KRAS G12C変異を有する既治療切除不能大腸癌に対するSotorasib+Panitumumab+FOLFIRI併用療法の長期安全性および有効性:第Ib相CodeBreaK 101試験
Long-term safety and efficacy of sotorasib plus panitumumab and FOLFIRI for previously treated KRAS G12C-mutated metastatic colorectal cancer: CodeBreaK 101 (phase 1b)
John H. Strickler, et al.
監修コメント
KRAS G12C変異陽性の切除不能大腸癌(mCRC)に対しては、近年、KRAS G12C阻害薬と抗EGFR抗体薬、さらには化学療法との併用による治療戦略が模索されている。KRAS G12C阻害薬Sotorasibと抗EGFR抗体薬Panitumumabの二剤併用は、CodeBreaK 300試験1)の結果に基づき、本邦でも承認申請中である。
本演題では、CodeBreaK 101試験のうち二次治療以降でのSotorasib+Panitumumab+FOLFIRIに関する長期成績が報告された。先行して報告されていた有効性・安全性データに加え、成熟した無増悪生存期間(PFS)および全生存期間(OS)データが提示された。奏効率(ORR)57.5%、PFS中央値8.2カ月、OS中央値15.6カ月という有効性は、mCRC二次治療の既存レジメンの有効性を凌駕する結果であり、比較試験の結果を待つ必要はあるものの、二次治療での有望な治療選択肢となり得ることを示唆している。
一方、grade 3以上の有害事象は50%と高頻度であり、またFOLFIRIに起因すると考えられる好中球減少や消化器毒性が、Sotorasibの中断・減量につながっている。KRAS G12C阻害薬の薬効は曝露量に依存し、減量や中断はRAS-GTPの再活性化や耐性獲得が懸念される。そのため、化学療法の併用が却って治療効果を損なうリスクも孕んでいる点は留意が必要である。
現在、一次治療としての有効性を検証する第III相CodeBreaK 301試験が進行中であり、同試験がpositiveな結果を示せば、本併用療法がKRAS G12C変異陽性mCRCに対する新たな一次治療の標準となるだろう。しかしながら、併用レジメンがFOLFOXではなくFOLFIRIである点は気になる。現在の実臨床では、RAS/BRAF遺伝子検査の結果を待たずにFOLFOXを先行投与し、結果判明次第、分子標的薬を追加する戦略が広く採用されている。そのため、FOLFIRIがベースレジメンとして設定されている場合、このような柔軟な対応が困難となる。なぜFOLFOXではなくFOLFIRIが選択されたのか。その理由は明らかではないが、治療導入時の選択肢やフローに大きく影響する点で、実地診療に展開された際の運用上の課題となり得る。
なお、Sotorasibは第一世代のKRAS G12C阻害薬であるが、本演題と同一セッションでは、“次世代”とされるOlomorasibやMK-1084に関する報告もなされていた。今後のさらなる開発が期待される。
(愛知県がんセンター 薬物療法部 医長 谷口 浩也)
KRAS G12C変異陽性の切除不能大腸癌に対するSotorasib+PanitumumabとFOLFIRIの併用療法
Sotorasib(KRAS G12C阻害薬)とPanitumumab(抗EGFR抗体)の併用は、KRAS G12C変異を有する治療抵抗性の切除不能大腸癌(mCRC)に対して、CodeBreaK 300試験に基づき承認されている1)。これにFOLFIRIを加えることで、耐性クローンの出現を分子レベルで抑制し、治療成績の向上が期待されている。また、毒性の重複が少ないことから、忍容性の高いレジメンと考えられている1-3)。この治療法は、第Ib相CodeBreaK 101試験の一部であるサブプロトコールHコホートGにおいて、二次治療以降を対象に有効性と安全性が検討され、良好な奏効率が示される一方、予期しない毒性は認められなかった4,5)。
本報告では、追跡期間が延長されたことにより得られた、無増悪生存期間(PFS)、全生存期間(OS)、および、更新された安全性および奏効データが示された。
主要評価項目は安全性・忍容性、副次評価項目として抗腫瘍効果を検討
主な適格基準は、各施設でKRAS G12C変異が確認されたmCRCであること、KRAS G12C阻害薬未使用であること、1レジメン以上の治療歴があること、Fluoropyrimidine系またはIrinotecanを使用していた場合にそれらの毒性による減量や投与遅延がないこと、などであった。Sotorasib 960mgを1日1回、Panitumumab 6mg/kgを2週ごと、FOLFIRIを2週ごとに投与し、病勢進行、同意撤回、または試験終了まで継続された。
主要評価項目は安全性および忍容性、副次評価項目は奏効率(ORR)、病勢コントロール率(DCR)、奏効期間(DOR)、奏効までの期間(TTR)、PFS、OSならびに薬物動態(PK)であった。
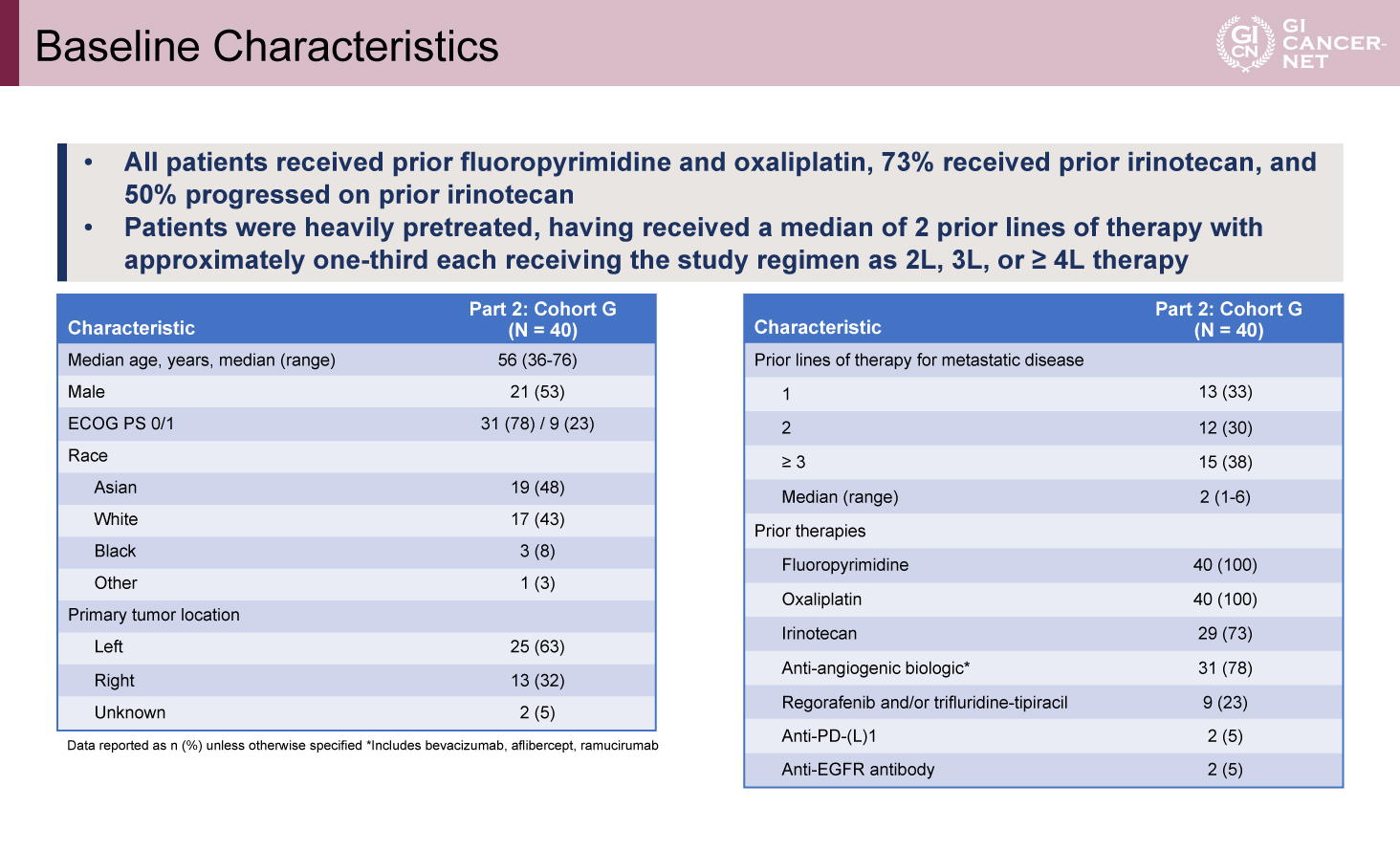
本コホートには40例が登録された。全例がFluoropyrimidine系およびOxaliplatinの前治療を受け、73%はIrinotecanの治療歴があり、50%はIrinotecan治療中に増悪していた。前治療ライン数の中央値は2であった。治療ライン別の内訳は、二次治療33%、三次治療30%、四次治療以降38%であった(表)。
表 Baseline Characteristics(発表者の許可を得て掲載)
奏効率・PFS・OSはいずれも良好、予期しない毒性は認めず
治療効果は、確定されたORR(全例部分奏効)57.5%(95%信頼区間[CI]40.9-73.0)、DCR 92.5%(95% CI: 79.6-98.4)、DOR中央値6.6カ月(95% CI: 5.5-9.7)であった。前治療ライン数が少ない患者ほど奏効率は高く(治療ライン1:69.2%、治療ライン2:58.3%、治療ライン3以上:46.7%)、また、Irinotecan治療中に病勢進行を認めた患者においても奏効率55.0%と高かった。
追跡期間中央値19.6カ月時点でのPFS中央値は8.2カ月(95% CI: 7.0-10.8)であり、前治療の内容にかかわらず、一貫した結果が得られた(図1)。
OSについては、追跡期間中央値32.7カ月時点での全体の中央値は15.6カ月(95% CI: 12.9-23.3)であった。治療ライン別では、二次治療ではOS中央値22.0カ月(95% CI: 6.7-31.7)、三次治療以降では14.7カ月(95% CI: 9.9-22.2)であった(図2)。
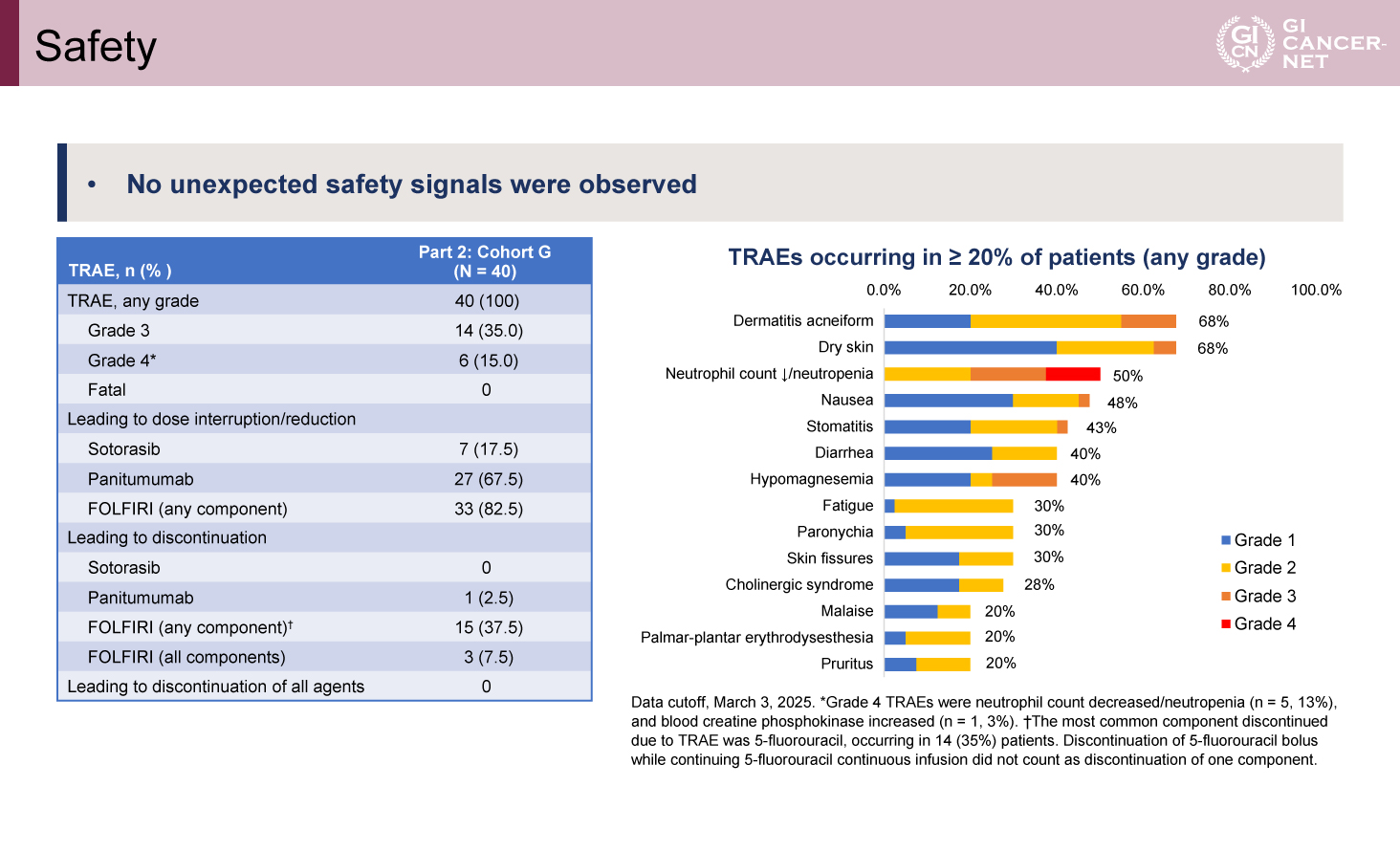
安全性に関しては、予期しない有害事象のシグナルは認められなかった。治療関連副作用(TRAE)はGrade 3が14例(35.0%)、Grade 4が6例(15.0%)で、治療関連死は認めなかった。TRAEによるSotorasibの減量/中断は7例(17.5%)であったが、投与中止例は認めなかった。Panitumumabの減量/中断は27例(67.5%)、投与中止は1例(2.5%)、FOLFIRIのすべての投与中止は3例(7.5%)であった。頻度の高いTRAEは、ざ瘡様皮疹および皮膚乾燥がそれぞれ68%、好中球減少症が50.0%にみられ、そのほかに消化器毒性などが続いた(図3)。
図1 Progression-free Survival(発表者の許可を得て掲載)
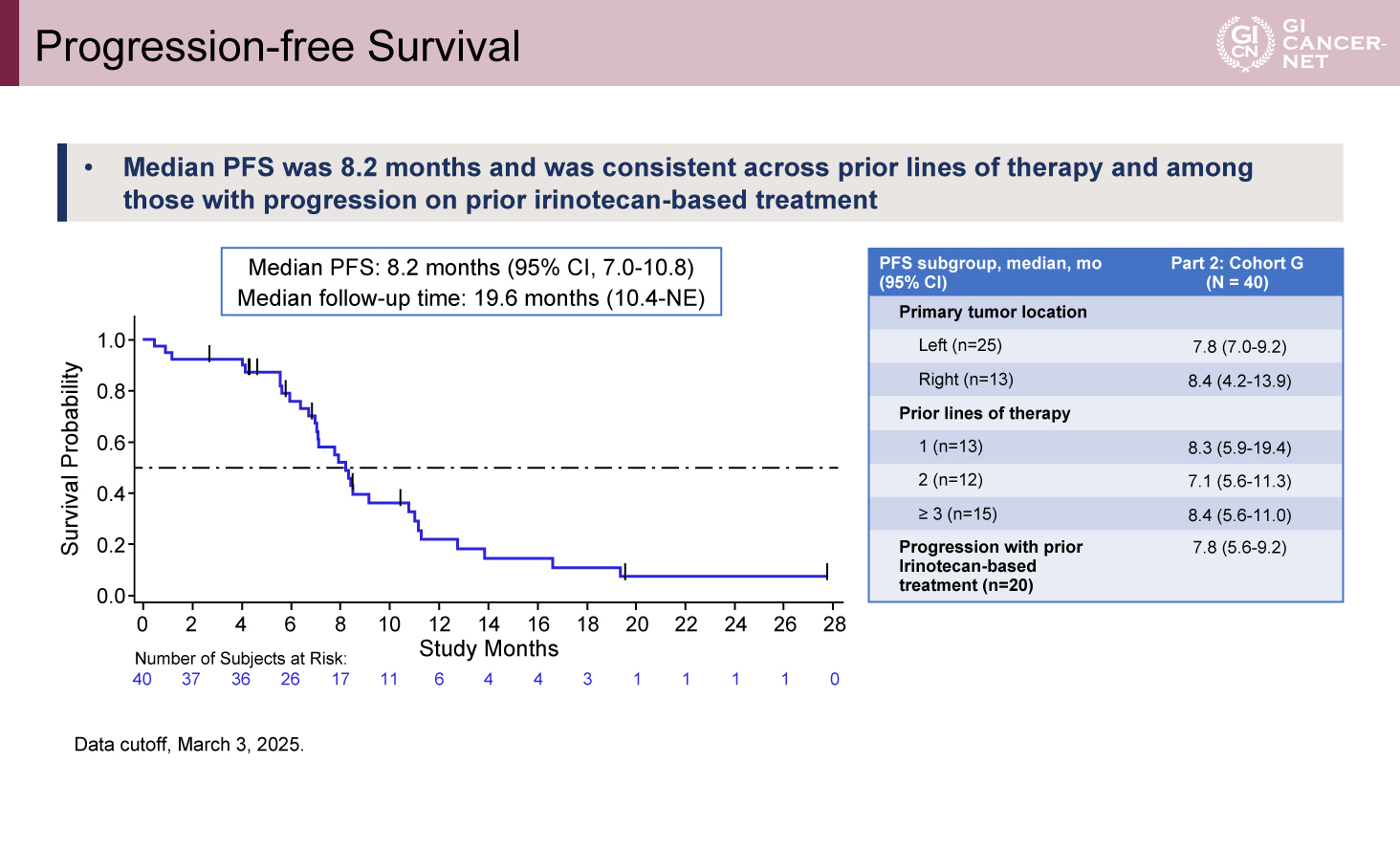
図2 Overall Survival(発表者の許可を得て掲載)
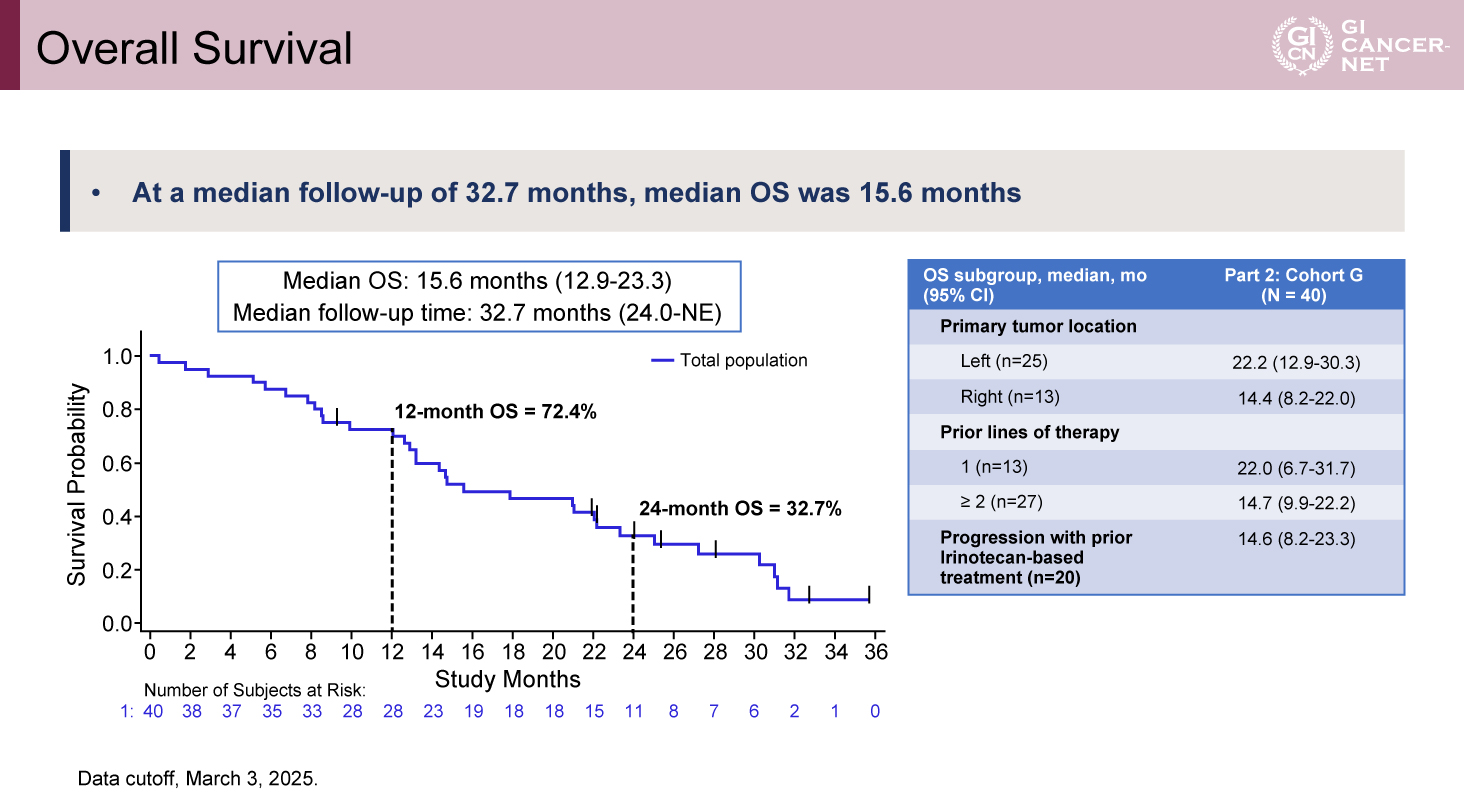
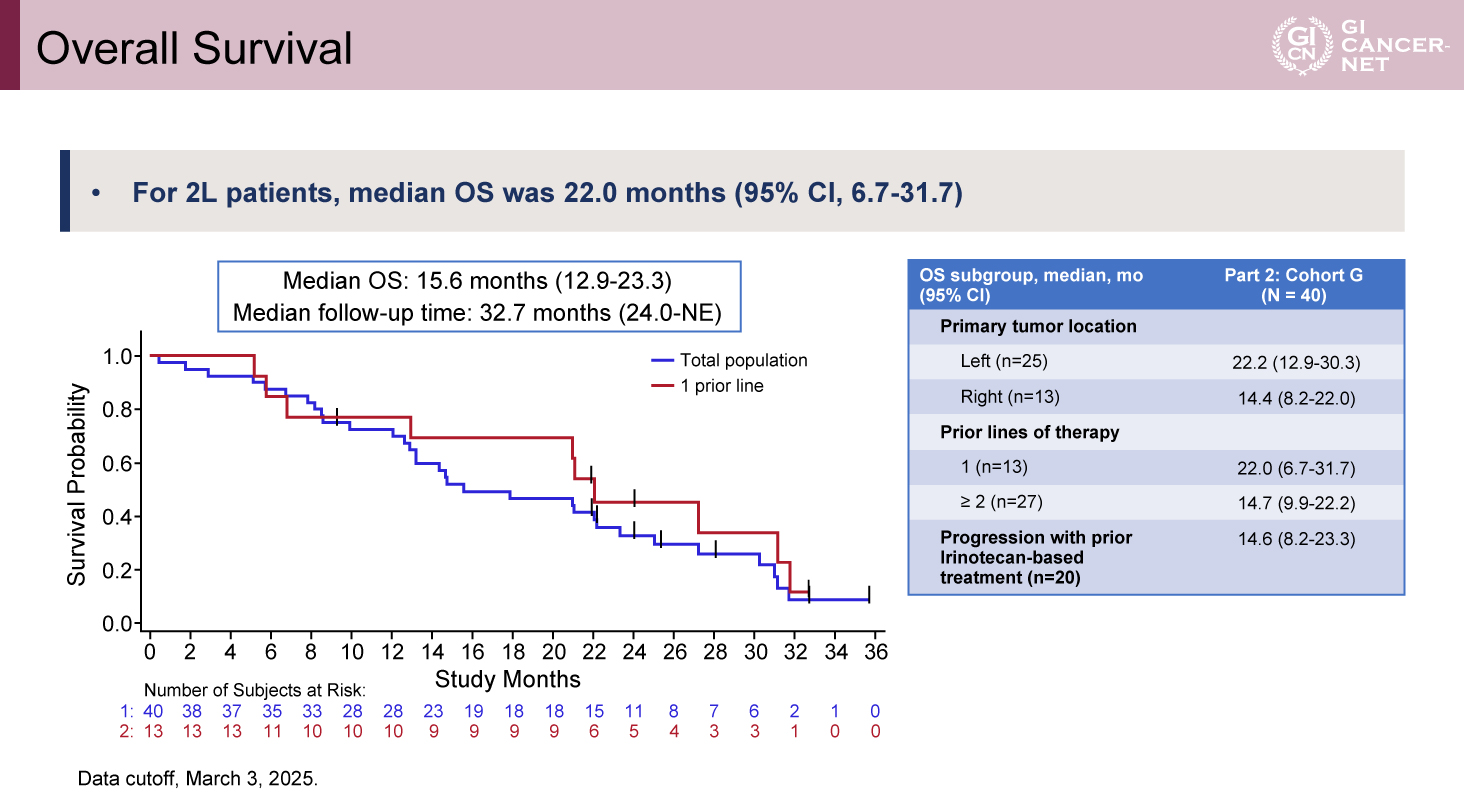
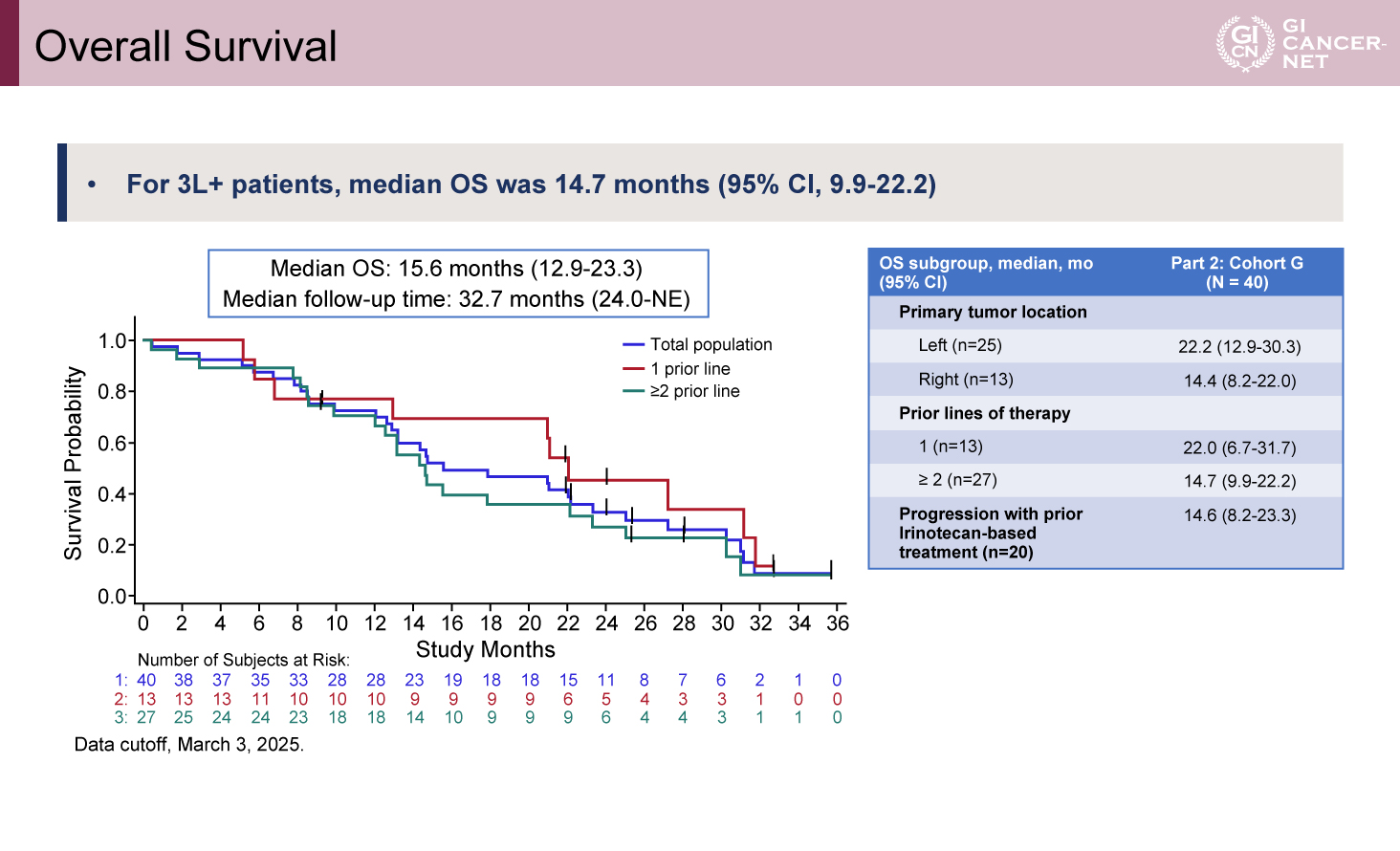
図3 Safety(発表者の許可を得て掲載)
結論
Sotorasib+Panitumumab+FOLFIRI併用療法は、二次治療以降のKRAS G12C変異陽性mCRCに対して、有望な有効性と安全性を示した。現在、このレジメンを一次治療として検証する第III相試験であるCodeBreaK 301試験(NCT06252649)が進行中である。
(レポート:愛知県がんセンター 薬物療法部 水野 太朗)
References
1) Fakih MG, et al.: N Engl J Med. 389(23): 2125-2139, 2023[PubMed]
2) Hong DS, et al.: Cancer Res. 83(7_Supplement): 2308-2308, 2023[Cancer Res]
3) Peeters M, et al.: J Clin Oncol. 28(31): 4706-4713, 2010[PubMed]
4) Hong DS, et al.: J Clin Oncol. 41(16_suppl): Abstract 3513, 2023[J Clin Oncol]
5) Masuishi T, et al.: Ann Oncol. 35(Supplement 4): S1432, 2024[Ann Oncol]
関連サイト
・CodeBreaK 301試験[ClinicalTrials.gov]
谷口 浩也先生
愛知県がんセンター 薬物療法部 医長