RAS/BRAF野生型切除不能大腸癌に対する初回治療としてのmodified FOLFOXIRI+Panitumumab療法とFOLFOX+Panitumumab療法の比較:TRIPLETE試験の全生存期間結果
Upfront modified FOLFOXIRI plus panitumumab(pan) versus FLFOX/pan for unresectable RAS and BRAF wild-type mCRC: overall survival results from the phase III TRIPLETE study by GONO
Veronica Conca, et al.
監修コメント
TRIPLETE試験のアップデート解析が発表され、演題の結語にもあったように、RAS野生型切除不能大腸癌の一次治療において「mFOLFOXIRI+抗EGFR抗体薬」治療を再検討すべきということが提案された。この試験は、mFOLFOXIRI+Panitumumab療法とFOLFOX+Panitumumab療法を比較し、抗EGFR抗体薬を使用する際にtripletレジメンとの併用が有用かどうかを検証する貴重な第III相試験であった。主要評価項目であるORRがmetせず、PFSも差がなかったことから、ESMOガイドラインではRAS野生型mCRCに対する1次治療でtriplet+抗EGFR抗体薬治療は完全に否定されることになった1,2)。しかし、今回のOSアップデート解析の結果、mFOLFOXIRI+Panitumumab療法が有意に良好なことが示され、GONOグループはその結果を真摯に受け止め、「再検討すべき」と結論付けたことは称賛したい。
今回の解析で有意なOS延長効果が示された一方で、他の有効性指標(ORR、PFS、ETS、DoR、R0切除率)には群間差がなく、OSのみが改善したという結果はどのようにディスカッションすべきか。会場から質問があったが、発表者自身もこの結果の明確な理由は現時点では不明であり、今後の検討課題であると述べていた。
日本ではJACCROにてmFOLFOXIRIにCetuximabまたはBevacizumabを併用した第II相ランダム化DEEPER試験が実施され、Cetuximab併用群で腫瘍縮小率の有意な改善とPFSの延長、50カ月を超える良好なOS結果が示されている3)。特に、肝限局転移を有さない、すなわち、肝臓だけに転移がとどまっていない症例において、triplet+抗EGFR抗体薬の効果が顕著であり、このサブ解析の結果はTRIPLETE試験でも同じことが示されていた。腫瘍縮小率が高い治療は、全身の腫瘍をコントロールすることによって予後を延長する効果が発揮される、このような効果がOS延長という形で現れるのではないかと妄想する。今後の両試験のさまざまな解析からさらにディスカッションしていきたい。
今回の結果より、全身状態が良好なRAS/BRAF野生型かつ左側mCRC患者において、mFOLFOXIRI+抗EGFR抗体薬が初回治療の有力な選択肢の一つとして再評価される可能性を期待したい。
(聖マリアンナ医科大学 臨床腫瘍学講座 主任教授 砂川 優)
TRIPLETE試験:RAS/BRAF野生型切除不能大腸癌に対する初回治療として、triplet+抗EGFR抗体薬の意義を検証した第III相試験
pMMR/MSS、RAS/BRAF野生型、左側の切除不能大腸癌(mCRC)に対する標準的な一次治療は、抗EGFR抗体薬(CetuximabまたはPanitumumab)と二剤の殺細胞性抗癌薬(FOLFOXまたはFOLFIRI)との併用療法とされている。イタリアのGONOグループで行われた第III相のTRIPLETE試験では、RAS/BRAF野生型のmCRCに対し、三剤の殺細胞性抗癌薬レジメンであるmodified FOLFOXIRI(mFOLFOXIRI)とPanitumumabとの併用療法とFOLFOX+Panitumumab療法の有効性が比較された。
本試験の主要評価項目である客観的奏効率(ORR)において、mFOLFOXIRI+Panitumumab療法は改善を示さず、また副次評価項目である無増悪生存期間(PFS)、早期腫瘍縮小率(ETS)、腫瘍縮小率(DoR)、R0切除率などにおいても優位性は認められなかった。加えて、三剤の殺細胞性抗癌薬を併用することによる消化管毒性の増加も報告されている。今回は、主解析時点ではimmatureであった全生存期間(OS)に関してのアップデート解析結果が報告された。
TRIPLETEの試験デザイン
未治療、RAS/BRAF野生型、測定可能病変を有する、18〜75歳、ECOG PSが2以下(71〜75歳の場合はPS 0-1に限定)のmCRC患者が、mFOLFOXIRI+Panitumumab(試験治療群)とFOLFOX+Panitumumab(対照治療群)の2群に1:1で無作為に割り付けられた。いずれも最大12サイクルまで投与され、その後は病勢進行(PD)まで5-FU/LV+Panitumumabによる維持療法が行われた。
主要評価項目は、ITT集団におけるORRであり、副次評価項目にはPFS、OS、ETS、DoR、R0切除率、安全性などが含まれていた。層別化因子には、ECOG PS(0-1 vs 2)、原発巣の部位(右側 vs 左側)、および肝限局転移の有無が用いられた。
今回のアップデート解析でmFOLFOXIRI+Panitumumab療法の有意なOS延長効果が報告された
本試験には計435例が登録された(mFOLFOXIRI+Panitumumab群:218例、FOLFOX+Panitumumab群;217例)。年齢中央値は両群とも59歳、ECOG PS 0-1の割合がmFOLFOXIRI+Panitumumab群で84%、FOLFOX+Panitumumab群で80%であった。その他の患者背景も両群でバランスが保たれていた。
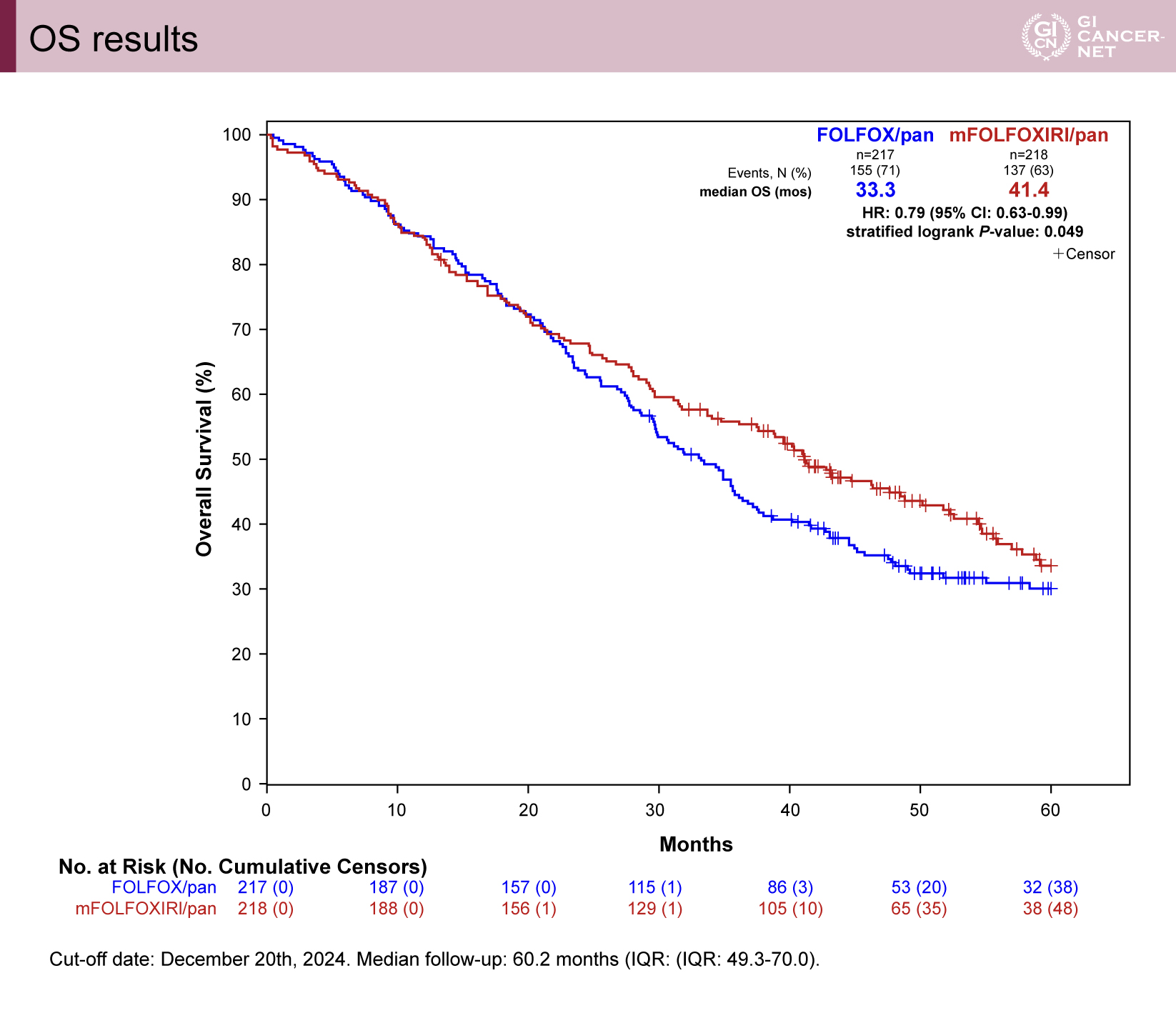
追跡期間中央値60.2カ月の時点でOSのアップデート解析が行われた。その結果、mFOLFOXIRI+Panitumumab療法はFOLFOX+Panitumumab療法と比較して有意なOS延長効果を示した(中央値:41.1カ月 vs 33.3カ月、ハザード比[HR]0.79、95%信頼区間[CI]0.63-0.99、層別ログランク検定によるp=0.049)(図1)。
OSにおけるサブグループ解析では、性別、ECOG PS、補助化学療法歴、原発巣の部位、原発巣の切除歴、転移のタイミング、転移臓器数、肝限局転移の有無、粘液癌の有無など、主要な臨床的サブグループ間での効果の一貫性が評価された。いずれの臨床的因子も治療法との間にOSにおける有意な相互作用(interaction)は確認されなかった。
図1 OS results(発表者の許可を得て掲載)
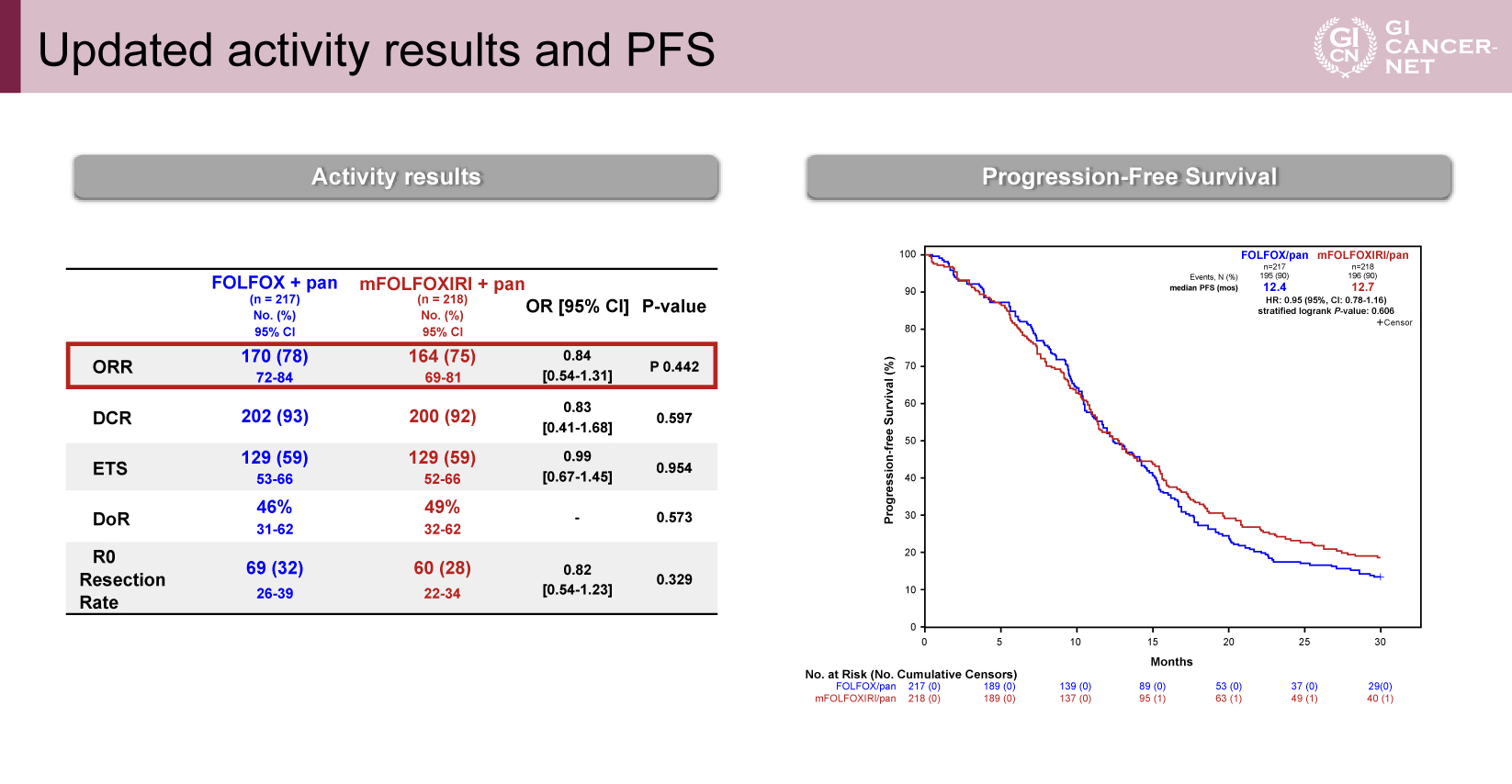
後治療移行割合およびOS以外の有効性の結果は両群で同等
後治療移行割合は両群で同程度であった(二次/三次/四次治療移行割合:mFOLFOXIRI+Panitumumab群71%/49%/32%、FOLFOX+Panitumumab群73%/51%/31%)。また、根治的な局所治療は、両群とも16%の症例で実施されていた。
OS以外の有効性に関してもアップデート解析結果が報告された。ORR(mFOLFOXIRI+Panitumumab 75% vs FOLFOX+Panitumumab 78%、p=0.442)、病勢制御率(92% vs 93%、p=0.597)、ETS(59% vs 59%、p=0.954)、DoR(49% vs 46%、p=0.573)、R0切除率(28% vs 32%、p=0.329)と、いずれも両群間での有意な差は認められなかった。また、PFSに関しても両群で同等の結果であった(中央値:12.7カ月 vs 12.4カ月、HR=0.95、95% CI: 0.78-1.16、p=0.606)(図2)。
図2 Updated activity results and PFS(発表者の許可を得て掲載)
結論
本試験のアップデート解析により、mFOLFOXIRI+Panitumumab療法がFOLFOX+Panitumumab療法と比較して、RAS/BRAF野生型のmCRC患者におけるOSを有意に延長することが示された。OS中央値の絶対差は7.8カ月に達し、臨床的にも意義のある生存延長効果と考えられる。この結果から、mFOLFOXIRI+Panitumumab療法は、RAS/BRAF野生型のmCRC患者に対する初回治療として再評価されるべき有効な選択肢であることが示唆された。
(レポート:聖マリアンナ医科大学 臨床腫瘍学講座 講師 新井 裕之)
References
1) Rossini D, et al.: J Clin Oncol. 40(25): 2878-2888, 2022[PubMed]
2) Cervantes A, et al.: Ann Oncol. 34(1): 10-32, 2023[PubMed]
3) Shiozawa M, et al.: Nat Commun. 15(1): 10217, 2024[PubMed]
関連サイト
・TRIPLETE試験[ClinicalTrials.gov]
砂川 優先生
聖マリアンナ医科大学
臨床腫瘍学講座 主任教授