Claudin18.2特異的CAR-T細胞療法(satri-cel)と主治医選択治療との比較:既治療進行胃癌・食道胃接合部癌を対象とした無作為化非盲検第II相試験(CT041-ST-01)の主要結果
Claudin18.2-specific CAR T cells (Satri-cel) versus treatment of physician's choice (TPC) for previously treated advanced gastric or gastroesophageal junction cancer (G/GEJC): Primary Results from a randomized, open-label, phase II trial (CT041-ST-01)
Changsong Qi, et al.
監修コメント
CAR-T細胞療法は、Chimeric Antigen Receptor-T細胞療法(キメラ抗原受容体T細胞療法)の略で、患者自身のT細胞を採取(アフェレーシス)し、遺伝子的に改変してがん細胞に対する攻撃性を強化したものを再度輸注する治療で、CD19を標的抗原として白血病やリンパ腫、BCMAを標的として多発性骨髄腫などに適応承認されているが、固形癌ではまだ承認されたものはない。
本試験は、Claudin18.2(CLDN18.2)を標的としたCAR-T細胞療法satri-celの有効性および安全性を、主治医選択治療と比較検証した、初の無作為化比較試験である。第I相試験では高い有効性を示し、衝撃を与えたが、今回もその有効性の高さを示した格好となる。
主要評価項目を無増悪生存期間(PFS:Progression Free Survival)に設定したのは、クロスオーバーを認めるデザインとし、患者登録を促進したいという狙いもあったと思われた。また、CAR-Tを製造する過程に時間がかかるため、1コースの化学療法を許容した点でもユニークである。
結果は、satri-cel群において、ITT集団でのPFSはHR=0.366と驚異的な差を認め、42%の患者がクロスオーバーした影響もあり、有意差はなかったものの、全生存期間(OS:Overall Survival)についてもHR=0.69と、臨床的意義のある改善を認めた。事前に規定されたサブグループ全体でOSおよびPFSにおける改善が示されており、本治療の汎用性を裏付ける結果と考えられる。また、satri-cel群に登録された104例中投与されたのが88例と、製造工程で規定のCAR-T細胞が得られないこともあり、治療が行われた集団(mITT)での解析も行われたが、PFS、OSにてより差が開いていた。
一方で、grade 3以上の治療関連有害事象(TRAE)は98.9%と高率で認められ、サイトカイン放出症候群(CRS:Cytokine Release Syndrome)の発現頻度も95.5%に達するなど、安全性面では十分な注意が必要である。幸いにもICANS(免疫エフェクター細胞関連神経毒性症候群)の発現は認められず、CRSの大多数はgrade 1/2にとどまったが、臨床への導入にあたっては、専門施設での慎重な対応が求められる。加えて、アフェレーシスから製造・投与に至る複雑なプロセス、長期間の治療準備期間、高コストといった現実的制約は、実際の現場での普及を妨げる一因となり得る。本試験の対象が全例中国人であったことも、本結果の外的妥当性を検討するうえでの制約であり、かつ現時点で日本と中国間での細胞療法のやり取りができない点も、今後の国際共同試験に向けて、解決すべき課題である。
CLDN18.2標的療法としては、さらにより低毒性で簡便な、ADC製剤(CMG901、IBI343)やBiTE抗体(IBI389)等の開発も進行しており、それらとの比較検討も期待される。
(国立がん研究センター中央病院 消化管内科/頭頸部・食道内科 科長 加藤 健)
進行胃・食道胃接合部癌におけるClaudin18.2を標的とした治療開発
Claudin18.2(CLDN18.2)は消化管腫瘍、特に胃癌および食道胃接合部癌(G/GEJC)において顕著に過剰発現しており、有望な治療標的として注目されている1)。Satri-cel/CT041は、自己由来のCLDN18.2特異的CAR-T細胞療法であり、既治療の進行G/GEJC患者を対象とした第I相試験において、有望な有効性が示されている2,3)。今回、satri-celの有効性および安全性を検討した第II相無作為化比較試験(CT041-ST-01)の主要結果が示された。
既治療例での主治医選択治療に対するsatri-celの優越性を検証
本試験は、中国において実施された非盲検の多施設共同無作為化比較試験である。主な適格基準は、18〜75歳、病理学的に確認された進行G/GEJC、少なくとも2ライン以上の治療に抵抗性であること、CLDN陽性(IHC 2+/3+、陽性腫瘍細胞が40%以上)、HER2陰性、ECOG PS 0-1などであった。被験者はSatri-cel群と主治医選択治療(TPC)群に2:1の比率で無作為に割り付けされた。Satri-cel群では全例アフェレーシスが施行され、1サイクルのbridging therapy(試験治療前に化学療法を実施すること)が許容された。Satri-celは、2億5000万個の細胞を1回量として、最大3回まで静脈内投与された。TPC群ではApatinib、Paclitaxel、Docetaxel、Irinotecan、Nivolumabのいずれかが投与され、病勢進行または忍容不能な毒性が認められた場合には、条件を満たせばsatri-celへのクロスオーバーが許容されていた。
主要評価項目は独立判定委員会(IRC)評価による無増悪生存期間(PFS)、主要な副次評価項目は全生存期間(OS)とされた。PFSについては、Satri-cel群とTPC群の比較においてHR=0.55を仮定し、TPC群のPFS中央値を3カ月と想定した。検出力84.7%、片側α=0.025を達成するためのサンプルサイズは150例とされた(図1)。
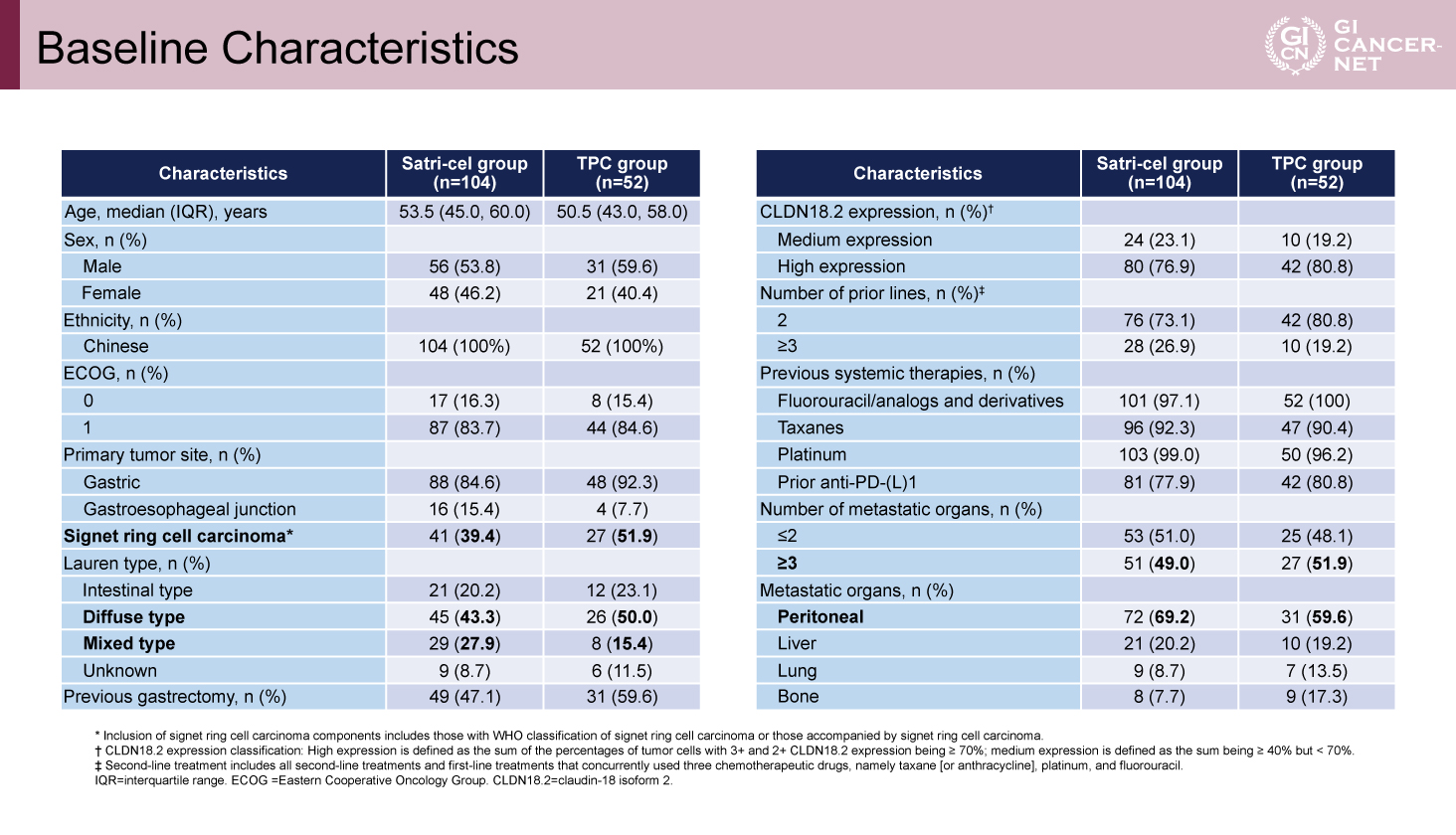
最終的に、Satri-cel群104例、TPC群52例の計156例が登録され(ITT集団)、Satri-cel群のうち88例、TPC群のうち48例が治療を受けた(mITT集団)。患者背景は両群で均衡がとれていた。Lauren分類のびまん型または混合型が多く(Satri-cel群71.2%、TPC群65.4%)、前治療ラインは2ラインが最多であった(Satri-cel群73.1%、TPC群80.8%)。また腹膜播種を有する割合も多かった(Satri-cel群69.2%、TPC群59.6%)(表)。
図1 Trial Design and Procedure schema(発表者の許可を得て掲載)
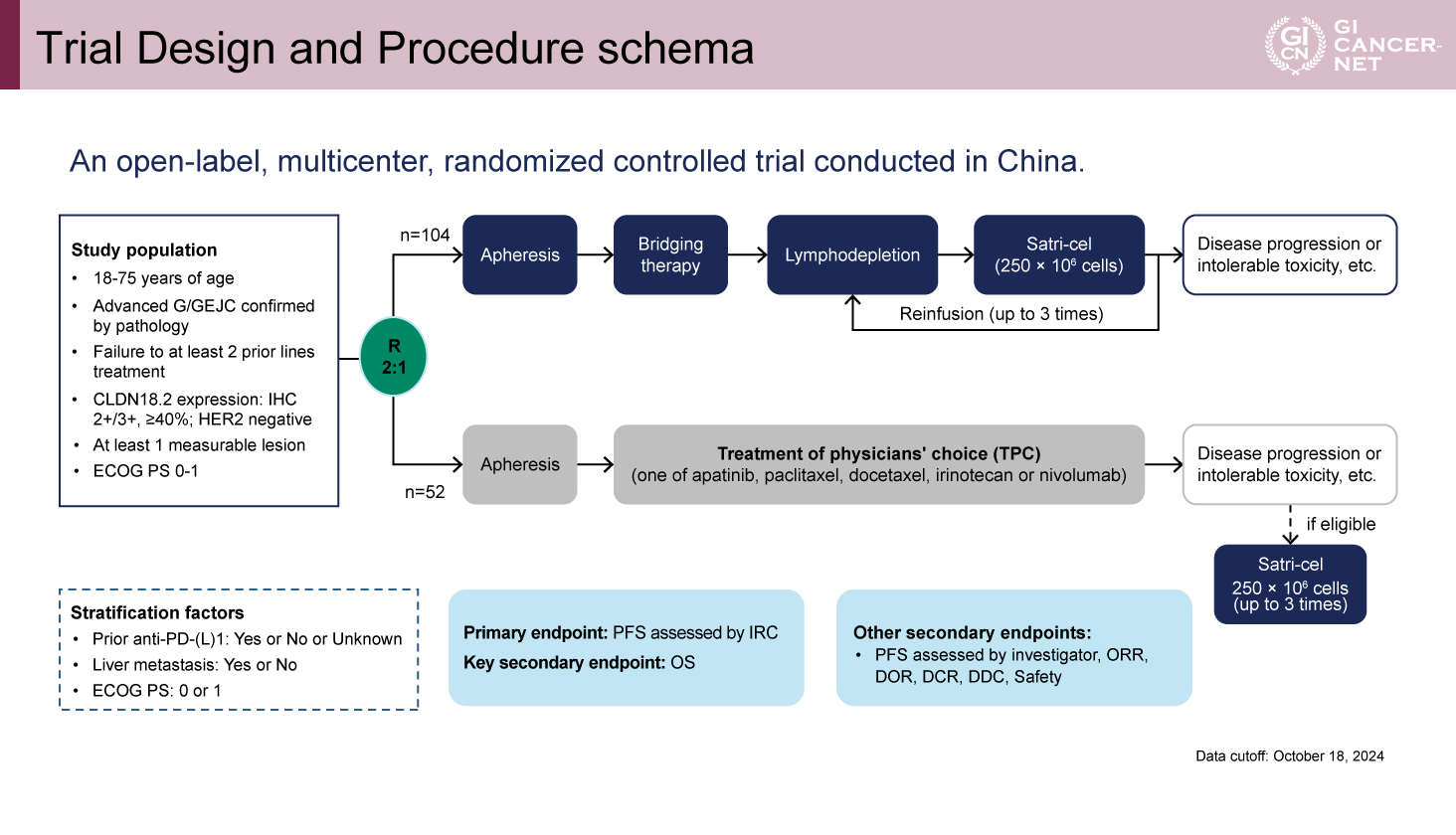
表 Baseline Characteristics(発表者の許可を得て掲載)
PFSはSatri-cel群で有意に延長、OSは有意差ないものの延長傾向
PFSの追跡期間中央値はSatri-cel群で9.07カ月、TPC群で3.45カ月であった。ITT集団におけるIRC評価によるPFS中央値は、Satri-cel群3.25カ月、TPC群1.77カ月と、Satri-cel群で有意な延長を認めた(HR=0.366、95% CI: 0.241-0.557、p<0.0001)。
OSの追跡期間中央値はSatri-cel群で14.42カ月、TPC群で11.33カ月であった。ITT集団でのOSに関しても、Satri-cel群で延長傾向が認められた(中央値7.92 vs 5.49カ月、HR=0.693、95% CI: 0.457-1.051、p=0.0416)。Satri-celによるPFSおよびOSのベネフィットは、事前に規定されたすべてのサブグループで認められた(図2、図3)。
mITT集団におけるPFS・OSの補足解析では、PFS中央値4.37カ月 vs 1.84カ月(HR=0.304、95% CI: 0.195-0.474)、OS中央値8.61カ月 vs 5.49カ月(HR=0.601、95% CI: 0.385-0.939)であり、いずれもSatri-cel群で明らかな延長を認めた。
TPC群のうち42%がsatri-celを後治療で受けており、クロスオーバーを補正するためにrank preserving structural failure time(RPSFT)モデルを用いたOSの解析が実施された。その結果、ITTおよびmITT集団において、Satri-cel群はTPC群に比して推定OS中央値が1.81〜2.06倍長く、死亡リスクはそれぞれ53%および63%低下していた(図4)。
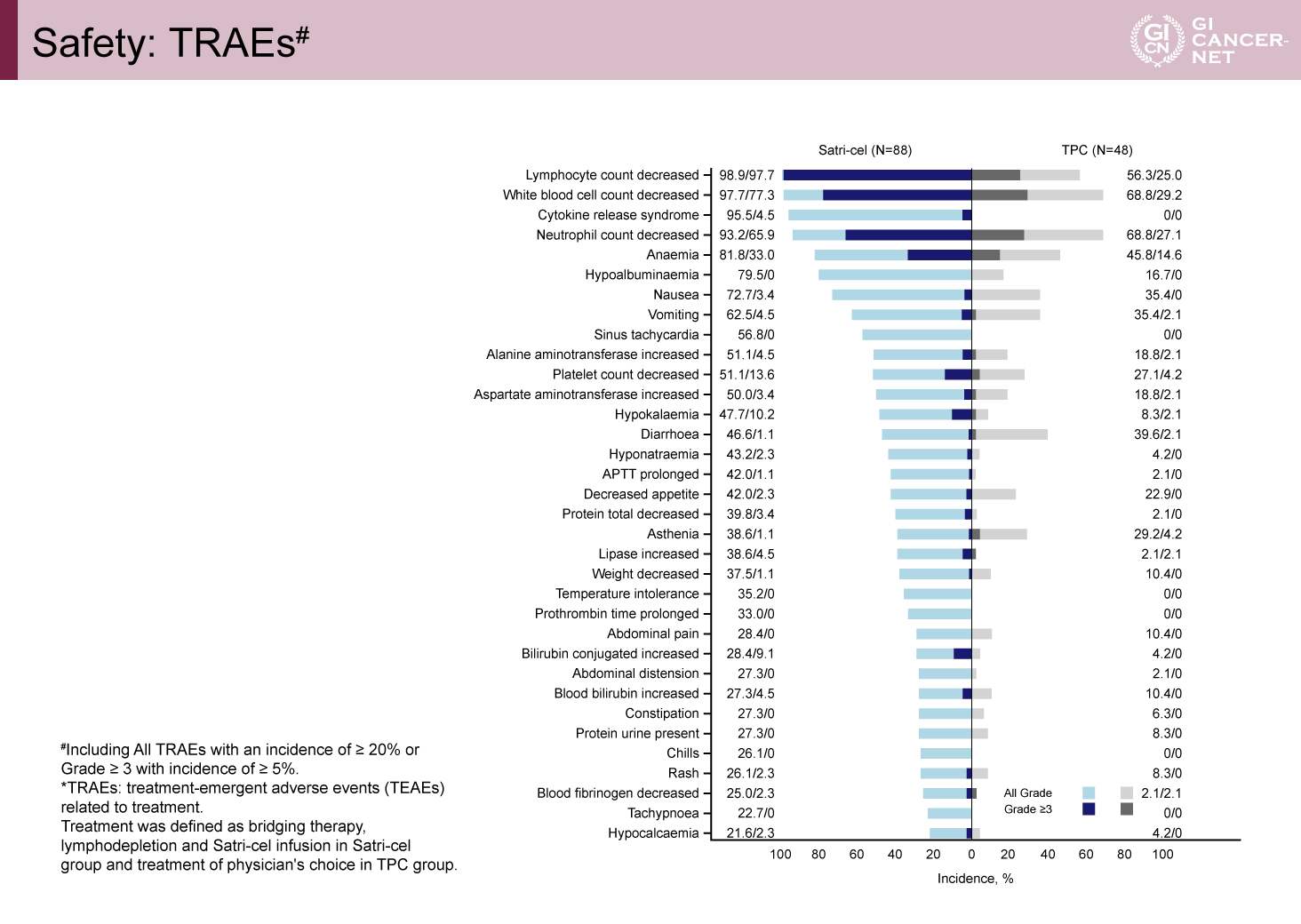
治療関連有害事象(TRAE)はSatri-cel群で100%、TPC群で91.7%に認められ、grade 3以上のTRAEは、それぞれ98.9%、56.3%であった。Satri-cel群において頻度の高かったTRAEは、リンパ球減少(98.9%)、白血球減少(97.7%)、およびサイトカイン放出症候群(CRS)(95.5%)であったが、grade 3以上のCRSは4.5%にとどまった。免疫エフェクター細胞関連神経毒性症候群(ICANS)は認められなかった(図5)。
図2 Primary Endpoint: PFS (ITT) assessed by IRC(発表者の許可を得て掲載)
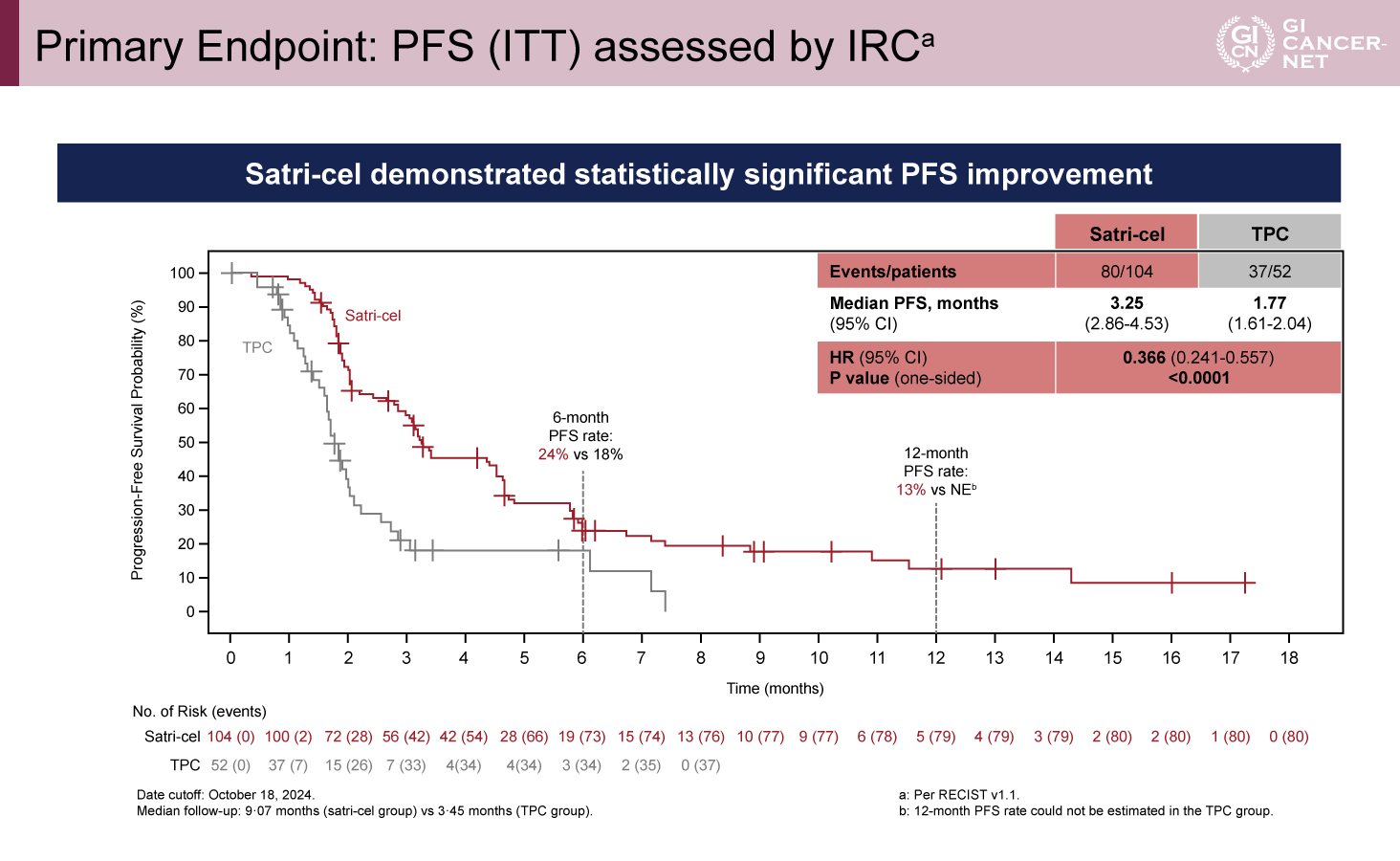
図3 Key Secondary Endpoint: OS (ITT)(発表者の許可を得て掲載)
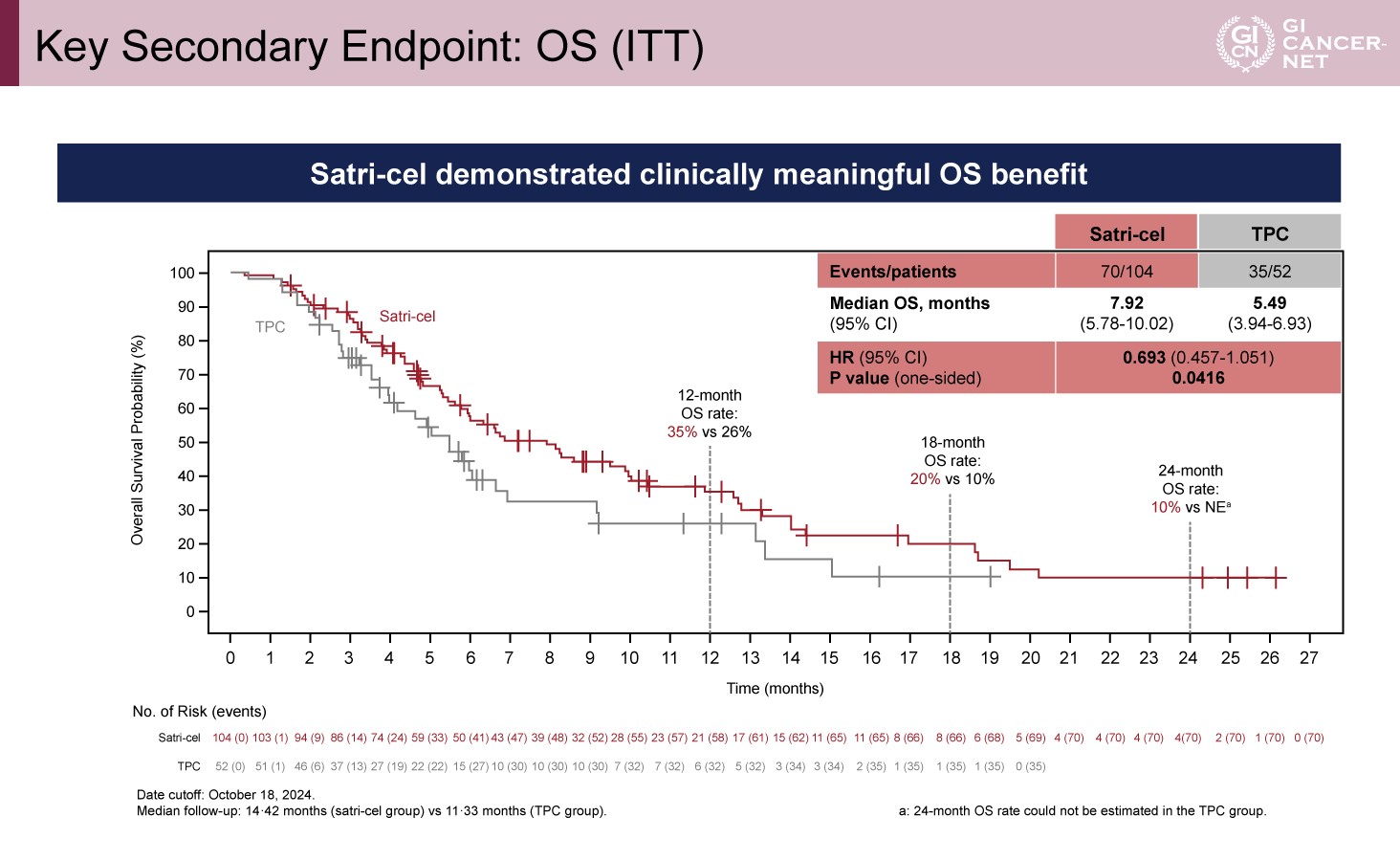
図4 Adjusting for treatment switching: OS analyzed by RPSFT model(発表者の許可を得て掲載)
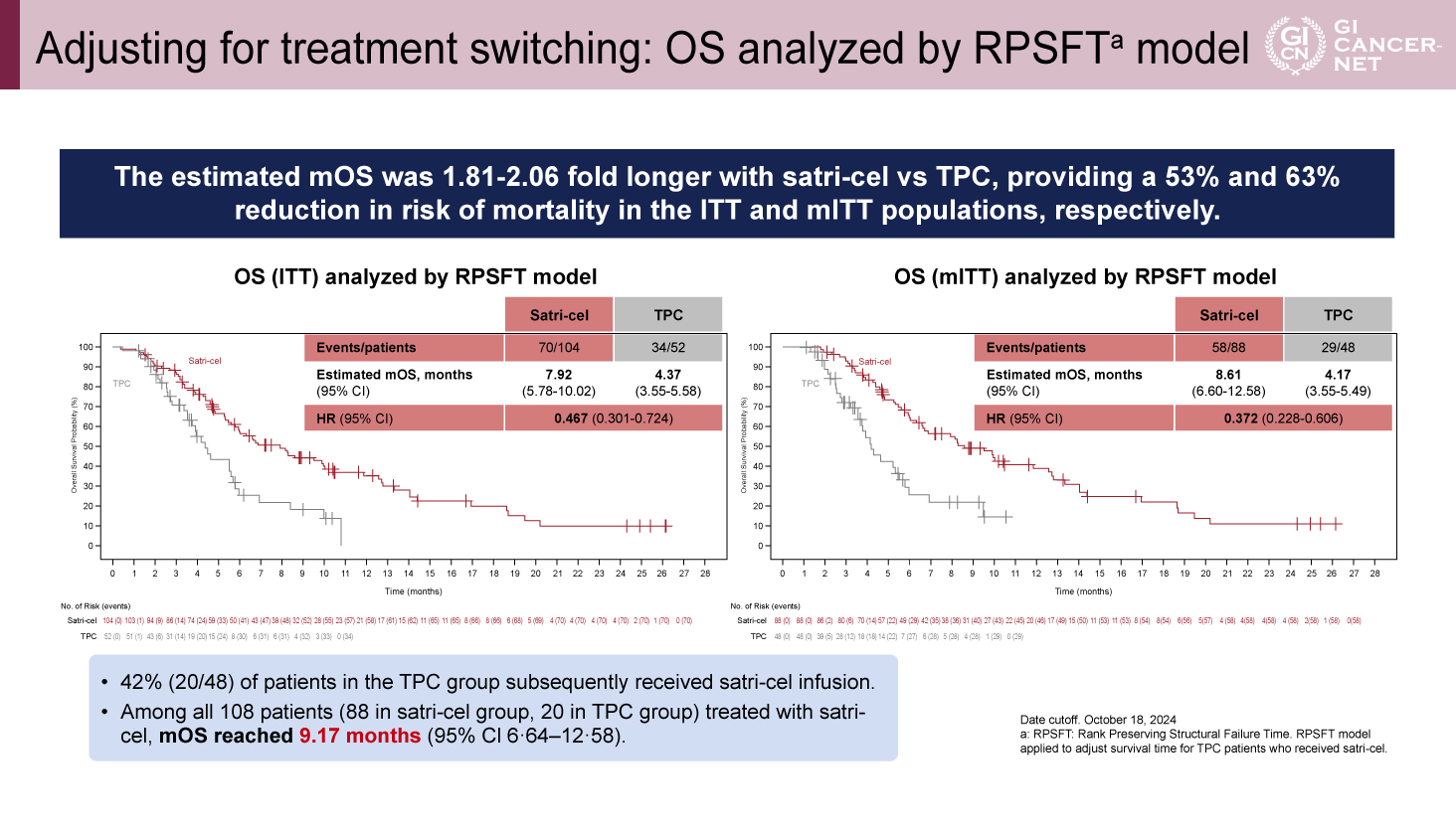
図5 Safety: TRAEs(発表者の許可を得て掲載)
結論
既治療の進行G/GEJC患者において、satri-celは標準治療と比較して、統計学的に有意なPFSの改善および臨床的に意義のあるOSの延長を示した。安全性プロファイルについても許容可能であり、satri-celが新たな治療選択肢となる可能性が示唆された。
(レポート:愛知県がんセンター 薬物療法部 水野 太朗)
References
1) Nakayama I, et al.: Nat Rev Clin Oncol. 21(5): 354-369, 2024[PubMed]
2) Qi C, et al.: Nat Med. 28(6): 1189-1198, 2022[PubMed]
3) Qi C, et al.: Nat Med. 30(8): 2224-2234, 2024[PubMed]
関連サイト
・CMG901[ClinicalTrials.gov]
・IBI343[ClinicalTrials.gov]
・IBI389[ClinicalTrials.gov]
・ILUSTRO試験[論文紹介]
加藤 健先生
国立がん研究センター中央病院 消化管内科/頭頸部・食道内科 科長