Stage IIIのDNAミスマッチ修復機能欠損(dMMR)結腸癌患者に対する術後補助療法としての標準化学療法単独またはAtezolizumab併用のランダム化試験(Alliance A021502:ATOMIC試験)
Randomized trial of standard chemotherapy alone or combined with atezolizumab as adjuvant therapy for patients with stage III deficient DNA mismatch repair (dMMR) colon cancer (Alliance A021502; ATOMIC)
Frank A. Sinicrope, et al.
監修コメント
『大腸癌治療ガイドライン2024年版』では、周術期薬物療法前にRAS、BRAFおよびミスマッチ修復機能欠損検査(MSIもしくはMMR-IHC)を行うことが新たに推奨された。しかし、これらの分子ステータスに応じた具体的なレジメン選択に関しては、現時点で明確な指針が示されていない。MSI-H/dMMR結腸癌は再発リスクが比較的低い一方、フッ化ピリミジン単独療法の効果が乏しいとされている。近年、切除不能例における免疫チェックポイント阻害薬(ICI)の有効性が確立され、直近では術前治療としてのICI投与の有用性を示唆する単群試験の結果も相次いで報告されている。
こうした流れを背景に登場したのが、本ATOMIC試験である。これは、術後補助療法としてのICIの有用性を検証した初の第III相試験であり、結果は極めて明快であった。Atezolizumabの併用により再発リスクが有意に低下し、ASCOプレナリーセッションにも採択されるなど、practice-changingなインパクトをもって受け止められている。米国ではすでに、実地診療への迅速な導入が現実味を帯びつつある。
その一方で、冷静な視点も求められる。注目すべきは、Atezolizumab併用群で認められたirAE(免疫関連有害事象)や治療関連死亡である。実際、この対象集団の約75%はICIを使用しなくとも再発しないと考えられており、そうした予後良好な集団に対し、1年間にわたるICI投与を行う意義については、慎重な議論が必要である。全生存期間(OS)のデータが成熟していないこと、さらに再発後のICI導入により根治も見込めることを考慮すれば、術後補助療法としての使用が“ベストタイミング”なのかは再考の余地がある。Discussantからも、「本当にFOLFOXが必要なのか?」「Atezolizumabを1年間も投与する根拠は?」といった過剰治療(overtreatment)の可能性を示唆する鋭い指摘がなされた。
本ATOMIC試験には日本からの参加も検討されたが、最終的には諸事情により見送られた。試験名“ATOMIC”には、「核となる変革」あるいは「小さくても強力な一撃」といった象徴的な意味が込められていると伺っているが、現時点ではこの成果を本邦に即時適用するのは難しいのが実情である。
一方、非小細胞肺癌やメラノーマの領域では、術後よりも術前にICIを使用するほうが高い効果を示すことが複数の試験で明らかになっており、この知見はdMMR大腸癌でも応用可能と考えられている。現在、日本も参加している国際共同第III相試験AZUR-2試験では、術前ICIの有効性が検証されており、その結果が今後の治療戦略を大きく左右する可能性がある。dMMR大腸癌における治療最適化を今後さらに推進するためには、術前段階で全例に対してMSIもしくはMMR-IHC検査を確実に実施できる体制を、診療科横断的に構築していくことが急務である。
(愛知県がんセンター 薬物療法部 医長 谷口 浩也)
dMMR Stage III結腸癌に 対する術後補助療法
Stage IIIの結腸癌に対しては、フッ化ピリミジン+Oxaliplatinによる術後補助化学療法が標準治療とされているが、再発率は依然として約30%と高い。全結腸癌の約15%程度を占めるDNAミスマッチ修復機能欠損(dMMR)結腸癌はStage IIIでは約10%を占めるが、この集団ではフッ化ピリミジン単剤による治療効果が限定的であり、より最適な治療戦略の確立が求められてきた1)。
一方、dMMR癌は多様な変異タンパク質により免疫原性が高く、転移・再発例では免疫チェックポイント阻害薬(ICI)の有効性が実証されている2,3)。しかしながら、術後補助療法としてのICIの有効性については、これまで明らかにされていなかった。
このような背景のもと、dMMR Stage III結腸癌に対する術後補助療法として、標準レジメンであるmFOLFOX6に抗PD-L1抗体薬Atezolizumabを併用する意義を第III相ランダム化比較試験で検証したのがATOMIC試験である。
試験デザイン
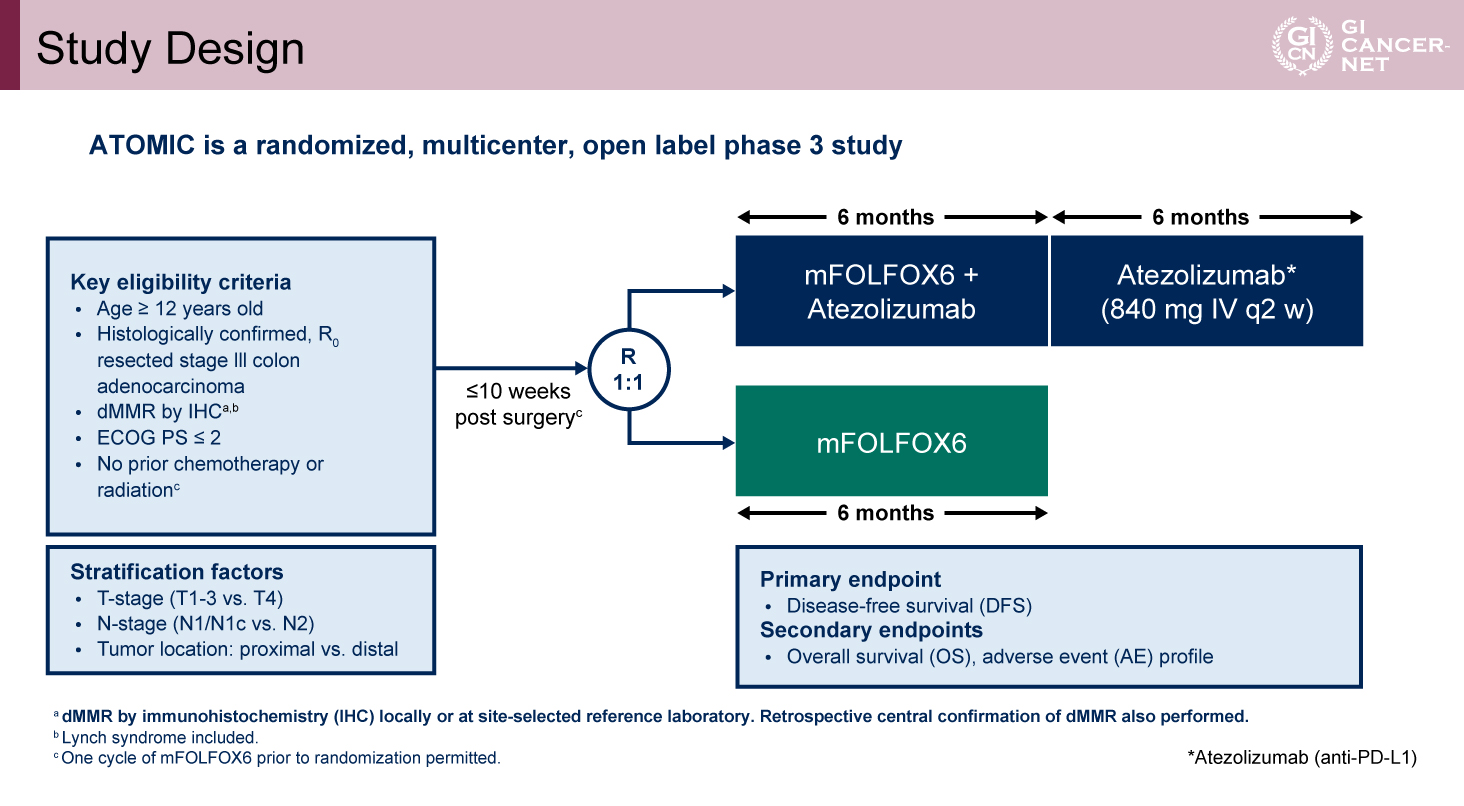
本試験は米国国立がん研究所(NCI)が支援する臨床試験部グループAllianceの多施設共同第III相試験である。対象は、12歳以上で化学療法や放射線治療の未施行例(ランダム化前1サイクルのmFOLFOX6は許容)であり、免疫組織化学染色によりdMMRが確認された、R0切除後のPS 0-2の結腸癌患者である。mFOLFOX6+Atezolizumab併用群(Atezolizumab併用群)またはmFOLFOX6単独群(標準治療群)に1:1で無作為に割り付けられた(図1)。
Atezolizumab併用群ではmFOLFOX6に加え、Atezolizumab(840mg、2週毎)を6カ月(12サイクル)投与した後、Atezolizumab単剤をさらに6カ月(13サイクル)継続した。層別化因子には、N因子、T因子、原発部位が用いられた。
主要評価項目は無病生存期間(DFS)であり、副次評価項目として全生存期間(OS)、有害事象が設定された。統計学的設定として、Atezolizumab併用により3年DFS率が75%から84%へ改善(ハザード比[HR]0.6)すると期待し、DFSイベント165件、片側有意水準0.025、検出力90%の条件下で、必要症例数は700例と算出された。
図1 Study Design(発表者の許可を得て掲載)
Atezolizumab併用群でDFSが有意に改善
2017年10月から2023年1月までの間に712例がランダム化され、Atezolizumab併用群では164例(46%)、標準治療群では213例(60%)がプロトコル通りに治療を完遂した。第2回中間解析において、DFSの群間比較のために実施された層別ログランク検定が、プロトコルで事前に定められていた中間解析の統計的有意水準(0.009)を超えたため、Allianceの効果安全性評価委員会が解析結果の公開を決定した。 データカットオフは2025年2月4日であり、追跡期間中央値は37.2カ月であった。
Atezolizumab併用群355例のうち、治療中断に至った症例は191例であり、主な理由は、有害事象(65例)および患者の意思による中止(71例)であった。なお、患者背景は再発リスクの高いT4症例やN2症例を含め、両群でおおむね均衡していた(表1)。
主要評価項目であるDFSについては、3年DFS率はAtezolizumab併用群で86.4%、標準治療群で76.6%と、Atezolizumab併用群で統計学的に有意な延長が認められた(p<0.0001、HR=0.50、95%信頼区間[CI]0.34-0.72)(図2)。さらに、年齢、T/N因子によるリスク分類など、各サブグループにおいても、ほぼ一貫してAtezolizumab併用による有効性を認めた(表2)。
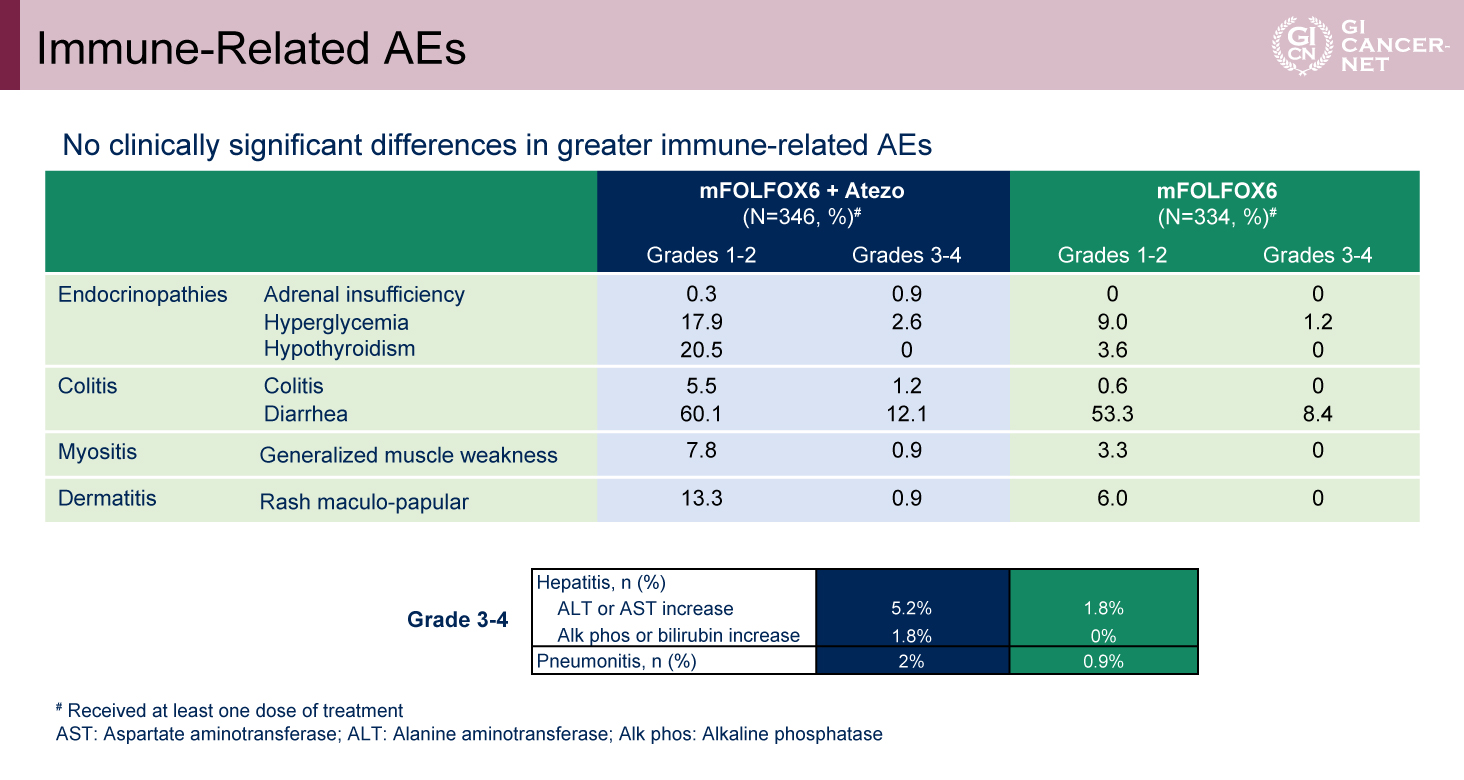
Grade 3/4の治療関連有害事象は、Atezolizumab併用群で72.3%、標準治療群で59.2%と併用群でやや高い傾向が認められた。治療関連死亡はAtezolizumab併用群でのみ2例報告された(表3)。主な有害事象のプロファイルは両群で概ね類似していたが、grade 4の好中球減少は標準治療群の6.9%に対し、Atezolizumab併用群で14.2%と高率であった(図3)。また、Atezolizumab併用群の免疫関連有害事象(irAE)の多くは、grade 1/2であった(表4)。
表1 Baseline Characteristics(発表者の許可を得て掲載)
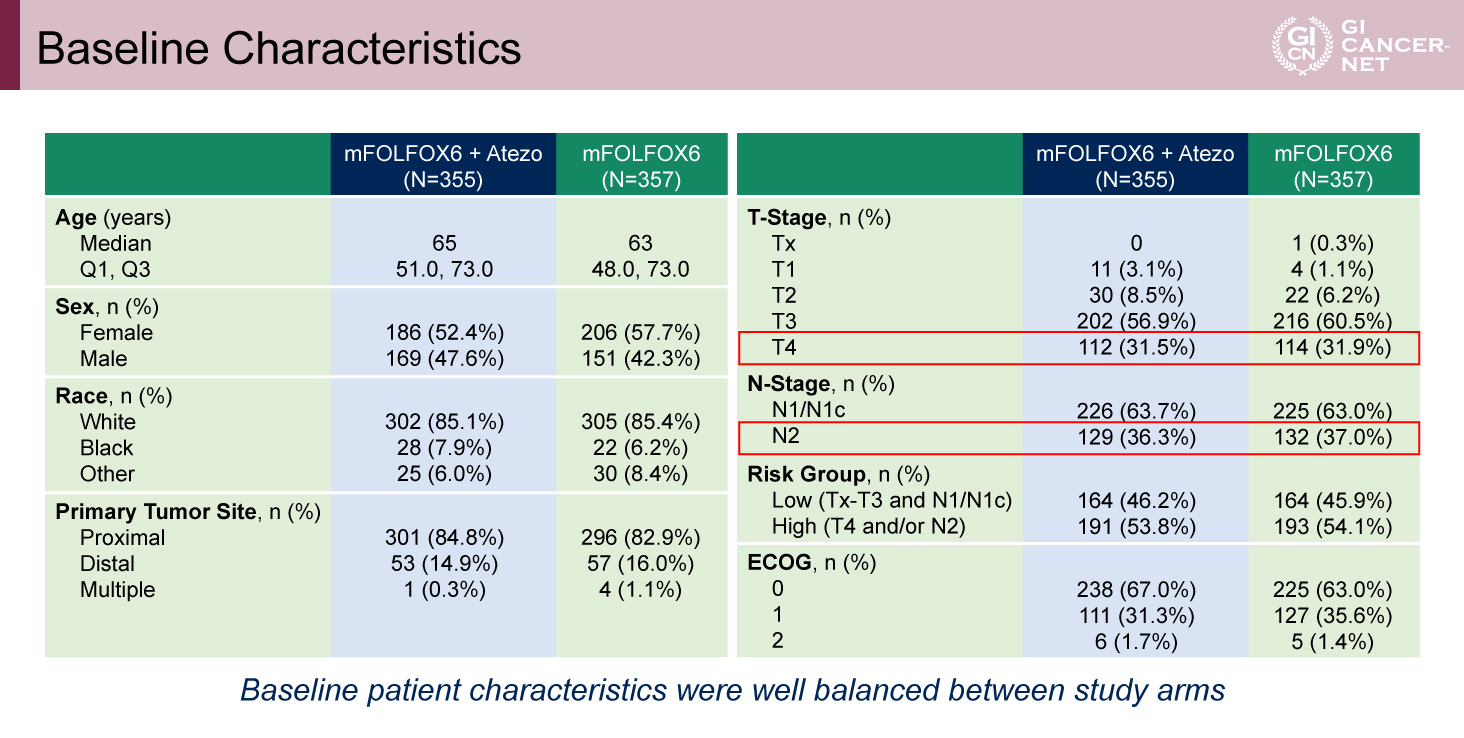
図2 Primary Endpoint: DFS(発表者の許可を得て掲載)
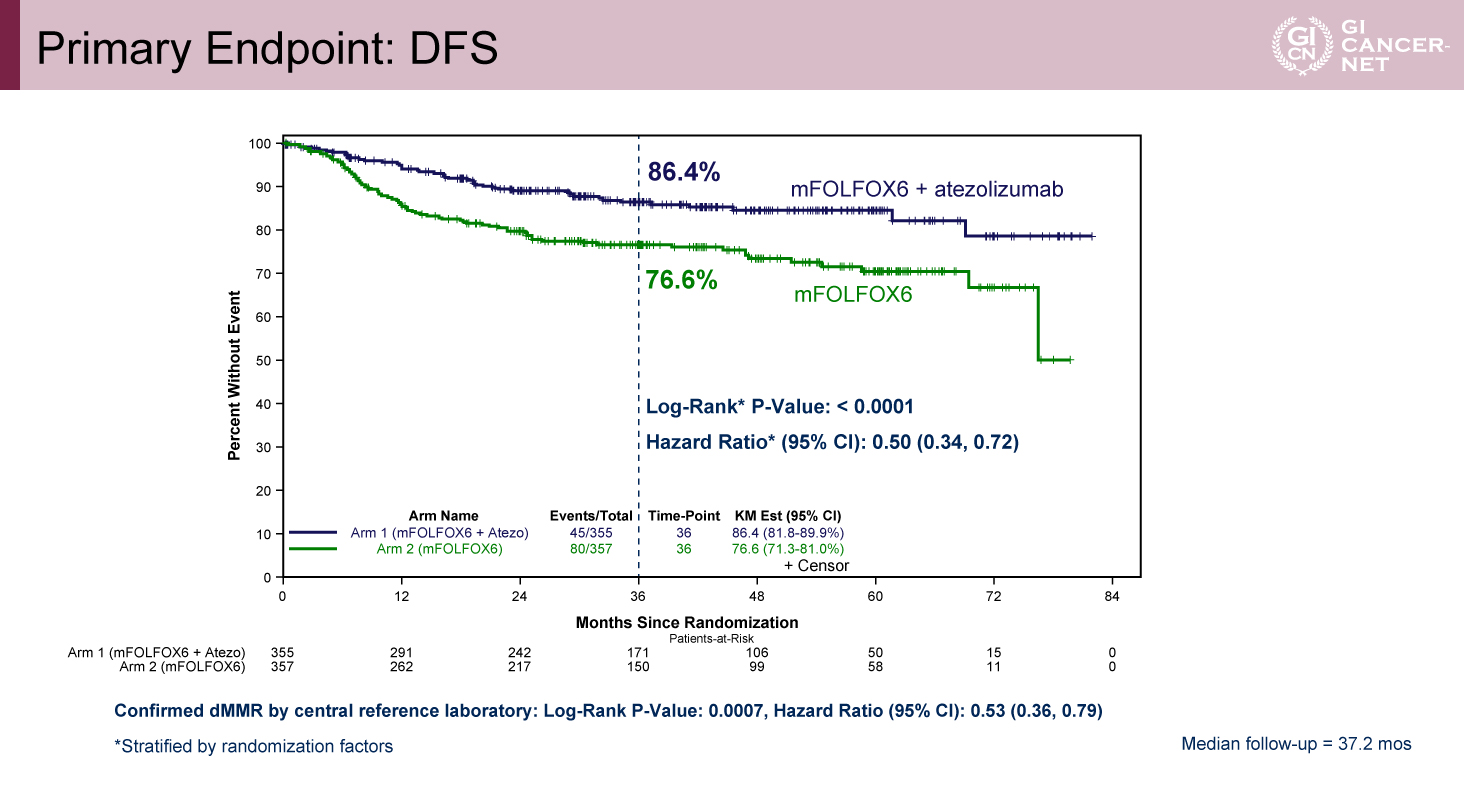
表2 DFS by Subgroups(発表者の許可を得て掲載)
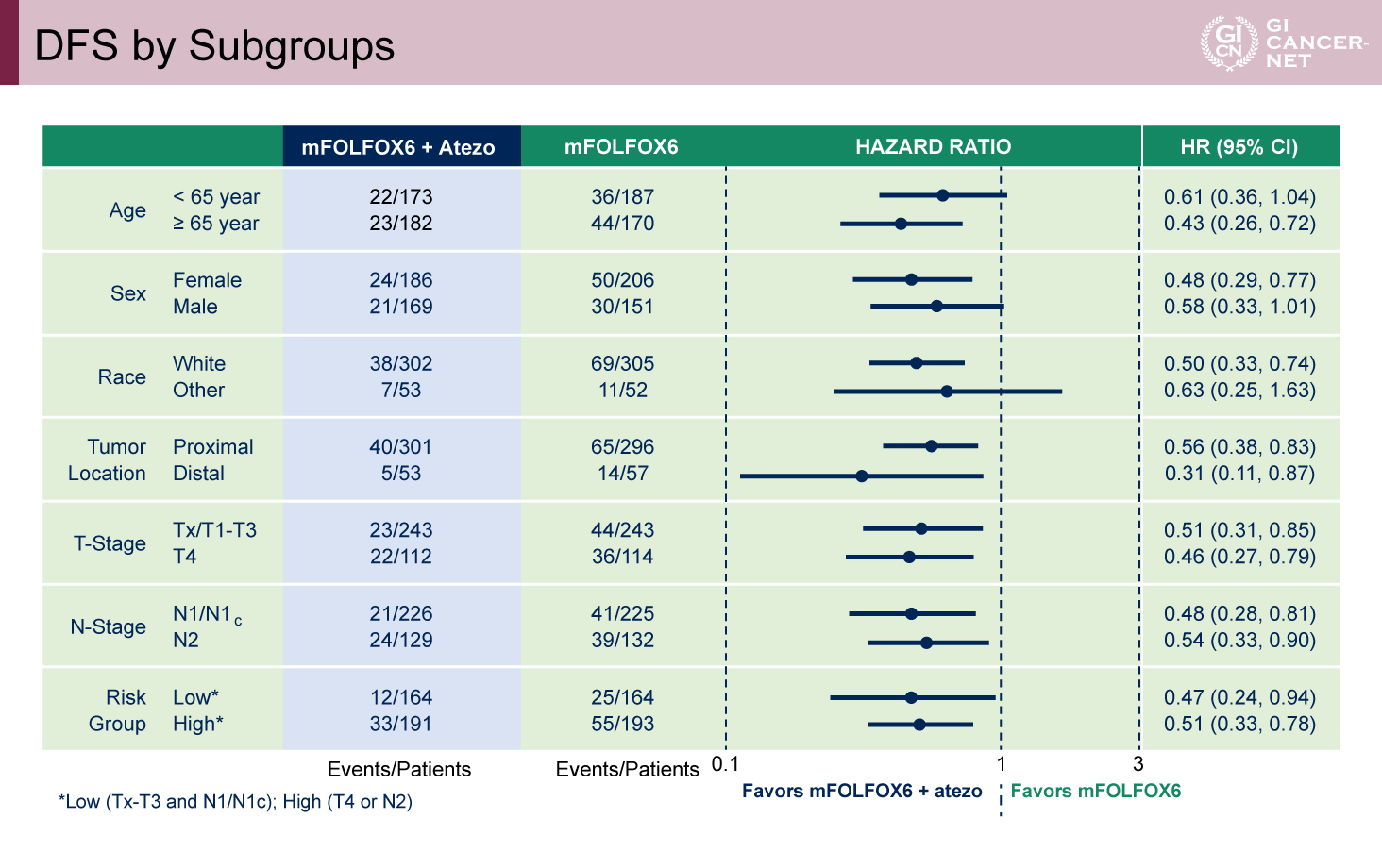
表3 Safety Summary(発表者の許可を得て掲載)
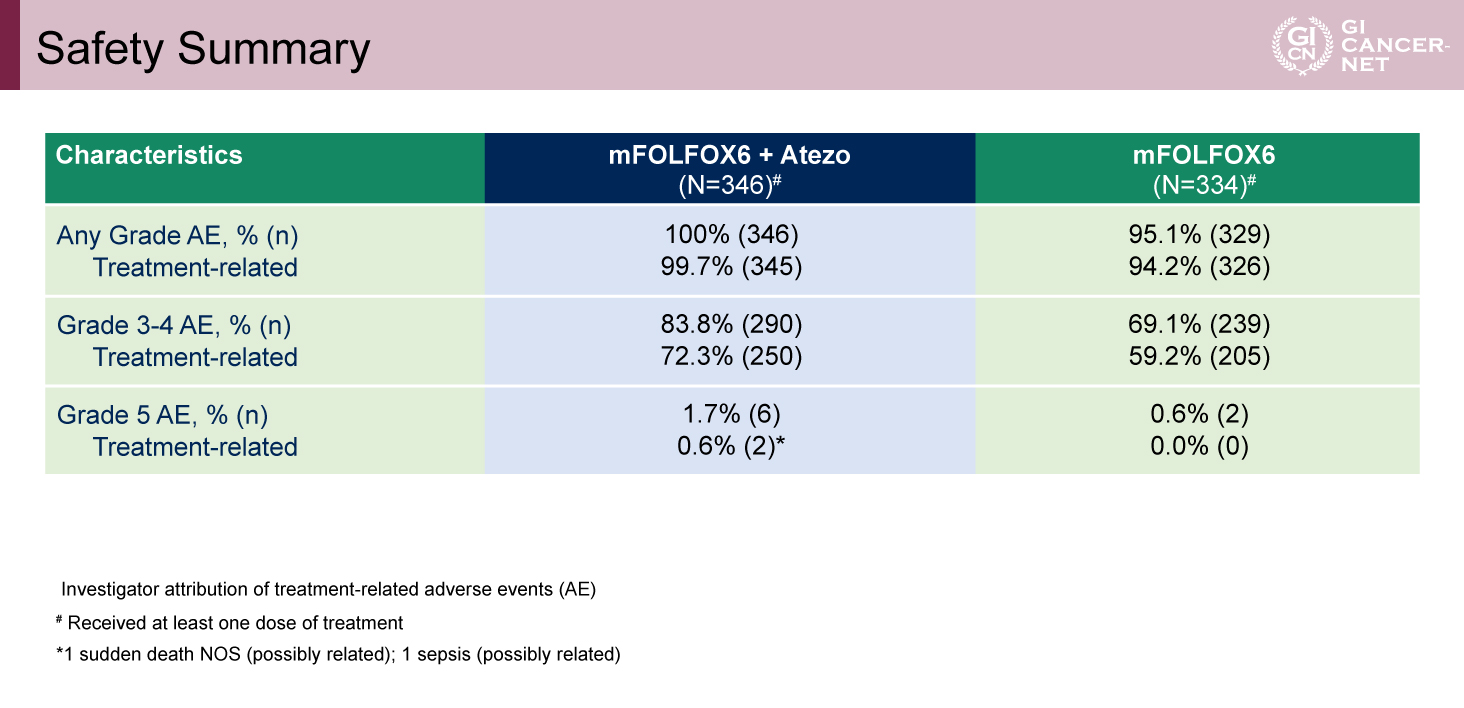
図3 Patient Safety(発表者の許可を得て掲載)
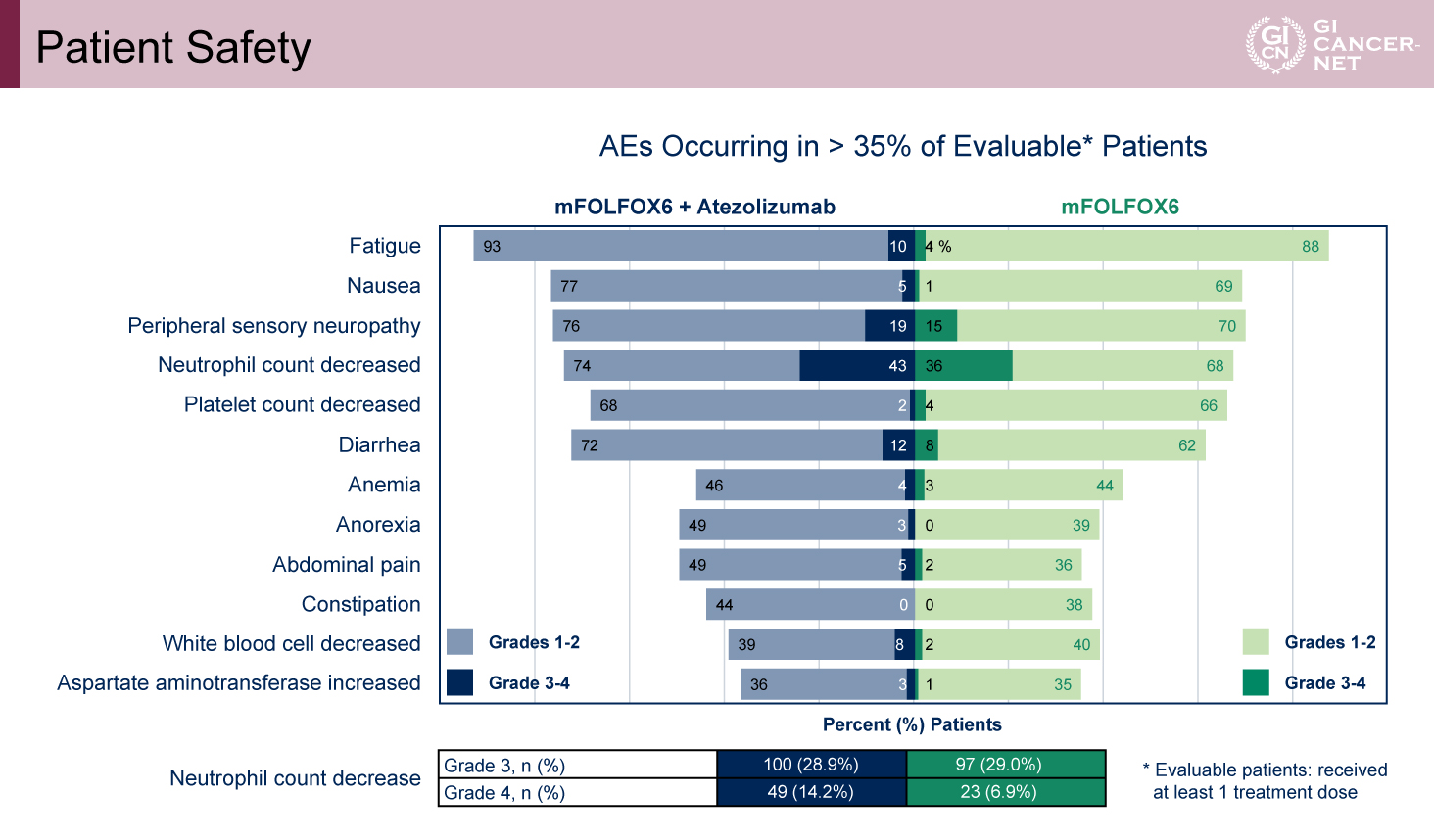
表4 Immune-Related AEs(発表者の許可を得て掲載)
結論
mFOLFOX6+Atezolizumabは、50%という臨床的に意味のある再発リスク低減を示し、安全性も良好であったことから、dMMR Stage III結腸癌に対する術後補助療法においての新たな治療選択肢となる。
(レポート:愛知県がんセンター 薬物療法部 安藤 泰樹)
References
1) Cohen R, et al.: J Clin Oncol. 39(6): 642-651, 2021[PubMed]
2) André T, et al.: N Engl J Med. 383(23): 2207-2218, 2020[PubMed]
3) Lenz HJ, et al.: J Clin Oncol. 40(2): 161-170, 2022[PubMed]
関連サイト
・ATOMIC試験[ClinicalTrials.gov][Alliance]
谷口 浩也先生
愛知県がんセンター 薬物療法部 医長