HER2陽性の切除不能・遠隔転移を有する胃もしくは食道胃接合部腺癌の2次治療を対象にTrastuzumab Deruxtecan(T-DXd)とRamucirumab+Paclitaxel併用療法を比較したランダム化第III相比較試験(DESTINY-Gastric04)の主解析
Trastuzumab deruxtecan (T-DXd) vs ramucirumab (RAM) + paclitaxel (PTX) in second-line treatment of patients (pts) with human epidermal growth factor receptor 2-positive (HER2+) unresectable/metastatic gastric cancer (GC) or gastroesophageal junction adenocarcinoma (GEJA): Primary analysis of the randomized, phase 3 DESTINY-Gastric04 study
Kohei Shitara, et al.
監修コメント
T-DXdは、日本ではランダム化第II相試験であるDESTINY-GC-01試験1)の結果に基づき、3次治療として承認され、日常診療でも広く使用されている。今回のDESTINY-GC-04試験2)は、HER2陽性胃癌に対する2次治療として長らく標準とされてきたPTX+RAM療法3)に対し、従来3次治療で用いられていたT-DXdを2次治療として比較することで、生存期間の延長が可能かどうかを検証した試験である。
本試験のポイントは、1次治療としてTrastuzumab(Tmab)を含むレジメンを受けた後、再度の組織検査によりHER2陽性と診断された患者のみを適格とした点にある。日本で実施されたWJOG7112G(T-ACT)試験4,5)では、Tmabを含む1次治療後におけるPTX単独療法に対するPTX+Tmab併用療法の有効性は示されなかったが、その背景として、組織生検が得られた16例中、HER2陽性を維持していた症例は5例(31%)にとどまっていたことが指摘されている。今回の試験でも、組織スクリーニングにおいて約40%の被験者が適格基準を満たさず除外されており、腫瘍組織が取得できた中でHER2陽性を維持している集団に絞ることで、良好な成績が得られたものと考えられた。
また、先日、CPS≧1のHER2陽性胃癌に対してPembrolizumabの適応が拡大され6)、化学療法+Tmabに併用可能となった。DESTINY-GC-04試験では、免疫チェックポイント阻害剤の既往歴がある患者は全体の15%と少数であったが、サブグループ解析においてPFSでハザード比0.74、全生存期間で0.59と、臨床的に有意な差が示されている。これは、初回化学療法でPembrolizumabが併用されても、本試験の結果が引き続き有用であることを示している。一方、1次治療後に再生検ができる胃癌患者は、原発巣がある患者さんや、肝転移など、生検しやすい部位に病変がある患者に限られ、また施設により異なる。HER2陽性が維持されていることを非侵襲的に確認できるようになるか?確認せずに投与すべきか否か?などが、新たなClinical Questionとなっている。
HER2陽性胃癌における治療開発はさらに加速しており、1次治療にT-DXdを導入するDESTINY-GC-05試験が開始されたばかりである。加えて、HER2の2つの異なるエピトープに結合する二重特異性抗体であるZanidatamabに化学療法とTislelizumabを併用するHERIZON-GEA-01試験や、化学療法+Tmabに、HER2の細胞外ドメインの別部位に結合し、HER2の細胞内取り込み(internalization)を促進するHLX22を併用するHLX22-GC-301試験などが進行中である。これらの試験結果次第では、HER2陽性胃癌に対する1次治療および2次治療の標準治療が今後さらに変化する可能性がある。
(国立がん研究センター中央病院 消化管内科/頭頸部・食道内科 科長 加藤 健)
背景
HER2陽性胃癌(HER2 IHC 3+もしくはIHC 2+/ISH陽性)は、胃癌の5~17%を占める。現在のHER2陽性胃癌の初回治療は、化学療法+Trastuzumab併用療法であり、CPS≧1の場合はさらにPembrolizumabが併用される。後方治療ラインでは、日本・韓国でDesitny-Gastric01試験が行われ、Trastuzumab Deruxtecan(T-DXd)単剤の有効性が証明され、この試験の結果からT-DXdが国内承認となった。海外においてもT-DXdの単アーム試験であるDestiny-Gastric02ならびに06試験が実施され、Desitny-Gastric01試験と同様な有用性と安全性が示されたことから、2次治療以降の後方ラインでT-DXdが広く承認されている。
一方、RAINBOW試験の結果から、2次治療(HER2ステータスを問わず)の標準治療はRamucirumab(RAM)+Paclitaxel(PTX)併用療法であったが、T-DXd単剤と直接比較した臨床試験はなかった。そのため、HER2陽性の切除不能/転移性の胃癌ならびに食道胃接合部腺癌の2次治療におけるT-DXdとRAM+PTXの有効性と安全性を評価するグローバル、多施設、非盲検、ランダム化第III相比較試験であるDESTINY-Gastric04試験が計画された。今回は中間解析における主解析の結果が報告された。
Trastuzumabを含む初回治療に不応後の腫瘍生検でHER2陽性が確認された2次治療の症例が対象であった
Destiney Gastric04試験の主たる適格性は、HER2陽性(HER2 IHC 3+もしくはIHC 2+/ISH陽性)の胃癌もしくは食道胃接合部腺癌、Trastuzumabを含む化学療法に不応後の腫瘍生検でHER2ステータスが確認されている、ECOG-PSが0もしくは1、臨床的に活動性のある中枢神経への転移がないであった。試験デザインとして、登録患者はT-DXd単剤群(6.4mg/kg、3週ごと)とRAM+PTX併用療法群に1:1にランダムに割り付けられた。層別化因子としては、HER2ステータス(HER2 IHC 3+ vs IHC 2+/ISH陽性)、地域(中国を除くアジア vs 西欧 vs 中国と残りの地域)、初回治療の増悪までの期間(6カ月未満 vs 6カ月以上)であった。主要評価項目は全生存期間(OS)、副次評価項目は無増悪生存期間(PFS)、確定の客観的奏効割合(cORR)、病勢制御割合(DCR)、奏効期間(DOR)、安全性であった。探索的なエンドポイントとして、患者報告アウトカム(PRO)が実施された。
統計設定としては、検出力を90%、OSのハザード比(HR)を0.7(試験全体の両側α=5%)を見込む場合に、OSのイベントは339例で必要であり、計画された症例登録数は490例であった。中間解析は、症例登録が完遂した後にOSのイベントが237を超えた時点で実施することが計画されていた。OS、PFS、cORRの階層的な検定(OS→PFS→cORR)については、多重性を制御するために、ゲートキーピング法を用いて行われた。中間解析における優越性の有効中止の境界値は両側P値<0.0228であった。
T-DXd群においてOS、PFS、cORRで有意な改善が認められた
1,088例が組織スクリーニング、638例が登録前スクリーニングを受け、最終的に494例がT-DXd群に246例、RAM+PTX群に248例がランダムに割り付けられた。患者背景については、両群間で大きな偏りは認められなかった。後治療で化学療法を受けた割合は、T-DXd群で51.2%、RAM+PTX群で47.6%であった。T-DXd群でPTXを受けた症例は25.6%、RAMを受けた割合は17.5%であった。RAM+PTX群でT-DXdを受けた症例は21.0%、Disitamab Vedotinを受けた割合は4.8%であった。
今回のデータカットオフは2024年10月24日時点のものであり、OSイベントは266例(全体の78.5%)で認められた。観察期間(中央値)はT-DXd群で16.8カ月、RAM+PTX群で14.4カ月であった。主要評価項目であるOSの中央値は、T-DXd群で14.7カ月、RAM+PTX群で11.4カ月であり、統計学的に有意にOSの延長が認められた(HR=0.70、95% CI: 0.55-0.90、p=0.0044)(図1)。6カ月のOS割合はT-DXd群で83.5%、RAM+PTX群で74.4%であった。12カ月のOS割合はT-DXd群が57.6%、RAM+PTX群が48.9%であった。24カ月のOS割合はT-DXd群が29.0%、RAM+PTX群が13.9%であった。後治療の影響を考慮した感度分析においても、T-DXd群がRAM+PTX群と比較して同様なOSの延長が認められた。OSのサブグループ解析では、全てのサブグループにおいてT-DXd群で良好な傾向が認められた。
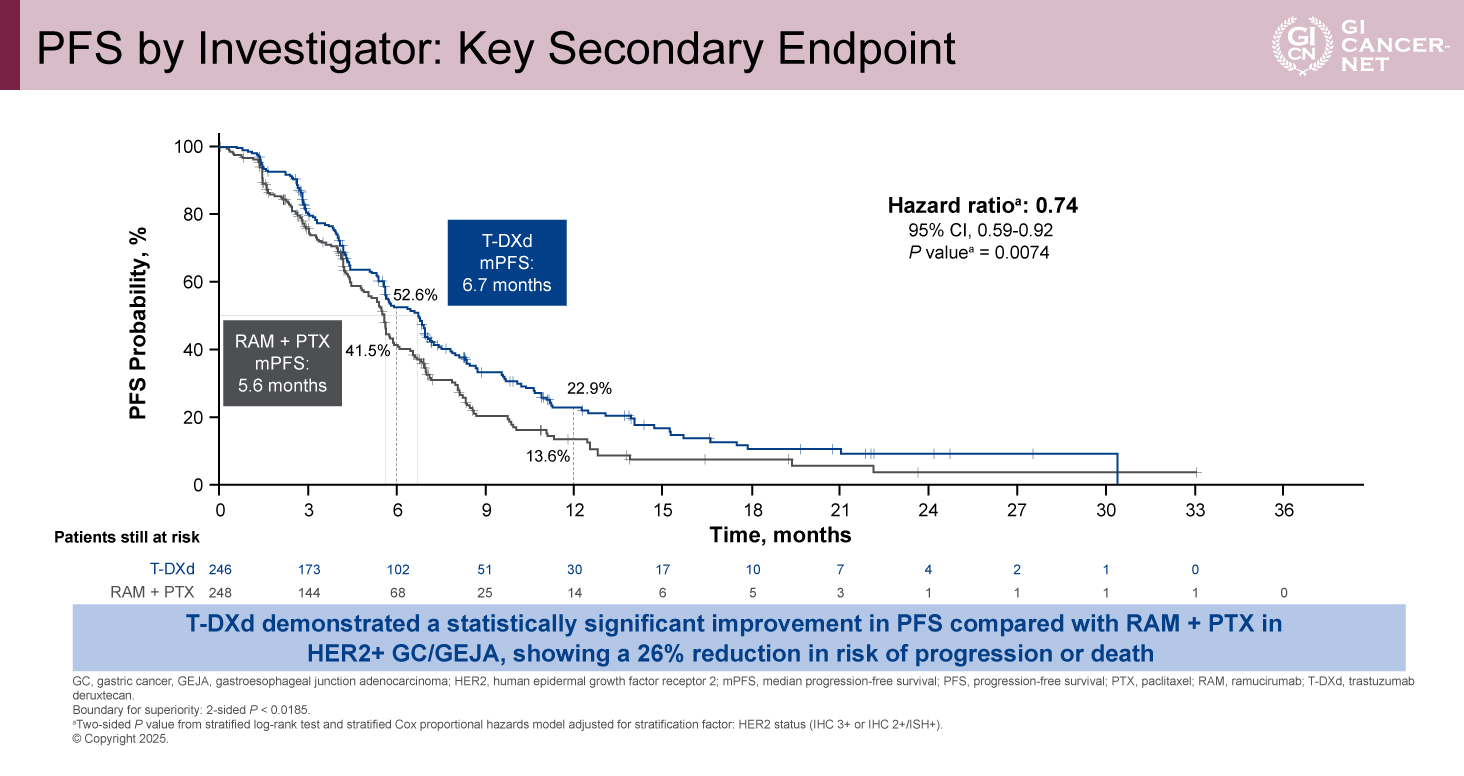
副次評価項目であるPFS中央値は、T-DXd群が6.7カ月、RAM+PTX群が5.6カ月で、統計学的に有意なPFSの延長が認められた(HR=0.74、95% CI: 0.59-0.92、p=0.0074)。6カ月PFS割合はT-DXd群で52.6%、RAM+PTX群が41.5%であった。12カ月PFS割合はT-DXd群が22.9%、RAM+PTX群が13.6%であった(図2)。PFSのサブグループ解析では、全てのサブグループにおいてT-DXd群で良好な傾向が認められた。
副次評価項目のcORRは、T-DXd群で44.3%、RAM+PTX群で29.1%であり、T-DXd群で有意に高値であった(p=0.0006)。DoRはT-DXd群で7.4カ月、RAM+PTX群で5.3カ月であった。DCRはT-DXd群で91.9%、RAM+PTX群で75.9%であった。
図1 OS: Primary Endpoint(発表者の許可を得て掲載)
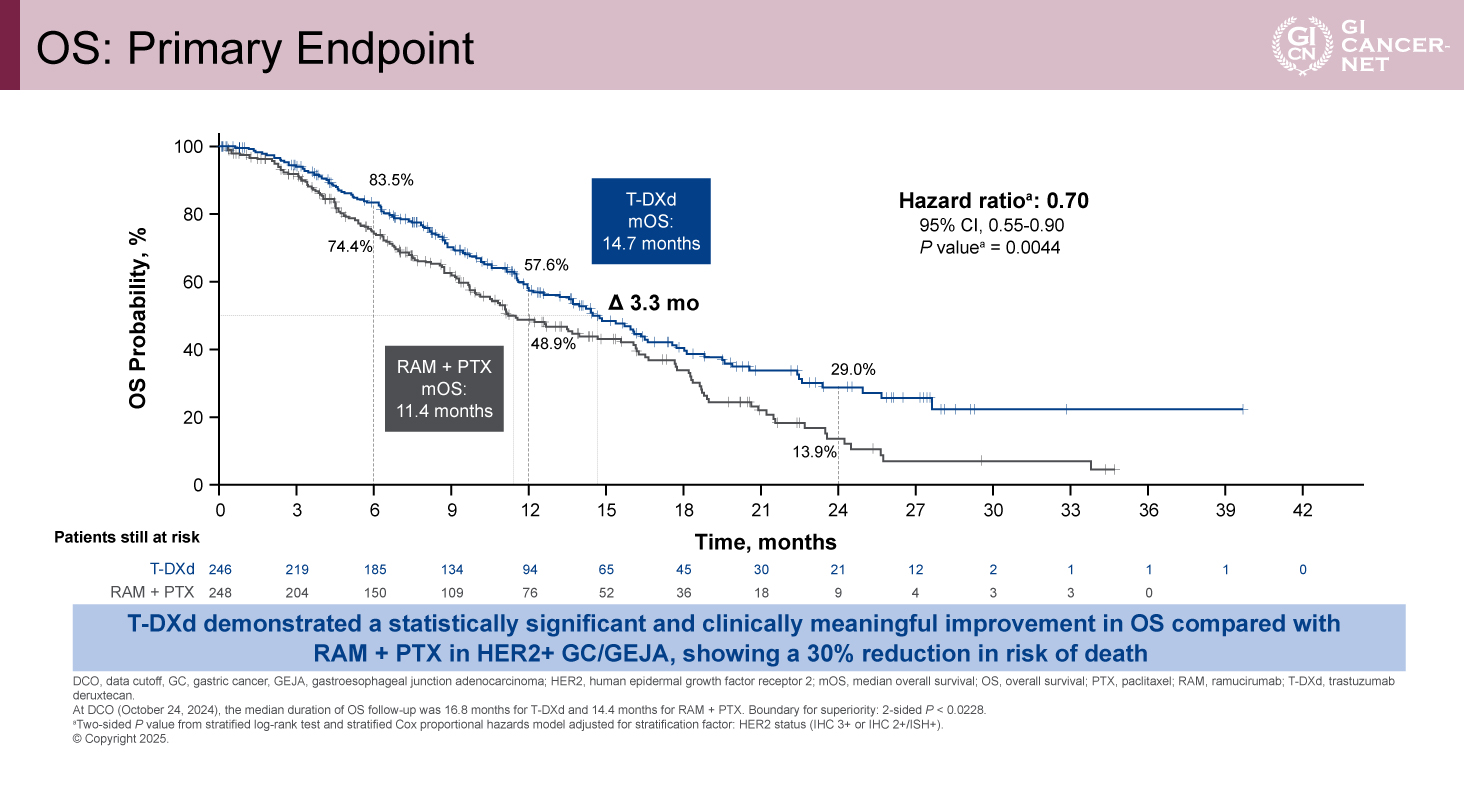
図2 PFS by Investigator: Key Secondary Endpoint(発表者の許可を得て掲載)
安全性については既報と同じ傾向で、新規の有害事象は認められなかった
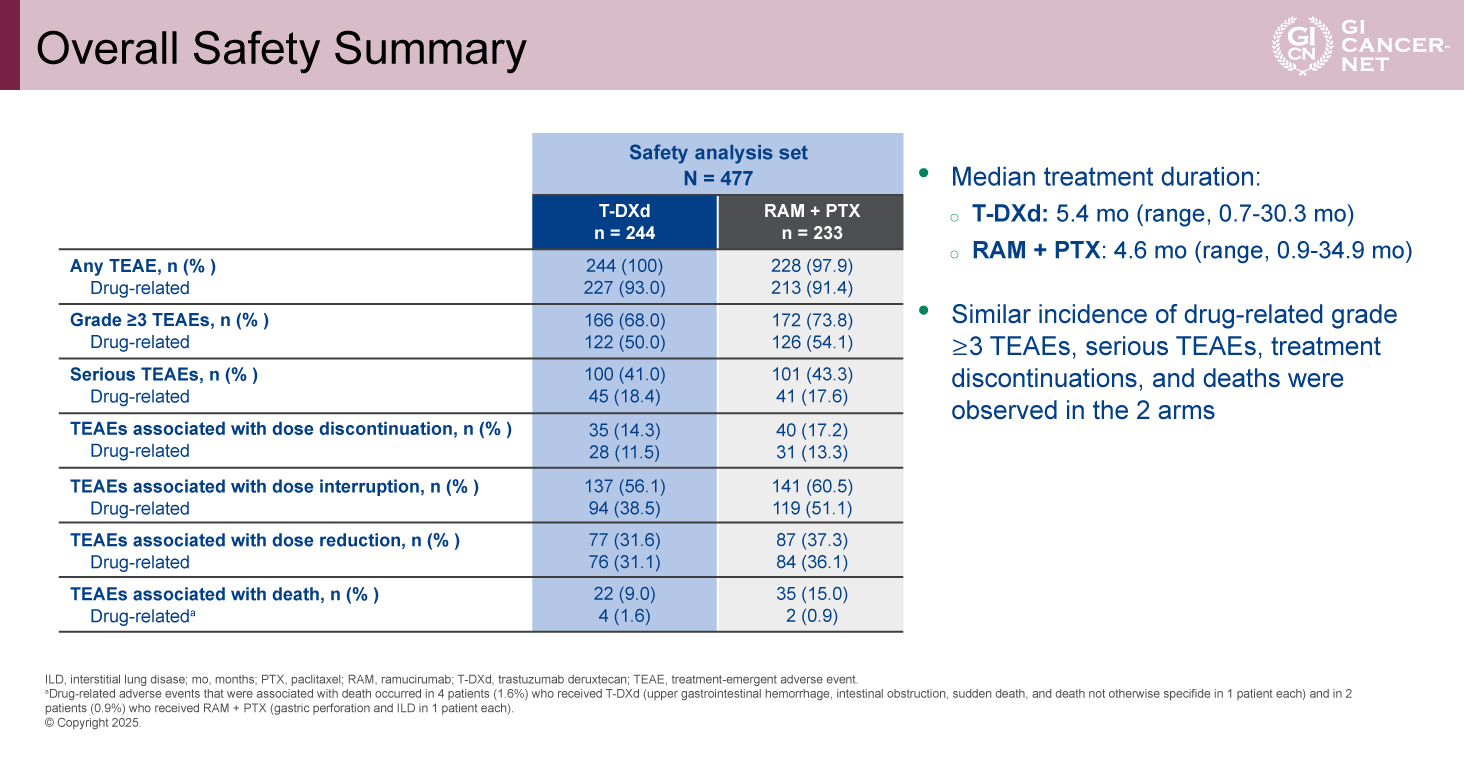
治療関連の有害事象については、T-DXd群が93.0%、RAM+PTX群が91.4%で認められた。治療関連のGrade 3以上の有害事象は、T-DXd群が50.0%、RAM+PTX群が54.1%であった。治療関連の重篤な有害事象は、T-DXd群で18.4%、RAM+PTX群が17.6%であった。治療関連で投与中止を要した有害事象は、T-DXd群が11.5%、RAM+PTX群が13.3%であった(表)。T-DXd群の治療関連有害事象で頻度が多かったものは、疲労(48.0%)、好中球数減少(48.0%)、悪心(44.3%)、貧血(31.1%)、食欲不振(29.1%)、骨髄抑制、消化器毒性であった。治療関連の間質性肺疾患/肺臓炎は、T-DXd群が34例(13.9%)、RAM+PTX群が3例(1.3%)であった。T-DXd群においてGrade 4以上は認められなかった。左室駆出不全は両群において差は認めず低頻度であった。
PROに関しては、EQ-5D-5L VASとFACT-Ga Gastric Cancer Subscaleに関して両群に大きな差は認められなかった。
表 Overall Safety Summary(発表者の許可を得て掲載)
結論
本試験の結果から、HER2+の切除不能/転移性の胃癌もしくは食道胃接合部腺癌において、T-DXdが2次治療の新たな標準治療となることが確認された。
(レポート:埼玉県立がんセンター 消化器内科 医長 高橋 直樹)
References
1) Shitara K, et al.: N Engl J Med. 382(25): 2419-2430, 2020[PubMed]
2) Shitara K, et al.: N Engl J Med. May 31, 2025[Online ahead of print][PubMed]
3) Wilke H, et al.: Lancet Oncol. 15(11): 1224-1235, 2014[PubMed]
4) Makiyama A, et al.: J Clin Oncol. 36(15_suppl): Abstract 4011, 2018[JCO]
5) Makiyama A, et al.: J Clin Oncol. 38(17): 1919-1927, 2020[PubMed]
6) 胃癌治療ガイドライン速報/2025年5月26日付[日本胃癌学会]
関連サイト
・DESTINY-Gastric04試験[ClinicalTrials.gov]
・DESTINY-Gastric01試験[ClinicalTrials.gov][論文紹介]
・DESTINY-Gastric02試験[ClinicalTrials.gov][論文紹介]
・WJOG7112G(T-ACT試験)[WJOG][学会レポート]
加藤 健先生
国立がん研究センター中央病院 消化管内科/頭頸部・食道内科 科長