切除不能進行・再発大腸癌の1st-lineにおけるS-1+Irinotecan+Bevacizumab併用療法の有用性を検証する無作為化第III相試験(TRICOLORE試験)
Treatment outcome according to tumor RAS mutation status in TRICOLORE trial: A randomized phase 3 trial of S-1 and Irinotecan plus Bevacizumab versus m FOLFOX6 or CapeOX plus Bevacizumab as first-line treatment for metastatic colorectal cancer
Yoshito Komatsu, et al.
監修コメント
TRICOLORE試験は、切除不能進行・再発大腸癌の1st-lineとしてS-1+Irinotecan+Bevacizumab(SIRBもしくはIRIS/BV療法)とmFOLFOX6/CapeOX+Bevacizumabを比較した、本邦で実施された世界初の無作為化第III相試験である。主要評価項目であるPFS曲線はS-1+Irinotecan+Bevacizumab群が常に上であり、非劣性が検証されただけでなく、やや有効な傾向も見てとれる。また、mFOLFOX6/CapeOX+Bevacizumab群の治療成績は既存の試験と同程度であり、治療・試験の質も高いと考えられる。
SIRBもしくはIRIS/BV療法は、有害事象として好中球減少および下痢に注意が必要であるが、末梢神経障害が少ない点は大きなメリットである。本試験の結果を受け、SIRBもしくはIRIS/BV療法は、本邦における切除不能進行・再発大腸癌の1st-lineにおける標準治療の1つとして確立された。これにより、患者の生活様式や副作用に対する嗜好に合わせて、経口フッ化ピリミジン系製剤か静注レジメンか、OxaliplatinかIrinotecanか、治療レジメンが選択できるようになった。ディスカッサントのArnold先生も、過去のS-1に関する試験をレビューしながら本試験の結果を前向きに評価していた。日本の臨床試験に対する理解と評価が、欧米でも少しずつ高まってきていることを実感した。
(コメント・監修:愛知県がんセンター中央病院 薬物療法部 医長 谷口 浩也)
S-1+Irinotecan+Bevacizumab併用療法
切除不能進行・再発大腸癌の2nd-line例を対象に実施されたFIRIS試験において、IRIS療法[S-1(80mg/m2, day 1-14)+Irinotecan(125mg/m2, day 1, 15)]はFOLFIRI療法に対する非劣性が証明されている1)。また、1st-lineとして、S-1+Irinotecan+BevacizumabであるSIRB療法[S-1(80-120mg, day 1-14)+Irinotecan(150mg/m2, day 1)+Bevacizumab(7.5mg/kg, day 1)3週毎]、およびIRIS+Bevacizumab療法[S-1(80-120mg, day 1-14)+Irinotecan(100mg/m2, day 1,15)+Bevacizumab(5mg/kg, day 1,15)4週毎]は、第II相試験においてその有効性と安全性が報告されている2,3)。
TRICOLORE試験
本試験は、1st-lineとしてS-1+Irinotecan+BevacizumabとmFOLFOX6/CapeOX+Bevacizumabを比較した無作為化第III相試験である。対象は、20歳以上、ECOG PS 0-1の切除不能進行・再発大腸癌患者であり、mFOLFOX6/CapeOX+Bevacizumab群[mFOLFOX6+Bevacizumab:Oxaliplatin(85mg/m2, day 1)+bolus 5-FU(400mg/m2, day 1)+infusion 5-FU(2,400mg/m2, 46hr, day 1-2)+l-LV(200mg/m2, day 1)+Bevacizumab(5mg/kg, day 1) 2週毎、もしくはCapeOX+Bevacizumab:Capecitabine(2,400-4,200mg/day, day 1-14)+Oxaliplatin(130mg/m2, day 1)+ Bevacizumab(7.5mg/kg, day 1)3週毎]、またはS-1+Irinotecan+Bevacizumab群(SIRB療法もしくはIRIS+Bevacizumab療法)に1:1で無作為に割り付けられた。
主要評価項目はPFSであり、副次評価項目はOS、奏効割合、TTF(time to treatment failure)、相対用量強度、有害事象、QOL、QALY(quality adjusted life years)などであり、ここでは、PFS、OS、奏効率、TTF、有害事象、RAS状況別の治療成績についての解析が報告された。PFS中央値をmFOLFOX6/CapeOX+Bevacizumab群11ヵ月、S-1+Irinotecan+Bevacizumab群12ヵ月と期待し、非劣性マージン1.25、片側α=0.025、検出力85%から、必要症例数は450症例と算出された。
S1+Irinotecan+Bevacizumab併用療法のPFSにおける非劣性を証明
2012年6月1日~2014年9月16日の間に487例が登録され、mFOLFOX6/CapeOX+Bevacizumab群244例、S-1+Irinotecan+Bevacizumab群243例に割り付けられ、解析対象はそれぞれ243例、241例であった。mFOLFOX6/CapeOX+Bevacizumab群では66例がmFOLFOX6+Bevacizumab療法、177例がCapeOX+Bevacizumab療法を受け、S-1+Irinotecan+Bevacizumab群では136例がSIRB療法(3週レジメン)、105例がIRIS+Bevacizumab療法(4週レジメン)を受けた。
患者背景は、表のとおりである。
表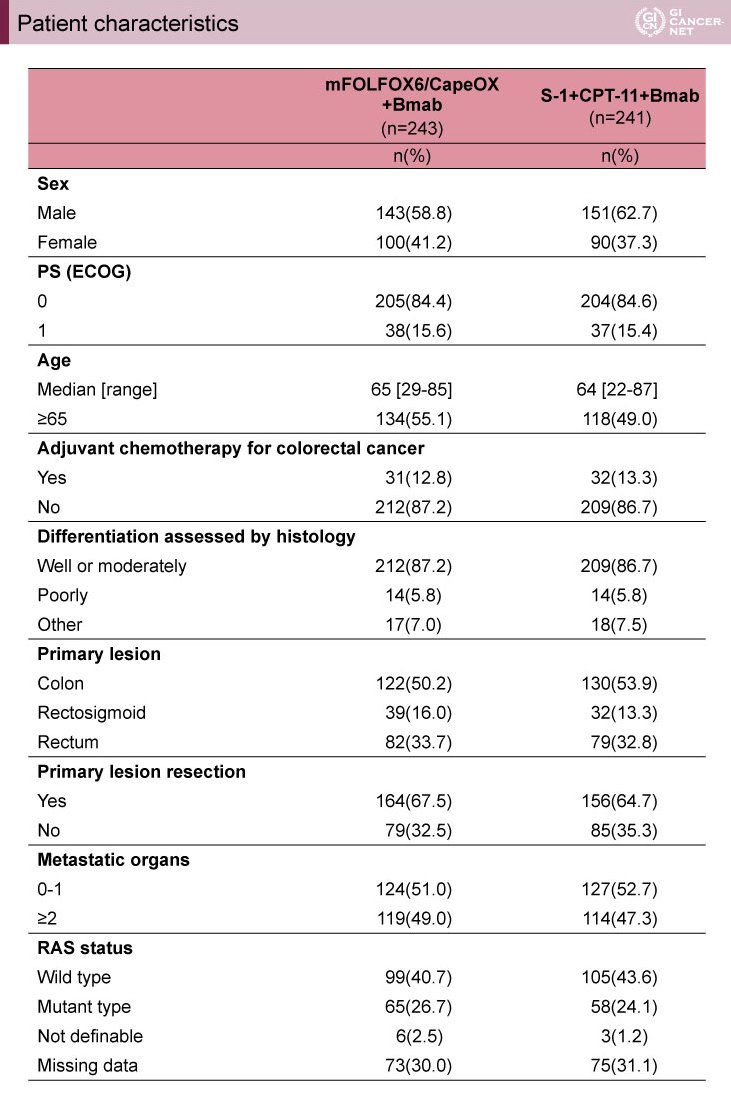
主要評価項目であるPFS中央値は、mFOLFOX6/CapeOX+Bevacizumab群10.8ヵ月(95% CI: 9.6-11.6)、S-1+Irinotecan+Bevacizumab群14.0ヵ月(95% CI: 12.4-15.5)、ハザード比は0.84(95% CI: 0.70-1.02)であり、S-1+Irinotecan+Bevacizumab併用療法の非劣性が証明された(非劣性p<0.001, 優越性p=0.082)。レジメン別のPFS中央値は、mFOLFOX6+Bevacizumab療法11.4ヵ月(95% CI: 9.0-13.3)、CapeOX+Bevacizumab療法10.4ヵ月(95% CI: 9.2-11.7)、SIRB療法13.2ヵ月(95% CI: 11.3-15.5)、IRIS+Bevacizumab療法14.3ヵ月(95% CI: 12.4-16.8)であった。
副次評価項目のTTF中央値は、mFOLFOX6/CapeOX+Bevacizumab群7.7ヵ月(95% CI: 7.1-8.2)、S-1+Irinotecan+Bevacizumab群9.6ヵ月(95% CI: 8.2-11.0)であり(HR=0.71, 95% CI: 0.59-0.85, p=0.0002)、TTFに関しては統計学的に有意な差をもってS-1+Irinotecan+Bevacizumab群が良好であった。
OS中央値は、追跡期間中央値32.4ヵ月の時点で、mFOLFOX6/CapeOX+Bevacizumab群33.6ヵ月、S-1+Irinotecan+Bevacizumab群34.9ヵ月であった(HR=0.86, 95% CI: 0.66-1.13)。
RAS状況別の解析では、RAS野生型におけるPFS中央値は、mFOLFOX6/CapeOX+Bevacizumab群11.6ヵ月(95% CI: 9.7-13.8)、S-1+Irinotecan+Bevacizumab群15.9ヵ月(95% CI: 12.4-18.0)、ハザード比は0.80(95% CI: 0.59-1.08)であり、S-1+Irinotecan+Bevacizumabの非劣性が証明された(非劣性p=0.002, 優越性p=0.149)。また、RAS変異型におけるPFS中央値は、それぞれ9.3ヵ月(95% CI: 7.8-10.8)、11.3ヵ月(95% CI: 9.6-13.6)、ハザード比は0.79(95% CI: 0.54-1.15)であり、S-1+Irinotecan+Bevacizumabの非劣性が証明された(非劣性p=0.009、優越性p=0.218)。
Grade 3以上の有害事象は、mFOLFOX6/CapeOX+Bevacizumab群(mFOLFOX6+Bevacizumab療法/CapeOX+Bevacizumab療法) vs. S-1+Irinotecan+Bevacizumab群(SIRB療法/IRIS+Bevacizumab療法)でそれぞれ、白血球減少:6.1%/1.1% vs. 10.4%/6.7%、好中球減少:25.8%/9.1% vs. 24.4%/24.0%、血小板減少:0.0%/2.3% vs. 0.7%/1.0%、貧血:0.0%/2.8% vs. 4.4%/5.8%、粘膜炎・口内炎:3.0%/1.1% vs. 3.0%/2.9%、食欲不振:4.5%/7.4% vs. 9.6%/2.9%、下痢:1.5%/8.5% vs. 13.3%/13.5%、手足症候群:1.5%/8.0% vs. 0.7%/1.0%、末梢神経障害:30.3%/18.8% vs. 0.0%/0.0%、高血圧:15.2%/10.8% vs. 11.1%/4.8%であり、好中球減少や下痢に関してはS-1+Irinotecan+Bevacizumab群で頻度が高く、末梢神経障害に関してはmFOLFOX6/CapeOX+Bevacizumab群で高い傾向にあった。
まとめ
切除不能進行・再発大腸癌の1st-lineとしてのS-1+Irinotecan+Bevacizumabは、mFOLFOX6/CapeOX+Bevacizumabに対する非劣性が示された。本併用療法はRAS野生型/変異型によらず有効性が示され、切除不能進行・再発大腸癌の1st-lineとして推奨されるレジメンの1つとなり得る。
(レポート:静岡県立静岡がんセンター 消化器内科 白数 洋充)

谷口 浩也 先生
愛知県がんセンター中央病院 薬物療法部 医長