切除不能進行・再発大腸癌に対する1st-lineとして、逐次投与方法(フッ化ピリミジン系製剤+Bevacizumab併用療法より開始)と多剤併用療法(フッ化ピリミジン系製剤+Irinotecan+Bevacizumab併用療法より開始)を比較する第III相試験(AIO KRK-0110 / ML22011試験)
Randomized phase III study of Fluoropyrimidine (FP) plus Bevacizumab (BEV) vs. FP plus Irinotecan (IRI) and BEV as first-line therapy for metastatic colorectal cancer (mCRC): German AIO KRK0110 (ML22011) - study
Dominik P. Modest, et al.
監修コメント
これまで逐次療法と併用療法について、いくつかの比較試験で検討されてきたが、逐次療法は治療選択肢の一つではあるものの、すべての患者に対して一律に推奨するべき治療法ではないとの結果であった。現在、切除不能進行・再発大腸癌に対する治療戦略において分子標的治療薬の併用は欠かせず、今回の試験はこのような状況下における逐次療法について検討した試験であった。
逐次療法群において予定されていた初回増悪後のIrinotecan併用療法に移行できたのがわずか38%、全治療経過でもIrinotecanが使用された症例が63%と、コントロールアームの併用療法群のIrinotecan使用率100%と比較して差は認めるものの、結果としてBevacizumab併用下においても逐次療法の併用療法における非劣性は証明できず、併用療法+Bevacizumabが第一の選択肢であることが示された。RAS、BRAF変異有無別の解析では、RAS/BRAF野生型において併用療法の効果が高い一方、RAS変異型では効果が乏しい傾向にあった。本解析はpreplannedされたものであったが、RAS、BRAF変異有無で層別化されているわけではないこと、背景因子と交絡の有無や背景因子で調整された結果について報告がなかったことから、現時点では参考程度にとどめるべきと思われる。今後の追加解析の報告が待たれる。
(コメント・監修:静岡県立静岡がんセンター 消化器内科 医長 山﨑 健太郎)
抗体療法(血管新生阻害剤、抗EGFR抗体薬)登場以降における逐次投与方法の位置づけは?
現在、切除不能進行・再発大腸癌に対する1st-lineとしては、多剤併用療法(フッ化ピリミジン系製剤+IrinotecanもしくはOxaliplatinの併用に加え、BevacizumabもしくはRAS野生型であれば抗EGFR抗体薬を併用)が標準的治療方法として実施されており、生存期間は30ヵ月を超えるようになっている。また、全身状態の良好な非高齢者においては、さらに強力なFOLFOXIRI療法も1st-lineとして、その有効性と安全性が報告されている。
一方で、化学療法によっても切除が望めない患者や緩除な進行を伴い無症状である患者、もしくは強力な治療の導入が困難そうな高齢者に関しては、QOLを維持しながら同等の生存期間の延長が得られる治療として、非強力な治療から1st-lineを開始する、いわゆる逐次投与方法が検討されてきた。抗体療法(Bevacizumabや抗EGFR抗体薬)が登場する以前には、CAIRO試験[Capecitabine→Irinotecan→CAPOX(Capecitabine+Oxaliplatin)療法 vs. CAPIRI(Capecitabine+Irinotecan)療法→CAPOX療法]1)もしくはMRC-FOCUS試験(5-FU→Irinotecan vs. 5-FU→併用療法 vs. 最初から併用療法にて開始)2)が行われ、逐次投与方法は治療戦略の1つとして提案されてきた。しかしながら、抗体療法登場以降において、切除不能進行・再発大腸癌の1st-lineにおけるこの逐次投与方法の位置づけは不明確であった。
逐次投与方法(フッ化ピリミジン系製剤+Bevacizumab併用療法より開始)と多剤併用療法(フッ化ピリミジン系製剤+Irinotecan+Bevacizumab併用療法)の治療成功期間を比較する第III相試験
未治療の切除不能進行・再発大腸癌患者を対象として、逐次投与療法群(FP+BEV群: フッ化ピリミジン系製剤+Bevacizumab併用療法→フッ化ピリミジン系製剤+Irinotecan+Bevacizumab併用療法)と併用療法群(FP+IRI+BEV群: フッ化ピリミジン系製剤+Irinotecan+Bevacizumab併用療法)に1:1に無作為に割り付けられた。FP+BEV群の治療としては、Cape+Bev療法(Capecitabine: 2,500mg/m2, day 1-14、Bevacizumab: 7.5mg/kg, day 1、3週毎)またはFL+Bev療法(5-FU: 400mg/m2急速静注, day 1+2,400mg/m2, 48時間持続投与、LV: 400mg/m2, day 1、Bevacizumab: 5mg/kg, day 1、2週毎)が選択された。FP+IRI+BEV群の治療としては、CAPIRI+Bev療法(Capecitabine: 1,600mg/m2, day 1-14, Irinotecan: 200mg/m2, day 1、Bevacizumab: 7.5mg/kg, day 1、3週毎)またはFOLFIRI+Bev療法(5-FU: 400mg/m2急速静注, day 1+2,400mg/m2, 48時間持続投与、LV: 400mg/m2, day 1、Irinotecan: 180mg/m2, day 1、Bevacizumab: 5mg/kg, day 1、2週毎)が選択された。なお、両群とも2010~2013年まではフッ化ピリミジン系製剤はCapecitabineのみ選択され、2013年以降は担当医により治療方法が選択された。また、FP+BEV群は、増悪後にCAPIRI+Bev療法もしくはFOLFIRI+Bev療法(フッ化ピリミジン系製剤は最初に選択した薬剤をその後の治療方法でも使用)に移行されることとなっていた。
主要評価項目はTFS(time-to-failure of strategy)、副次評価項目は奏効割合、1st-lineのPFS、OS、分子サブタイプ別の効果、QOL、安全性であった。なお、TFSは治療開始から上記治療方法の終了までの期間のことであり、FP+BEV群ではCape/FL+Bev療法開始からCAPIRI/FOLFIRI+Bev療法の中止までの期間、そしてFP+IRI+BEV群ではCAPIRI/FOLFIRI+Bev療法の中止までの期間であった。TFSの非劣性マージンのハザード比0.8を期待し、片側α=0.05、検出力80%で計画されたが、登録が遅延したため検出力70%に改訂し、目標登録数430例として実施された。
逐次投与療法群は主要評価項目であるTFSに関して併用療法群に対して非劣性を示すことはできなかった。
434例が登録され、解析対象症例数は421例(FP+BEV群212例、FP+IRI+BEV群209例)であった。また、分子サブタイプが解析されたのは88.8%(374名)であった(FP+BEV群188例、FP+IRI+BEV群186例)。患者背景に偏りはなく、年齢中央値はFP+BEV群71歳、FP+IRI+BEV群69歳、ECOG PS 1はそれぞれ39.2%、37.8%、右側結腸はそれぞれ32.1%、30.1%であった。
主要評価項目のTFSの中央値は、FP+BEV群9.6ヵ月(90% CI: 8.6-10.6)、FP+IRI+BEV群9.9ヵ月(90% CI: 8.8-10.6)であった。ハザード比は0.86(90% CI: 0.73-1.02) であり、統計学的に逐次投与療法の非劣性を示すことはできなかった(p=0.16)
(図1)。
図1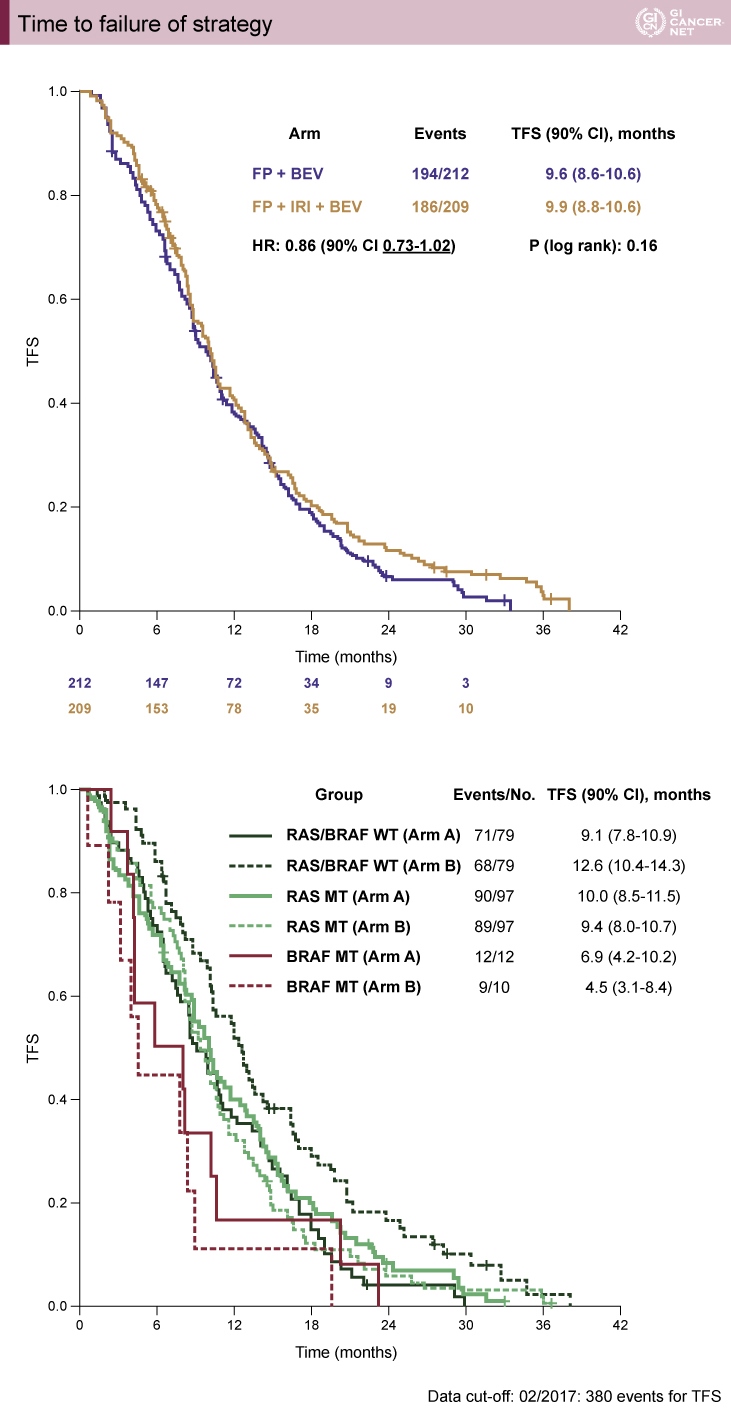
TFSの分子サブタイプ別解析では、RAS/BRAF野生型において、FP+IRI+BEV群が有意にTFSの延長を示した(HR=0.61, 90% CI: 0.46-0.82)(図2)。一方で、RAS変異型においては、FP+BEV群で良好な傾向であった(HR=1.09, 90% CI: 0.81-0.1.46)。
図2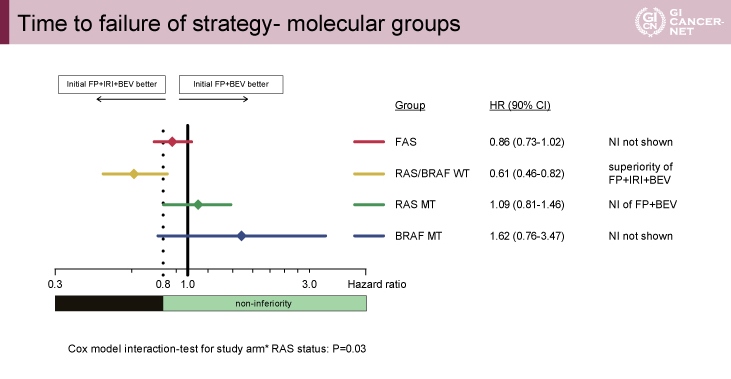
FP+BEV群において、次治療としてIrinotecanが投与された症例は37.7%であり、いずれかの治療ラインでIrinotecanが投与された症例は63.2%であった。
奏効割合は、FP+BEV群36.8%、FP+IRI+BEV群53.6%であり、FP+IRI+BEV群が有意に良好であった(p=0.005)。RAS/BRAF野生型における奏効割合は、FP+BEV群44.3%、FP+IRI+BEV群65.8%とFP+IRI+BEV群が有意に良好であったが(p=0.01)、RAS変異型ではそれぞれ33.0%、46.4%(p=0.08)、BRAF変異型ではそれぞれ25.0%、30.0%(p=0.79)であり、有意差は認めなかった。
OS中央値はFP+BEV群21.9ヵ月(95% CI: 20.2-25.0)、FP+IRI+BEV群23.5ヵ月(95% CI: 20.9-27.9)と差を認めなかった(HR=0.84, 95% CI: 0.66-1.06, p=0.14)。一方で、RAS/BRAF野生型におけるOS中央値は、FP+BEV群25.2ヵ月(95% CI: 20.8-29.8)、FP+IRI+BEV群32.2ヵ月(95% CI: 26.1-46.1)であった。
後治療については、両群で実施された薬剤に差を認めなかった。なお、毒性、QOLに関してはFP+BEV群がFP+IRI+BEV群と比べて良好であった。
結論
切除不能進行・再発大腸癌の1st-lineは併用療法より開始することが望ましいと考えられ、特にRAS/BRAF野生型の症例では併用療法が推奨される。一方で、RAS/BRAF変異型に関しては、今後、適切な治療方法、戦略の探求が更に必要である。
(レポート:国立がん研究センター東病院 消化管内科 久保木 恭利)

山﨑 健太郎 先生
静岡県立静岡がんセンター 消化器内科 医長