Gemcitabine+nab-Paclitaxel±Demcizumabの無作為化第II相試験(YOSEMITE試験)
YOSEMITE: A 3 arm double-blind randomized phase 2 study of Gemcitabine, Paclitaxel protein-bound particles for injectable suspension (Abraxane®) and Placebo (GAP) versus Gemcitabine, Abraxane® and either 1 or 2 truncated courses of Demcizumab
Antonio Cubillo, et al.
監修コメント
膵癌の化学療法抵抗性については、様々な原因が挙げられる。従来、悪液質による全身状態の悪化、膵癌間質増生による間質圧亢進と血流低下が指摘されてきたが、近年、各種薬剤に抵抗性を示す癌幹細胞の存在が注目されている。
本試験で用いられたDemcizumabは、NOTCHシグナル伝達経路のDLL-4を阻害し、癌幹細胞増殖抑制、血管新生阻害などを期待された薬剤である。膵癌においては、併用されたGemcitabine+nab-Paclitaxelにより、間質増生の減少、間質圧低下を生じることが報告されており、同療法とDemcizumabの併用は、膵癌化学療法抵抗性の改善に非常に期待された組み合わせであった。しかしながら、プラセボ群と比較し、有効性の上乗せ効果を示せず、残念な結果であった。癌幹細胞およびEMTの制御には様々な経路が関与しており、DLL-4阻害だけでは十分でなかった可能性が考えられる。癌幹細胞については、c-Myc経路、Stat3経路、βカテニン経路を阻害し、癌幹細胞抑制効果を示すBBI608という薬剤が、Gemcitabine+nab-Paclitaxelとの併用で膵癌に対して良好な抗腫瘍効果を発揮することが2017年米国臨床腫瘍学会年次集会で報告されており1)、第Ⅲ相試験に移行した。癌幹細胞を標的としたDemcizumabについても、バイオマーカー解析結果、さらなる薬剤との組み合わせに引き続き注目していく必要がある。
(コメント・監修:神奈川県立がんセンター 消化器内科 医長 上野 誠)
進行膵癌における癌幹細胞とDemcizumab
進行膵癌に対する標準治療はFOLFIRINOX2)またはGemcitabine+nab-Paclitaxel(GN療法)3)であるが、これらの治療法は癌幹細胞の制御に不十分であり、治療耐性の主な原因と考えられている。
NOTCH-1は、上皮間葉移行(epithelial-mesenchymal transition; EMT)の重要なシグナル伝達経路である。NOTCH受容体のリガンドのひとつであるDLL-4(Delta-like Ligand 4)抗体のDemcizumabは、膵癌幹細胞の浸潤を抑制し、かつ血管新生阻害効果を有し、持続的な抗腫瘍効果が期待された。
GN療法とGN+Demcizumab併用療法の無作為化第II相試験
対象は進行膵管腺癌患者であり、プラセボ群[GN療法(Gemcitabine: 1,000mg/m2, day 1, 8, 15, 28日毎+nab-Paclitaxel: 125mg/m2, day 1, 8, 15, 28日毎)+プラセボ]、Demcizumab/プラセボ群[GN療法+Demcizumab(3.5mg/kg, 2週毎, day 70まで)]、Demcizumab/Demcizumab群[GN療法+Demcizumab(3.5mg/kg, 2週毎, day 70まで, day 169からday 238まで)の3群に1:1:1の割合で無作為に割り付けられた(図1)。
主要評価項目はPFS、副次評価項目はOS、奏効割合、安全性であり、探索的評価項目としてバイオマーカーの検討とされた。なおPFSの解析は、プラセボ群と、Demcizumab/プラセボ群+Demcizumab/Demcizumab群(Demcizumab群)との比較により行われた。
図1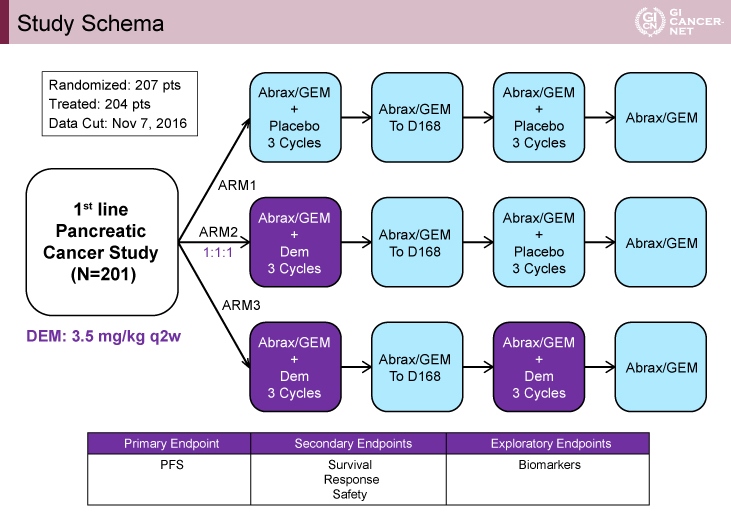
Demcizumab群はプラセボ群に対して有意なPFSの延長を示せず
207例が無作為化され、そのうち治療が行われた204例がITT集団とされた(プラセボ群68例、Demcizumab/プラセボ群71例、Demcizumab/Demcizumab群66例)。プラセボ群、Demcizumab/プラセボ群、Demcizumab/Demcizumab群における患者背景は、年齢中央値が62歳、63歳、66歳、転移巣の数中央値が1、0、1、肝転移例が72.1%、74.6%、75.4%、ECOG PS 0/1が34例/34例、33例/38例、31例/34例であり、3群間でバランスがとれていた。
主要評価項目であるPFSの中央値は、プラセボ群5.49ヵ月、Demcizumab群5.52ヵ月であった(HR=0.930, 95% CI: 0.630-1.375, p=0.7158)(図2)。
図2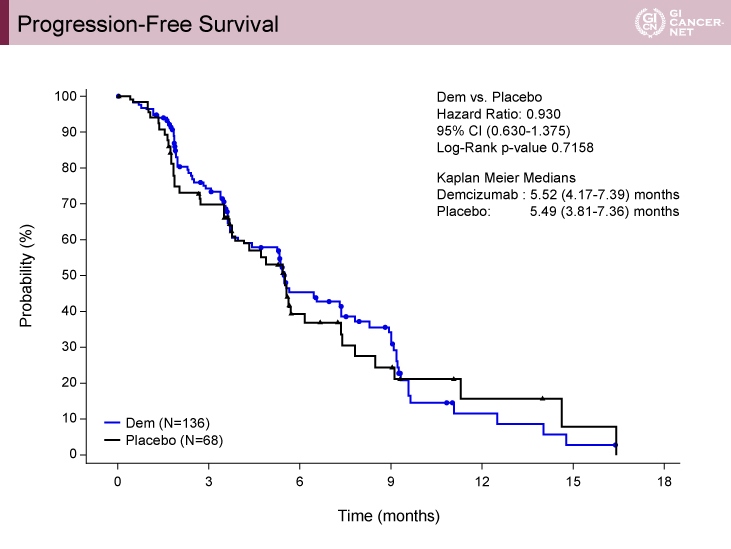
OSの中央値は、プラセボ群未到達、Demcizumab群13.2カ月であった(HR=1.018, 95% CI: 0.616-1.683, p=0.9443)。また、奏効割合は、プラセボ群41.2%、Demcizumab群33.1%であり、臨床的有効割合(CR+PR+SD)はそれぞれ70.6%、74.3%であった。
主な有害事象は(プラセボ群 vs. Demcizumab/プラセボ群 vs. Demcizumab/Demcizumab群)、悪心(61.8% vs. 53.5% vs. 63.1%)、下痢(50.0% vs. 57.7% vs. 69.2%)、貧血(39.7% vs. 60.6% vs. 53.8%)、疲労(50.0% vs. 43.7% vs. 56.9%)、末梢浮腫(42.6% vs. 54.9% vs. 52.3%)であった。なお、grade 3以上の心不全(0% vs. 5.6% vs. 1.5%)、肺高血圧(0% vs. 1.4% vs. 0%)はいずれも低率であったが、出血(1.5% vs. 9.8% vs. 6.2%)はDemcizumab群で多く認められた。
まとめ
Demcizumab群はプラセボ群に比べてPFSの延長を示せず、OSの延長も示せなかった。一方で、安全性は比較的高いと考えられた。
(レポート:神奈川県立がんセンター 消化器内科 小林 智)

上野 誠 先生
神奈川県立がんセンター 消化器内科 医長