未治療の切除不能進行・再発胃/食道胃接合部癌患者に対するNivolumab+S-1/Capecitabine+Oxaliplatinの安全性および臨床的効果(ATTRACTION-04/ONO-4538-37試験)
Interim safety and clinical activity of Nivolumab in combination with S-1/Capecitabine plus Oxaliplatin in patients with previously untreated unresectable advanced or recurrent gastric/gastroesophageal junction cancer: Part 1 study of ATTRACTION-04 (ONO-4538-37)
Yoon-Koo Kang, et al.
監修コメント
本年1月の消化器癌シンポジウムでATTRACTION-02試験の結果が報告され、後方ラインにおける胃癌に対するNivolumabの有効性が示された。本邦でもNivolumab単剤療法が間もなく胃癌に対しても使用可能となるが、次なるステップとして、早い治療ラインにおける単剤療法もしくは化学療法との併用が検討されている。本報告は、1st-lineにおける化学療法との併用を検討したATTRACTION-04試験1)の第II相部分の結果報告である。
SOX療法(G-SOX試験2))およびCapeOX療法(REAL2試験3))の有効性、そしてATTRACTION-02試験で報告されたNivolumab単剤の有効性を鑑みると、約70%という奏効割合は、概ね期待された抗腫瘍効果が示されていると言える。Nivolumabの臨床試験の生存曲線で"tail"と表現される、腫瘍の長期維持が可能となる効果が、より前方ラインの治療にNivolumabを併用することにより、どのように得られていくのか、part 2の結果に大きな期待を寄せたい。また、懸念される有害事象についても、想定範囲内に留まっており、まずは一安心した。
本学会ではATTRACTION-02試験のサブグループ解析の結果が報告され、腫瘍細胞のPD-L1発現割合はNivolumabの治療効果予測因子とならないことが示された。そして本報告においても、奏効はPD-L1発現割合が少ない(1%未満)症例でも認められていた。Nivolumabの治療効果を予測するバイオマーカーは1st-lineにこそ必要と考えられ、ATTRACTION-04試験のなかでそれが明らかになることを期待したい。
(コメント・監修:愛知県がんセンター中央病院 薬物療法部 医長 谷口 浩也)
切除不能進行・再発胃癌に対するNivolumabの有効性
Nivolumabは、PD-1(programmed death-1)を標的とする完全ヒト型IgG4モノクローナル抗体であり、標準治療が不応または不耐の切除不能進行・再発胃癌および食道胃接合部腺癌を対象としたプラセボ対照第III相試験であるATTRACTION-02試験において、主要評価項目であるOSを有意に延長し(中央値:Nivolumab群5.32ヵ月 vs. プラセボ群4.14ヵ月, HR = 0.63, 95% CI: 0.50- 0.78, p<0.0001)、胃癌に対する有効性が既に示されている。そして、ATTRACTION-02試験に引き続き、1st-lineとしてSOX療法またはCapeOX療法へのNivolumabの上乗せを検討する第II/III相試験として、ATTACTION-04試験1)が現在進行中である。本会では、第II相部分(part 1)の結果が報告された。
ATTRACTION-04試験
ATTRACTION-04試験は、日本、韓国および台湾が参加する多施設共同無作為化第II/III相試験として計画され、part 1ではNivolumab+SOX療法およびNivolumab+CapeOX療法の安全性、忍容性および有効性を評価することを目的とされた。対象は、ECOG PS 0-1で、前治療歴がないHER2陰性の切除不能進行・再発胃癌もしくは食道胃接合部癌患者であり、Nivolumab+SOX群とNivolumab+CapeOX群に1:1で割り付けられた。
主要評価項目は安全性および忍容性であり、副次評価項目は担当医および/または盲検中央判定による奏効割合、PFS、OSなどであった。
SOXまたはCapeOX療法へのNivolumab併用の安全性および忍容性が示される
40例が登録され、Nivolumab+SOX群21例、Nivolumab+CapeOX群19例に割り付けられた。患者背景は、Nivolumab+SOX群で男性が少なく(57% vs. 79%)、進行胃癌が多く(71% vs. 47%)、手術歴を有する症例が少なかった(33% vs. 53%)。なお、観察期間中央値は8.3ヵ月であった。
Grade 3以上の治療関連有害事象(>10%)は、Nivolumab+SOX群では好中球減少(14%)、Nivolumab+CapeOX群では末梢神経障害(11%)、食欲減退(11%)が認められたが、その他の有害事象に大きな差はなかった(表)。なお、治療関連死亡は両群とも認めなかった。
表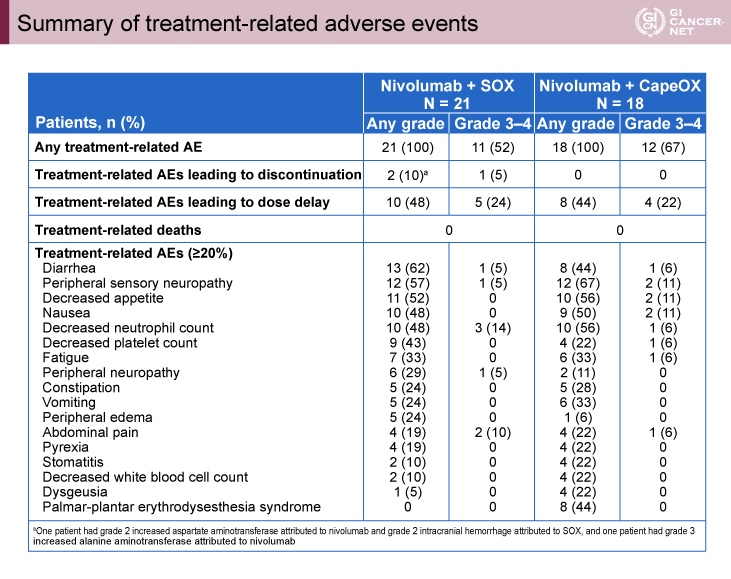
奏効割合は、担当医/盲検中央判定評価においてNivolumab+SOX群67%/ 62%、Nivolumab+CapeOX群71%/71%であり、PD-L1発現割合によらず多くの症例で腫瘍縮小が得られていた(図)。
図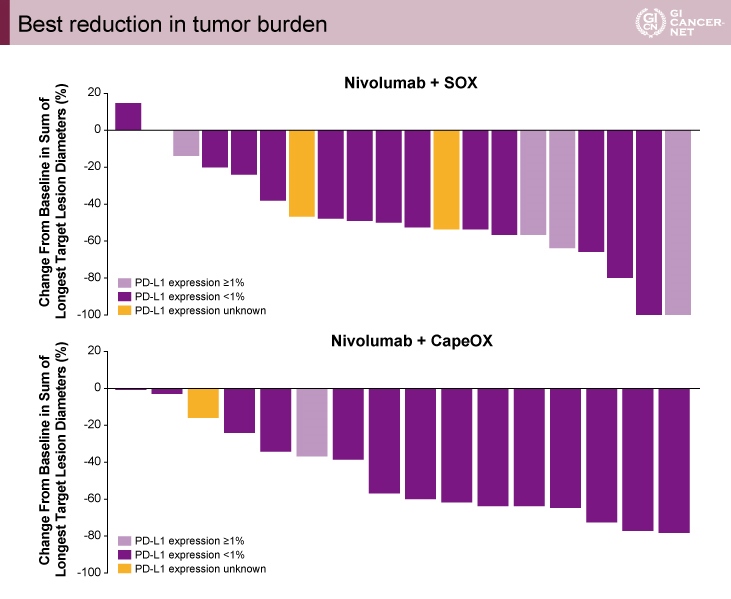
PFS中央値は、担当医/盲検中央判定評価においてNivolumab+SOX群9.9ヵ月(95% CI: 6.8- 9.9)/ 未到達(95% CI: 4.4- NE)、Nivolumab+CapeOX群7.1ヵ月(95% CI: 4.3- NE)/ 7.2ヵ月(95% CI: 5.7- NE)であった。
Part 2(第III相部分)が進行中
切除不能進行・再発胃癌および食道胃接合部癌に対するNivolumab+SOX/CapeOX併用療法は、いずれも忍容可能で抗腫瘍効果を示した。現在、part 2が進行中である。
(レポート:聖マリアンナ医科大学 臨床腫瘍学 水上 拓郎)

谷口 浩也 先生
愛知県がんセンター中央病院 薬物療法部 医長