進行胃癌および食道胃接合部腺癌に対するPembrolizumab単剤もしくは化学療法との併用の安全性および有効性を検討した第II相マルチコホート試験(KEYNOTE-059試験)
KEYNOTE-059: Efficacy and safety of Pembrolizumab alone or in combination with chemotherapy in patients with advanced gastric or gastroesophageal cancer
Zev A. Wainberg, et al.
監修コメント
2017年9月8日に抗PD-1抗体薬であるNivolumabの胃癌への適応拡大が厚生労働省部会にて了承され、胃癌にも免疫チェックポイント阻害剤が本格的に実臨床に導入される見込みとなったが、初回治療例に対してどうなのか、またもう1つの抗PD-1抗体薬であるPembrolizumabについてどうなのかについては、いくつかの試験の結果を待つ必要がある。今回のKEYNOTE-059試験の結果は、既に2017米国臨床腫瘍学会年次集会で示されたコホート1、2の結果のアップデートに加え、今回初めてPD-L1陽性胃癌の初回化学療法としてのPembrolizumab単剤の成績の報告がなされた。
コホート1については既報の通りであり、また同じ対象に対するNivolumab成績とほぼ同様であることが改めて示された。一方コホート2については、2017年米国臨床腫瘍学会年次集会の報告では、PFS中央値6.6ヵ月、OS中央値20.8ヵ月であったものが、アップデートの結果、OS中央値が13.8ヵ月となっていた。観察期間の延長に伴い死亡のイベントが増えたことで、化学療法単独の成績とあまり変わらないOS中央値となったことが驚きであった。ただ、一部の患者に持続的効果が認められ、生存曲線のtail upが特徴の1つであるため、中央値だけで判断するのは時期尚早である。
今回初出であるコホート3については、化学療法なしでどの程度Pembrolizumabの効果が期待できるのか、効果が期待できる患者選択に最適な基準はなにかが焦点であった。肺癌におけるKEYNOTE-024試験では、PD-L1陽性細胞50%以上の患者へ対象を絞ることで、化学療法に対してPembrolizumab単剤がOSにおける優越性を示した1)。一方本試験では、PD-L1で染色された細胞数(腫瘍細胞、リンパ球、マクロファージ)/全生存細胞数×100)を示す、Combined Positive Score(CPS)1%以上がPD-L1陽性症例とされた。その結果、奏効割合はPD-L1陽性胃癌に対象を絞ったKEYNOTE-012試験2)と同様に26%、PFS中央値は3.3ヵ月と短いものの、長期にわたり奏効する症例が認められるためOS中央値は20.7ヵ月と良好な成績を示した。もちろんこのコホートには比較的小さな転移巣を持つ、より状態のよい、選択された胃癌患者が登録されている可能性も考えられるが、胃癌においてもPD-L1陽性患者には、まず免疫チェックポイント阻害剤を投与し、効果なければ速やかに化学療法へ切り替え、効果ある患者には継続した投与を行うことで、トータルの予後を延ばすことができる、可能性を示唆している。
最終的には第III相試験であるKEYNOTE-062試験3)の結果を見ないと、選択バイアスなどの問題は解決されないが、結果が期待される。
(コメント・監修:国立がん研究センター中央病院 消化管内科 医長 加藤 健)
切除不能進行・再発胃癌に対する免疫チェックポイント阻害剤
切除不能進行・再発胃癌に対する化学療法は、分子標的薬の登場や支持療法の進歩により、1年を超える生存期間が期待できるようになったものの、依然として予後は不良である4,5)。PD-1/PD-L1を標的とした免疫チェックポイント阻害剤は複数の癌種において生存期間の有意な延長を示しており、切除不能・進行再発胃癌に対しても、第III相比較試験であるONO-4538-12(ATTRACTION-2)試験で3rd-line以降におけるNivolumabの有効性が示されている6)。
同様に、切除不能・進行再発胃癌に対する抗PD-1完全ヒトIgG4モノクロナール抗体Pembrolizumabについては、第Ib相試験であるKEYNOTE-012試験において、その安全性と有効性が示唆された2)。これに引き続き、2017年米国臨床腫瘍学会年次集会において第II相マルチコホート試験であるKEYNOTE-059試験の部分的結果が報告され、既治療例に対する単剤療法(コホート1)および初回治療における標準化学療法との併用療法(コホート2)のいずれにおいても、有望な結果がみられた。今回、これらコホートのアップデートに加え、初回治療におけるPD-L1陽性例に対する単剤療法(コホート3)に関する結果が報告された。
既治療例に対する単剤療法(コホート1)および初回治療における標準化学療法との併用療法(コホート2)のアップデート
2レジメン以上の治療歴のある259例に対するPembrolizumab単剤の安全性および有効性を検証したコホート1では、PFS中央値2.0ヵ月(95% CI: 2.0-2.1)、OS中央値5.5ヵ月(95% CI: 4.2-6.5)であった。PD-L1発現状況によるPFS中央値は、PD-L1陽性2.1ヵ月(95% CI: 2.0-2.1)、PD-L1陰性2.0ヵ月(95% CI: 1.9-2.0)と同程度であったが、6ヵ月PFS割合はそれぞれ18.2%、9.9%であり、PD-L1陽性でやや良好であった。同様に、OS中央値はPD-L1陽性5.8ヵ月(95% CI: 4.4-7.8)、PD-L1陰性4.6ヵ月(95% CI: 3.2-6.5)であり、6ヵ月OS割合はそれぞれ48.4%、42.9%であった。
また、初回治療の25例に対するPembrolizumabと標準化学療法(Cisplatin+5-FU/Capecitabine)との併用療法の安全性と有効性を検証したコホート2では、PFS中央値6.6ヵ月(95% CI: 5.9-10.6)、OS中央値13.8ヵ月(95% CI: 8.6-NR)であった。
切除不能・進行再発胃癌に対する初回治療におけるPembrolizumab単剤療法(コホート3)
コホート3の主な適格基準は、ECOG PS 0-1、前治療歴なし、PD-L1陽性、HER2陰性の切除不能・進行再発胃癌もしくは食道胃接合部腺癌であり、Pembrolizumab(200mg, 3週ごと)を、病勢増悪または毒性中止まで最大35サイクル投与された。PD-L1陽性の定義はコホート1、2と同様に22C3抗体を用いた免疫組織化学法においてCPS 1%以上とされた。主要評価項目は安全性および中央判定による奏効割合であった。
コホート3の対象患者は31例で、年齢中央値62歳(範囲32-75)、男性19例(61%)、人種は白人16例(52%)、アジア人15例(48%)、原発部位は胃癌19例(61%)、食道胃接合部癌12例(39%)、原疾患に対する手術歴あり12例(39%)であった。
観察期間中央値17.5ヵ月(範囲1.7-20.7)において、主要評価項目である奏効割合は26%(95% CI: 12-45)、病勢コントロール割合は36%(95% CI: 19-55)であった。また、治療前と比較して腫瘍縮小を認めた症例は24例(77%)、データカットオフ時におけるDOR(duration of response)中央値は9.6ヵ月(範囲2.1-17.8+)であり、長期にわたり奏効を維持している症例を認めた(図1)。
図1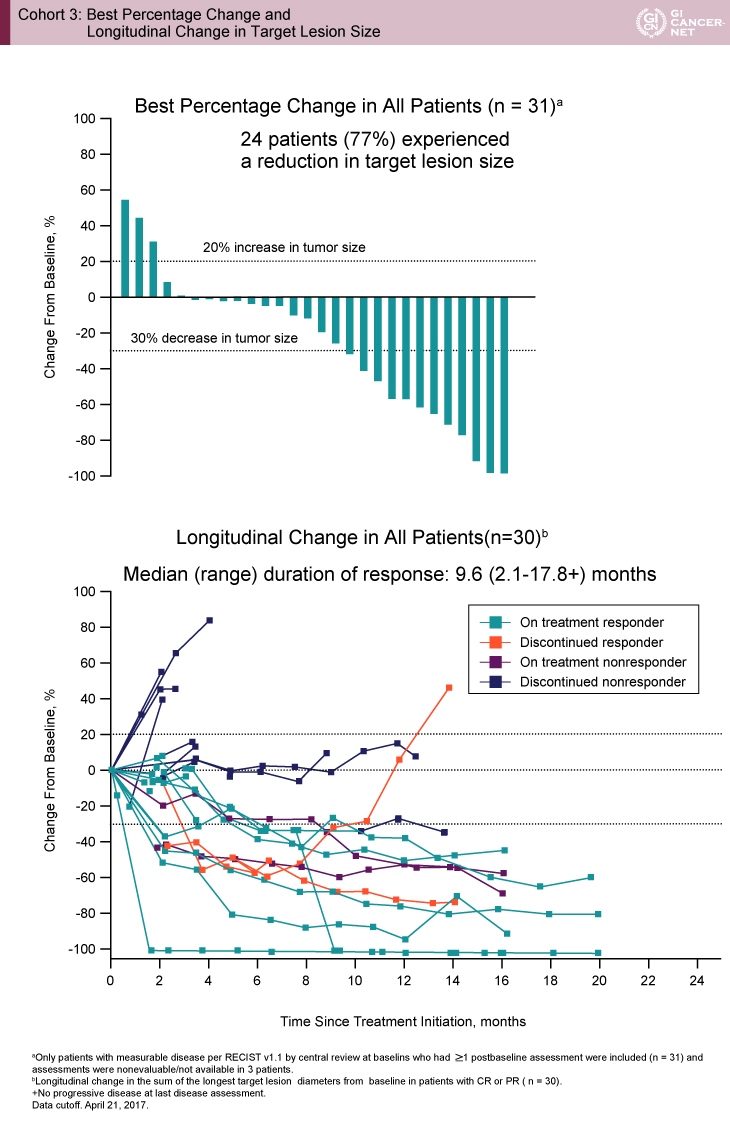
PFS中央値は3.3ヵ月(95% CI: 2.0-6.0)、OS中央値は20.7ヵ月(95% CI: 9.2-20.7)であった(図2)。
図2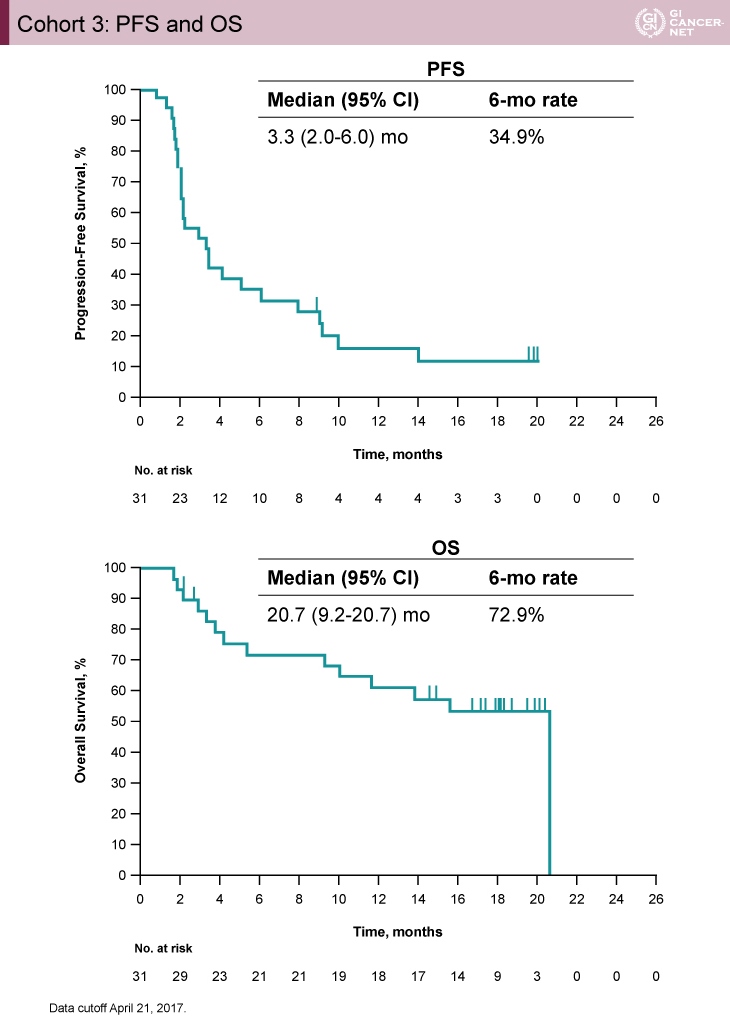
有害事象は31例中24例(77%)で認められ、grade 3以上の有害事象は7例(23%)で認められた。免疫関連有害事象は31例中10例(32%)で認められ、肺臓炎4例(13%)、大腸炎1例(3%)、皮疹1例(3%)であった。なお、肺臓炎を発症した1例は安全性の追跡期間中に死亡し、治療関連有害事象による死亡と判断された。
結論
切除不能進行・再発胃癌に対するPembrolizumabの治療効果と安全性は、既治療例に対する単剤療法、初回治療例に対する併用療法のいずれにおいても、アップデート解析で改めて確認された。加えて、PD-L1陽性の初回治療例に対するPembrolizumab単剤療法の有望な抗腫瘍効果が示され、毒性も管理可能であった。
現在、2nd-lineにおいてPembrolizumabとPaclitaxelを比較する第III相比較試験(KEYNOTE-061試験)7)、および1st-lineにおいてPembrolizumab単剤療法、Pembrolizumabと標準化学療法との併用療法、標準化学療法を比較する第III相比較試験(KEYNOTE-062試験)3)が進行中である。
(レポート:がん研有明病院 総合腫瘍科 福田 直樹)
References
- 1) Reck M, et al.: N Engl J Med. 2016; 375(19): 1823-1833[PubMed]
- 2) Muro K, et al.: Lancet Oncol. 2016; 17(6): 717-726[PubMed]
- 3) Study of Pembrolizumab (MK-3475) as First-Line Monotherapy and Combination Therapy for Treatment of Advanced Gastric or Gastroesophageal Junction Adenocarcinoma (MK-3475-062/KEYNOTE-062)[CT.gov]
- 4) Harada K, et al.: Gastric Cancer. 2017; 20(Suppl 1): 92-101[PubMed]
- 5) Lordick F, et al.: Ann Oncol. 2017; 28(8): 1767-1775[PubMed]
- 6) Kang YK, et al.: 2017 Gastrointestinal Cancers Symposium. abst #2[学会レポート]
- 7) A Study of Pembrolizumab (MK-3475) Versus Paclitaxel for Participants With Advanced Gastric/Gastroesophageal Junction Adenocarcinoma That Progressed After Therapy With Platinum and Fluoropyrimidine (MK-3475-061/KEYNOTE-061)[CT.gov]

加藤 健 先生
国立がん研究センター中央病院 消化管内科 医長