胆道癌に対する術後補助化学療法としてのGEMOXの第III相試験(PRODIGE 12-ACCORD 18試験)のRFSアップデートと初回OS結果
Adjuvant GEMOX for biliary tract cancer: Updated relapse-free survival and first overall survival results of the randomized PRODIGE 12-ACCORD 18 (UNICANCER GI) phase III trial
Julien Edeline, et al.
監修コメント
本演題は、胆道癌術後補助化学療法におけるGEMOX療法の有用性を検証した試験である。2017年消化器癌シンポジウムにおいて主要評価項目であるRFS(relapse-free survival)が報告され、今回のESMO 2017 CongressではRFSのupdateとOSが報告されたが、いずれも有意な差を認めなかった。一方、2017年米国臨床腫瘍学会年次集会では、英国からBILCAPと呼ばれるCapecitabineの胆道癌術後補助療法における有用性を検証した無作為化第III相試験の結果が報告された1)。その結果、CapecitabineはITT解析では有意差をわずかに認めなかったが、感度分析、per protocol解析では有意差を認め、Capecitabine補助化学療法が経過観察群に対し、優越性を示したとの内容であった。ITT解析での優越性の証明でないことに議論の余地が残るが、今後欧米では、Capecitabineが胆道癌術後補助療法の標準治療として位置付けられるであろう。
ただ、両試験ともに、術式、T stageなどの詳細な情報が報告されていない。胆道癌においては、腫瘍深達度によって術式が大きく異なり、肝葉切除や肝動脈合併切除を伴うこともある。その侵襲度により術後補助化学療法の忍容性は大きく異なる可能性があるが、現時点でその評価を行うことはできない。また、胆道癌の手術の質は世界各国で大きく異なる可能性があり、海外でのエビデンスを手術の質が高いと予想される本邦にそのまま外挿できるかどうかは、今後、慎重に判断する必要がある。現在、本邦では、胆管癌におけるGemcitabine術後補助化学療法2)、胆道癌におけるS-1術後補助化学療法3)の優越性を検証する第Ⅲ相試験が各々行われている。腫瘍深達度、術式、手術の質などにも注目して、検証試験の結果を待ちたい。
(コメント・監修:神奈川県立がんセンター 消化器内科 医長 上野 誠)
胆道癌術後補助化学療法
治癒切除後の胆道癌に対しては、経過観察が長らく標準治療であったが、2017年米国臨床腫瘍学会年次集会のBILCAP試験において、CapecitabineがOSの延長を示したことが報告された1)。しかし、ITT解析では統計学的有意差を示しておらず、いまだその解釈については議論の余地がある。一方、切除不能・進行胆道癌では、GemcitabineとCisplatinの併用療法(GC療法)4,5)が標準治療である。さらに、CisplatinをOxaliplatinに置き換えたGEMOX療法は、GC療法との直接比較はなされていないが、Cisplatinに比べて腎毒性が少なく簡便であることから、欧州で広く用いられている6)。
今回、治癒切除後胆道癌に対するGEMOX療法の有効性が期待され、標準治療である経過観察との無作為化第Ⅲ相試験が行われた。
主要評価項目をRFSとしてGEMOX療法の優越性を検証
本試験の主な適格規準は、R0またはR1切除が行われた胆道癌(肝内胆管癌、肝外胆管癌、胆嚢癌)、ECOG PS 0-2、術後3カ月以内、肝機能が保たれていることであった。対象患者は、原発部位(肝内胆管 vs. 肝外/肝門部 vs. 胆嚢)、R0 vs. R1切除、リンパ節転移の有無、施設の4つを層別因子として、GEMOX群と経過観察群に1:1で無作為に割り付けられた(図1)。なお、GEMOX群は、day 1にGemcitabine 1,000mg/m2、day 2にOxaliplatin 85mg/m2を投与し、2週1サイクルで計12サイクルまで投与した。また、両群ともにCTおよびCA19-9測定による再発確認を3ヵ月毎に2年間、3年目からは6ヵ月毎に行った。
主要評価項目は、RFSとQOLであり、RFS中央値を経過観察群18ヵ月、GEMOX群30ヵ月(HR=0.60)と仮定し、必要イベント数は126であった。
図1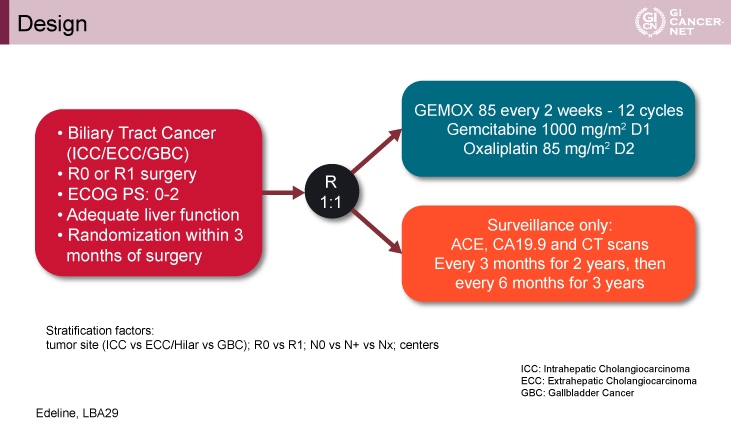
GEMOX療法によるRFSの有意な延長は認められず
患者背景は、GEMOX群/経過観察群でそれぞれ、ECOG PS 0が54%/64%、R1切除が14%/12%、リンパ節転移陽性が37%/36%、原発部位は肝内胆管癌が43%/46%、遠位胆管+肝門部胆管癌が39%/33%、胆嚢癌が18%/21%であった。なお、GEMOX群の95例中31例(33%)が12サイクル完遂し、平均サイクル数は9.7サイクルであった。
主要評価項目であるRFSの中央値は、GEMOX群30.4ヵ月、経過観察群18.5ヵ月と比較的大きな差が認められたが、統計学的有意差は認められなかった(HR=0.88, 95% CI: 0.62-1.25, p=0.47)(図2)。
図2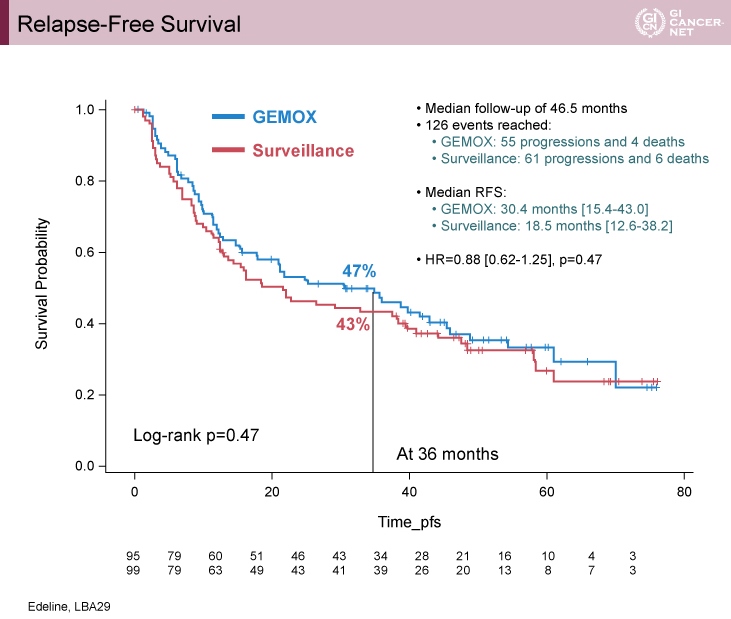
副次評価項目のOSについても、中央値はGEMOX群75.8ヵ月、経過観察群50.8ヵ月であったが、有意差は認められなかった(HR=1.08, 95% CI: 0.70-1.66, p=0.74)。 また、RFSのサブグループ解析では、原発巣、リンパ節転移の有無、R0/R1切除などにおいてGEMOXの有効性が期待できる患者集団は見出されなかった一方で、胆嚢癌においてはGEMOX群が有意に不良であった(HR=2.56, p=0.042)。
有害事象とQOL
QLQ-C30を用いたQOL調査では、試験登録時、1年後、2年後のいずれにおいてもGEMOX群と経過観察群の間に有意差を認めなかった。なお、GEMOX群におけるgrade 3/4の主な有害事象は、γGTP上昇30%/7%、ALP上昇10%/1%、末梢神経障害20%/1%、好中球減少14%/4%であり、忍容性は比較的高いと考えられた。
まとめ
胆道癌術後補助化学療法としてGEMOX療法の有効性は認められなかった。
(レポート:神奈川県立がんセンター 消化器内科 小林 智)
References
- 1) Primrose JN, et al.: 2017 Annual Meeting of the American Society of Clinical Oncology®: abstr#4006
- 2) 胆管癌切除例に対するゲムシタビン補助療法施行群と手術単独群の第Ⅲ相比較試験[UMIN-CTR]
- 3) 根治切除後胆道癌に対する術後補助療法としてのS-1療法の第III相試験 (JCOG1202, ASCOT)[UMIN-CTR]
- 4) Valle J, et al.: N Engl J Med. 362(14): 1273-1281, 2010[PubMed]
- 5) Okusaka T, et al.: Br J Cancer. 103(4): 469-474, 2010[PubMed]
- 6) Andre T, et al.: Br J Cancer. 99(6): 862-867, 2008[PubMed]
- 7) Stein A, et al.: BMC Cancer. 15: 564, 2015[PubMed]

上野 誠 先生
神奈川県立がんセンター 消化器内科 医長