進行肝細胞癌に対するLenvatinibとSorafenibの無作為化第III相試験におけるバイオマーカー解析
Analysis of serum biomarkers in patients from a phase 3 study of Lenvatinib vs. Sorafenib as first-line treatment for unresectable hepatocellular carcinoma
Richard S, Finn, et al.
監修コメント
2017年米国臨床腫瘍学会年次集会において、進行肝細胞癌におけるSorafenibに対するLenvatinibの非劣性を検証する無作為化第III相試験(REFLECT試験)の結果が報告された。本試験では、主要評価項目であるOSで非劣性を認めたものの、どの部分を非劣性として優れた点と考えるかが議論になった。アジア人においては毒性管理の難しい手足症候群の発現頻度の改善は重要な点であるが、手足症候群の頻度がより少ない欧米人においてはあまり重要視されなかった。むしろ、高血圧を主としたgrade 3以上の全毒性の発現割合はLenvatinib群が高く、ディスカッサントからは、QOL、コストなどについて優れた点を明示すべきで、両者を使い分けるバイオマーカーの開発も重要であるとのコメントがなされた。
今回のESMOでは、REFLECT試験のQOL解析の詳細報告が本演題とは別になされ、下痢、疼痛などの項目で、QOLが改善していることが報告された1)。両薬剤の使い分けは実臨床において近々の課題であり、本演題で報告されたバイオマーカー解析は非常に興味深いものであった。今後、進行肝細胞癌は免疫チェックポイント阻害剤の導入も予想されており、治療アルゴリズムが複雑になるなかで、治療、予後と関連するバイオマーカーの意義はますます重要になっていくと思われる。
(コメント・監修:神奈川県立がんセンター 消化器内科 医長 上野 誠)
切除不能進行肝細胞癌に対するLenvatinib
2017年米国臨床腫瘍学会年次集会において、進行肝細胞癌に対する1st-lineとしてLenvatinibとSorafenibを比較する無作為化第III相試験(REFLECT試験)の結果が報告され、Sorafenibに対するLenvatinibの非劣性が統計学的に証明された。また、副次評価項目であるPFS、TTP(time to progression)、奏効割合もLenvatinib群で優れていた。一方で毒性については、手足症候群の発現頻度はLenvatinib群で低かったものの、高血圧は高頻度であり、grade 3以上の全毒性の発現頻度はLenvatinib群がやや上回っていた。そのため、LenvatinibはSorafenibに置き換わる治療というより、Sorafenibと並ぶ進行肝細胞癌に対する1st-lineにおける選択肢とみなされた。そのため、今後はこの両薬剤の使い分けが注目されるところであり、本演題はその点に示唆を与えるものである。
REFLECT試験の954例中119例においてバイオマーカーを検討
REFLECT試験は全体で954例が組み入れられ、Lenvatinib群478例、Sorafenib群476例に割り付けられた。このうち、同意が得られた119例でバイオマーカー解析が行われ、血清バイオマーカー解析はLenvatinib群66例、Sorafenib群48例、遺伝子発現解析はそれぞれ34例、24例で行われた。バイオマーカー解析例における患者背景は、REFLECT試験全体とは若干異なり、欧米の症例がREFLECT試験全体では30%程度であったのに対して、バイオマーカー解析例では60~80%と高率であった。
血清バイオマーカー変動:治療にかかわらずVEGF, ANG2, FGF21が予後因子
血清バイオマーカー解析は、VEGF, ANG2, FGF19, FGF21, FGF23, PIVKA-IIについて解析され、ベースライン、1サイクル目のday 15、2~9サイクル目のday 1の各時点で測定された。その結果、VEGFは両群ともに治療開始後から上昇傾向を認めたが、Sorafenib群に比べてLenvatinib群でより上昇していた。また、Lenvatinib群では治療開始後にFGF19/23の上昇とANG2の低下を認めたが、Sorafenib群ではいずれも変動を認めなかった。一方、Sorafenib群ではPIVKA-IIの上昇を認めたが、Lenvatinib群では変動を認めなかった。
血清バイオマーカーと予後の関連性を検討したところ、症例数が少なく統計学的有意差を認めないものもあるが、両群ともに治療開始時のVEGF高値、ANG2高値、FGF21 高値で予後不良であった(表)。
表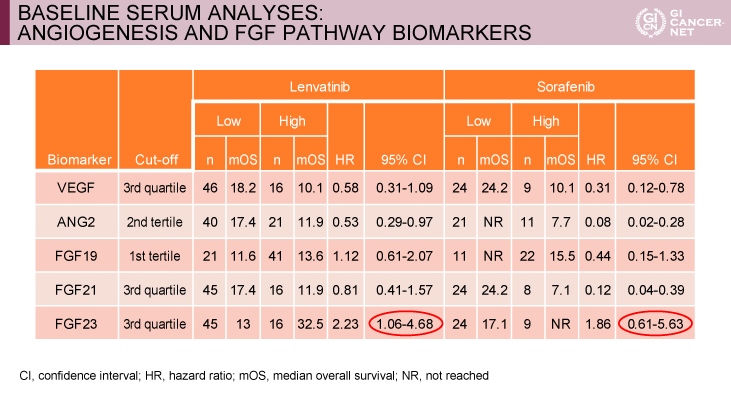
組織による遺伝子発現解析:VEGFおよびFGF高発現の有無がLenvatinibとSorafenibの効果予測因子に
遺伝子発現解析では、既存の組織検体を用いて799遺伝子の発現レベルが解析され、Lenvatinibの作用機序に関わる血管新生および成長因子関連の36遺伝子について検討された。このうち、VEGF高発現例(Group 1)、FGF高発現例(Group 2)、FGF・VEGF非高発現例(Group 3)の3群に分けて、OSについて比較検討された。なお、Group 1はLenvatinib群14例、Sorafenib群11例、Group 2はそれぞれ7例、5例、Group 3は13例、8例であった。
その結果、Sorafenib群ではGroup 3に対してGroup 1+2が有意に予後不良であった(HR=14.55, 95% CI: 1.87-113.14, p=0.0009)。一方、Lenvatinib群では、Group 3に対してGroup 1+2が有意に予後良好であった(HR=0.39, 95% CI: 0.16-0.91, p=0.0253)(図)。すなわち、VEGFまたはFGFが高発現である症例は、Sorafenib群では予後不良であり、Lenvatinib群では予後良好であった。
図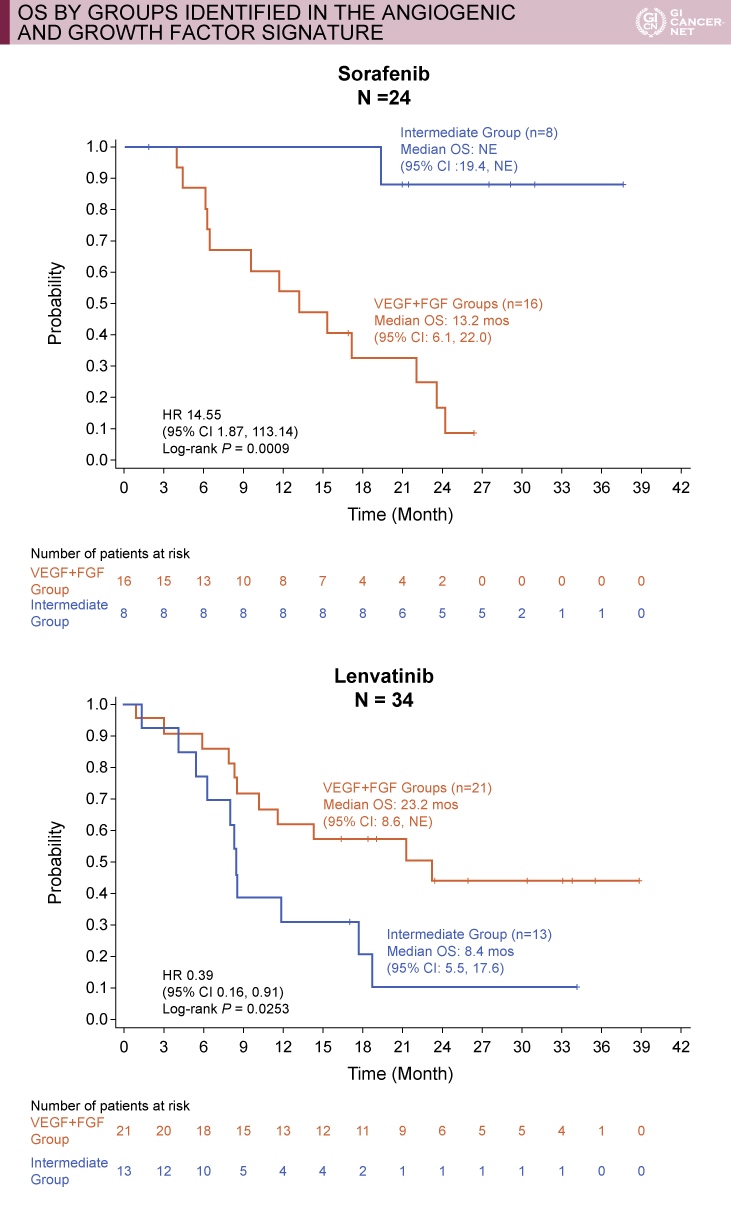
まとめ
血清バイオマーカー解析ではVEGF、ANG2、FGF21がSorafenibおよびLenvatinibの予後因子であることが示唆され、遺伝子発現解析ではVEGFおよびFGF遺伝子高発現がLenvatinibの効果予測因子であることが示唆された。ただし、本解析は少数例によるものであり患者背景もITT解析と異なるため、現在進行中の追加解析結果を待ちたい。
(レポート:神奈川県立がんセンター 消化器内科 小林 智)
Reference
- 1) Vogel A, et al.: ESMO 2017 congress: abstr#618O

上野 誠 先生
神奈川県立がんセンター 消化器内科 医長