HER2T発現の切除不能進行・再発大腸癌に対するTrastuzumab Deruxtecan(DS-8201a)第I相臨床試験最新結果
Updated results of phase 1 study of trastuzumab deruxtecan (DS-8201a) in HER2-expressing advanced colorectal cancer.
Takayuki Yoshino, et al.
監修コメント
遺伝子異常等をもとにした治療戦略化は肺癌領域で進んでいるが、現時点において大腸癌領域では抗EGFR抗体薬の無効因子としてRAS遺伝子変異検索が行われているに過ぎない。しかし、大腸癌領域でも個別化治療の開発は進んでおり、これまでBRAF V600E変異例を対象とした抗EGFR抗体薬+BRAF阻害薬+MEK阻害薬の有効性が報告され、現在、国際共同第III相試験が展開されている。
HER2に関してはこれまで乳癌、胃癌における抗HER2療法の開発が進み、Trastuzumab(Tmab)、Pertuzumab、Lapatinib、T-DM1の登場につながった。大腸癌に目を向けてみると、本邦におけるHER2発現は次世代シークエンサーを用いた解析で2.8%と報告されており1)、国内外において治療開発が始まっている2,3)が、まだ実用化には至っていない。
Trastuzumab Deruxtecan(DS-8201a)は抗HER2抗体にトポイソメラーゼI阻害薬を結合させた抗体薬物複合体(ADC)であり、その治療効果に関しては既に乳癌や胃癌をはじめとした多癌種で有効性が報告されている4-6)。中でも胃癌コホート5)ではHER2低発現(IHC2+、FISH陰性)の症例でも長期奏効例が報告されており、大腸癌コホートでも期待していたが、残念ながら本報告での奏効例はIHC3+の症例に限定されていた。また、他試験3)ではKRAS変異型での奏効例はみられなかったが、本試験ではKRAS変異例でも奏効例を認めたものの長期継続例はみられず、大腸癌における抗HER2療法開発に際しての対象絞り込みは、引き続き検討の余地があると思われた。
現在、HER2発現の切除不能進行・再発大腸癌を対象として、DS-8201aの有効性と安全性を評価する国際共同第II相試験が進行中である。IHC3+もしくはIHC2+/ISH陽性を対象としたコホートAに続き、IHC2+/ISH陰性を対象としたコホートB、IHC1+を対象としたコホートCも予定されており、その結果に期待するとともに、大腸癌領域における個別化医療のさらなる発展に期待したい。
(コメント・監修:北海道大学病院 消化器内科 助教 結城 敏志)
目的はTrastuzumab Deruxtecan(DS-8201a)の安全性と有効性の評価
本試験は、抗HER2抗体にトポイソメラーゼI阻害薬(DXd)を結合させた製剤であるTrastuzumab Deruxtecan[DS-8201a:HER2に対する抗体薬物複合体(ADC)]の安全性と有効性を評価することを目的に、日本と米国において、HER2陽性乳癌、HER2低発現乳癌、HER2陽性胃癌、HER2発現のその他固形癌患者を対象に実施された試験である。今回は、その他固形癌のうち大腸癌について安全性と有効性に関する最新データが発表された。
2018年8月までに、前治療を受けた切除不能進行・再発大腸癌患者20例が本試験に登録された。用量漸増パート(part 1)の結果を基に、HER2発現のその他固形癌(part 2d)を対象にDS-8201a 6.4mg/kgが3週毎に1回投与された。Part 2dにおける主要評価項目は、上記用量における安全性と忍容性の評価および有効性の評価であった。
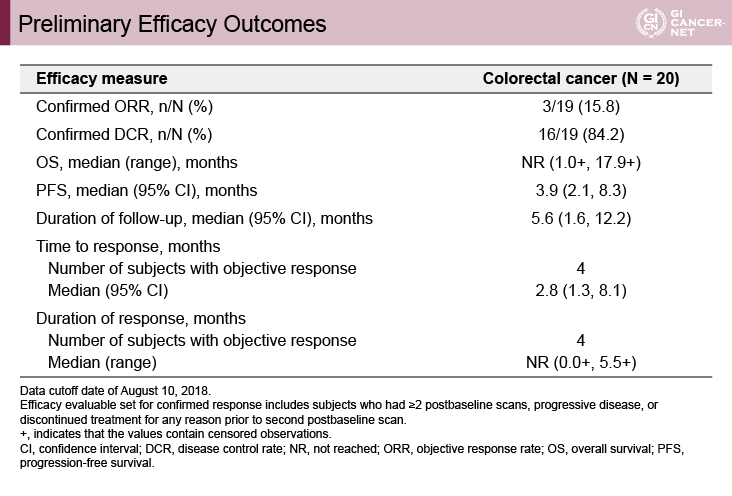
全奏効割合(ORR)15.8%、病勢制御割合(DCR)84.2%、無増悪生存(PFS)期間3.9ヵ月
患者背景は、年齢中央値59.5歳、ECOG PS(performance status)0が13例(65.0%)、1が7例(35.0%)であった。保存組織検体にて後方視的に行われた中央判定において、免疫組織化学染色(IHC)のHER2陽性が13例であった。その内訳は、3+が9例(45.0%)、2+が2例(10.0%)、1+が2例(10.0%)であり、0の症例が7例(35.0%)含まれていた。RAS遺伝子変異解析では、KRAS変異例が5例(25.0%)、NRAS変異例が2例(10.0%)であった。また、前治療にIrinotecan(IRI)が投与された症例は17例(85.0%)であった。
有効性の評価が行われたのは19例であり、全奏効割合(ORR)は15.8%(3/19)、病勢制御割合(DCR)は84.2%(16/19)、無増悪生存(PFS)期間は3.9ヵ月、奏効例4例(確定していない1例を含む)における奏効までの期間は2.8ヵ月であった。観察期間中央値は5.6ヵ月であり、今回の報告では全生存(OS)期間、奏効例における奏効期間(DR)は未到達であった(表1)。
表1 Preliminary efficacy outcomes(発表者の許可を得て掲載)
Waterfall plotでは縮小傾向を示している症例はIHC3+もしくは2+の症例のみであり、なかでも奏効例はIHC3+の症例のみであった(図1)。一方、IHC1+もしくはIHC0の症例では腫瘍縮小が認められなかった。RAS statusやIRI投与歴に関しては、その有無にかかわらず有効例が認められた。
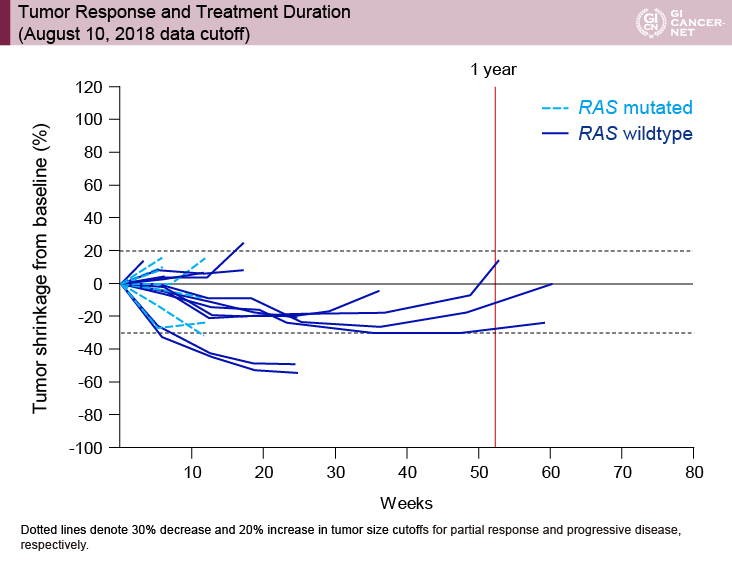
治療期間に関しては、長期治療例はRAS野生型に限定されており、RAS変異例で長期治療継続例はなかった(図2)。
図1 Best percent change in tumor size from baseline (August 10, 2018 data cutoff)(発表者の許可を得て掲載)
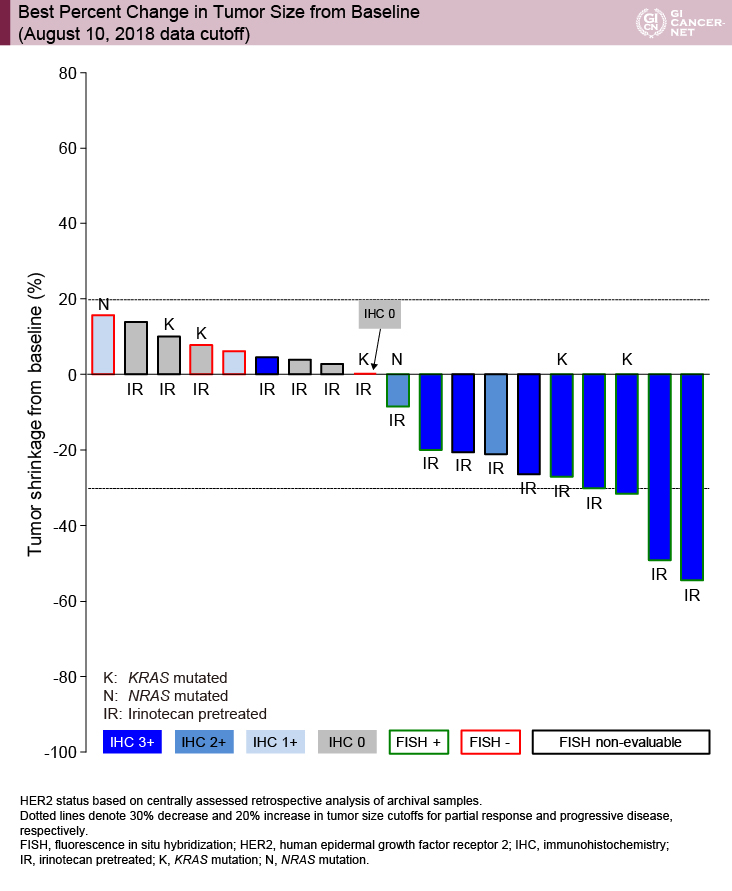
図2 Tumor response and treatment duration (August 10, 2018 data cutoff)(発表者の許可を得て掲載)
安全性については大腸癌以外の症例を含めた本試験の全体報告があり、part 1およびpart 2においてDS-8201a 5.4mg/kgもしくは6.4mg/kgを投与された259例中257例(99.2%)に有害事象が発現した。Grade 3以上の有害事象は140例(54.1%)、重篤な有害事象は59例(22.8%)、死亡に至った症例は12例(4.6%)であった。
発現頻度が30%以上の有害事象は、悪心192例(74.1%、9例≧Grade 3)、食欲不振147例(56.8%、12例≧Grade 3)、嘔吐113例(43.6%、6例≧Grade 3)、貧血98例(37.8%、50例≧Grade 3)、脱毛97例(37.5%、全例<Grade 3)、疲労88例(34.0%、6例≧Grade 3)、下痢87例(33.6%、5例≧Grade 3)、便秘85例(32.8%、2例≧Grade 3)であった。
(レポート:関西ろうさい病院 下部消化器外科 副部長 賀川 義規)

結城 敏志 先生
北海道大学病院 消化器内科 助教