MSI-H/dMMRの切除不能進行・再発大腸癌に対する初回治療としてのNivolumab+低用量Ipilimumab併用療法による長期治療効果
Durable clinical benefit with nivolumab plus low-dose ipilimumab as first-line in microsatellite instability ?high/mismatch repair deficient metastatic colorectal cancer.
Heinz-Josef J. Lenz, et al.
監修コメント
大腸癌に対して有効性の期待が少ないとされてきた免疫チェックポイント阻害薬であるが、2015年に開催されたASCOで初めてミスマッチ修復機構欠損(dMMR)の切除不能進行・再発大腸癌に対するPembrolizumabの有効性が報告され1,2)、マイクロサテライト不安定性(MSI-H)/dMMR大腸癌に対する治療開発に拍車がかかった。
今回報告があったCheckMate 142試験においては、既治療例のMSI-H/dMMR切除不能進行・再発大腸癌に対するNivolumab(NIVO)単剤コホートにて有効性が示され、すでに米国FDAで承認されている3)。統計学的な検定が行われたわけではないが、さらには、既治療例におけるNIVO+Ipilimumab(IPI)併用療法コホートでは、NIVO単独コホートの有効性を凌駕する全奏効割合(ORR)(NIVO単剤31% vs. NIVO+IPI併用51%)と生存延長効果[12ヵ月無増悪生存(PFS)割合はNIVO単剤50% vs. NIVO+IPI併用71%、12ヵ月OS割合はNIVO単剤73% vs. NIVO+IPI併用85%)を示し、FDA優先審査に指定されている4)。
今回は初回治療例に対するNIVO+低用量IPI併用療法の有効性が発表された。既治療例と投与スケジュールが異なっていたが、有害事象頻度はNIVO+低用量IPI併用療法において明らかに低頻度であり、有効性と安全性のバランスを考慮すると本スケジュールが良好である印象を受けた。また、本報告ではMSI-H/dMMRかつBRAF変異大腸癌に対する有効性も報告されており、良好な成績が示された。BRAF変異大腸癌は生命予後が悪いことが知られているが、現在進行中の既治療例に対する抗EGFR抗体薬+BRAF阻害薬+MEK阻害薬の開発5,6)と合わせて、MSI-H/dMMRかつBRAF変異型という稀少集団ではあるものの、治療選択の幅が広がる可能性を示した発表であった。
しかし、Pembrolizumabが同対象に対して国際共同第III相試験7)を実施しているのに対して、本試験は単アームの小規模第II相試験である。今後、この対象に対するNIVO+低用量IPI併用療法の開発において、検証的な第III相試験を実施するのかを含め、実臨床へのプロセスがどのように動いていくのかに注目していきたい。
(コメント・監修:北海道大学病院 消化器内科 助教 結城 敏志)
開発が進むMSI-H/dMMR切除不能進行・再発大腸癌の治療
切除不能進行・再発大腸癌の治療開発が進んでいるなか、高頻度マイクロサテライト不安定性(MSI-H)/ミスマッチ修復機構欠損(Mismatch Repair Deficient: dMMR)の症例に対する一次化学療法の有効性が乏しいことが報告されている8-10)。MSI-H/dMMRの進行再発大腸癌症例は遺伝子変異数(tumor mutation burden: TMB)が圧倒的に多く、また、腫瘍浸潤性リンパ球(tumor infiltrating lymphocyte: TIL)とクローン様リンパ球反応による独特の免疫腫瘍微小環境を有することから、免疫チェックポイント阻害薬の効果が非常に期待でき、すでに既治療例における抗PD-1抗体の有効性に関してはいくつも報告されている。
CheckMate 142試験におけるNivolumab(NIVO)+低用量Ipilimumab(IPI)併用療法コホート
CheckMate 142試験は、PD-1抗体であるNivolumab(NIVO)単剤療法、NIVOと抗CTLA-4抗体であるIpilimumab(IPI)との併用療法における有効性と安全性を検討した第II相試験であり、今回、CheckMate 142試験のうち一次治療としてのNIVO+IPI併用療法コホートの結果が報告された。
本コホートは、MSI-H/dMMRの切除不能進行・再発大腸癌を対象とし、NIVO(3mg/kgを2週間隔)とIPI(1mg/kgを6週間隔)の併用療法を、病勢進行(PD)や毒性などの理由による治療中止まで継続するスケジュールで実施された。このスケジュールは同薬剤併用の既治療コホート(NIVO 3mg/kg+IPI 1mg/kgを3週間隔×4回→その後はNIVO 3mg/kgを2週間隔)とは異なったスケジュールであり、IPIは低用量となっている。
主要評価項目は担当医判定での全奏効割合(ORR)、副次評価項目は中央判定での全奏効割合(ORR)、病勢制御割合(DCR)、奏効期間(DR)、無増悪生存(PFS)期間、全生存(OS)期間、安全性とされた。
本コホートには45例が登録され、患者背景は、年齢中央値66歳、男性23例(51%)、ECOG PS(performance status) 0/1は56%/44%、診断時臨床病期I-III/IVは62%/38%、PD-L1発現≧1%/<1%/不明は27%/58%/16%、BRAF/KRAS野生型/BRAF変異型/KRAS変異型/不明は29%/38%/22%/11%、Lynch症候群は18%であった。
各薬剤の投与コース中央値は、NIVOが24コース、IPIが8コースであり、解析時点で27例(60%)が投与継続中であった。治療中止例のうち7例(16%)がPD、薬剤関連有害事象による治療中止が3例(7%)であった。
BRAF変異例の全奏効割合(ORR)は71%、病勢制御割合(DCR)88%と良好
主要評価項目である担当医判定によるORRは60%[完全奏効(CR)3例(7%)、部分奏効(PR)24例(53%)]、安定(SD)が11例(24%)、PDが6例(13%)であり、DCRは84%であった。BRAF変異例は17例登録されたが、ORRは71%、DCRは88%と良好な成績が得られている。その他、PD-L1の発現の有無やLynch症候群の診断にかかわらず奏効が得られていた。
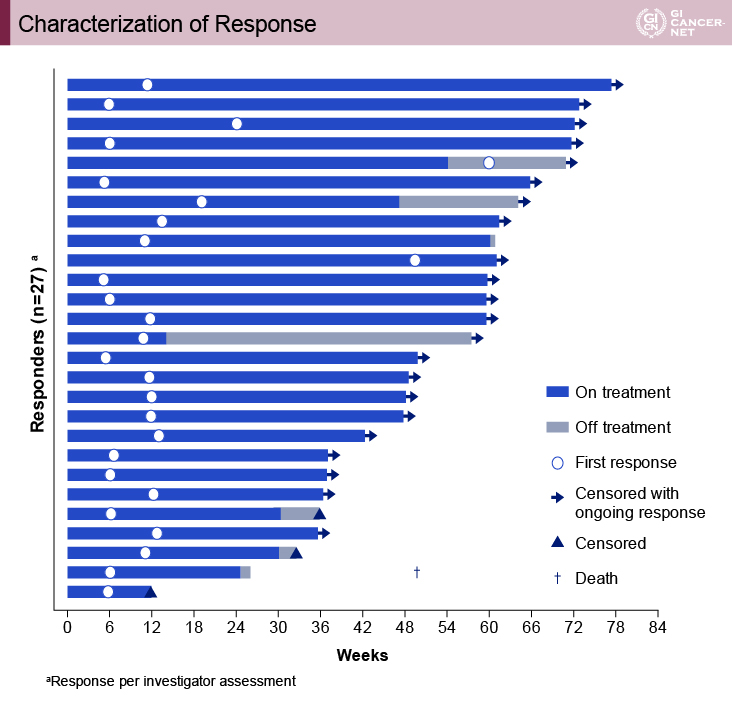
治療効果発現までの期間中央値は2.6ヵ月(1.2~13.8ヵ月)で、その治療効果継続は長期にわたっているものの、奏効期間中央値には至っていない。解析時点において82%の症例が効果継続中であり、6ヵ月以上治療効果が継続している症例も74%に認める一方、治療開始後48週(12ヵ月)を超えてから腫瘍縮小を認めた症例もあった(図1、図2)。
図1 Best reduction in target lesions(発表者の許可を得て掲載)
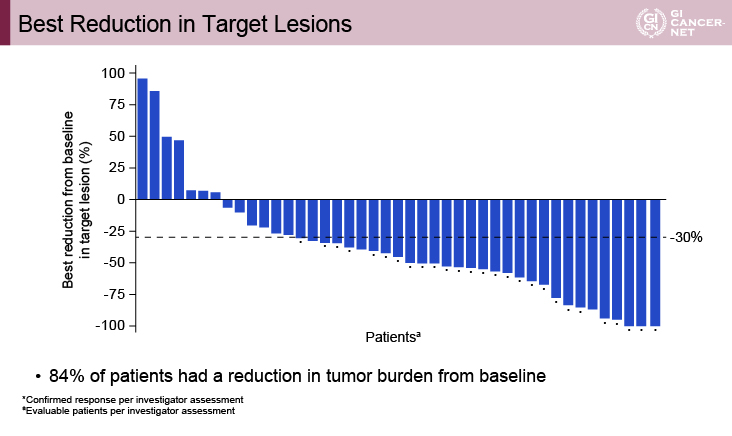
図2 Characterization of response(発表者の許可を得て掲載)
期待される長期の生存延長効果と忍容性
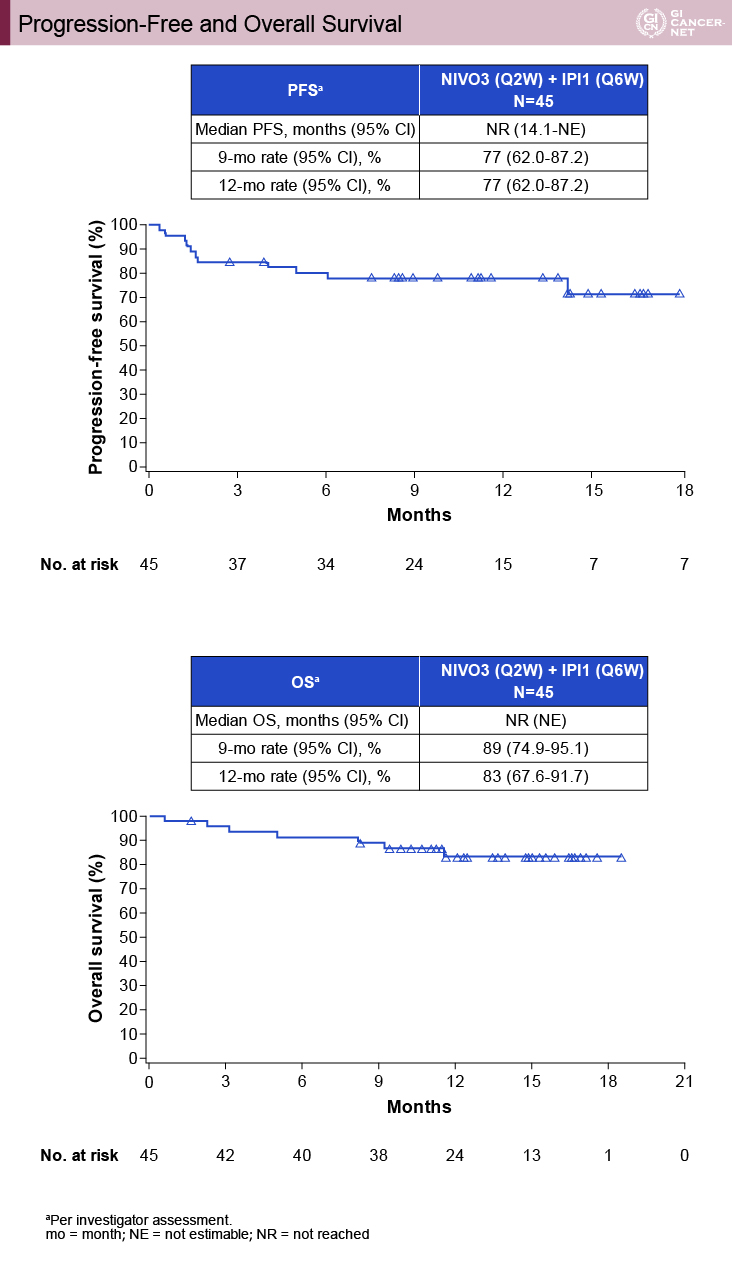
副次評価項目であるPFSおよびOSも、観察期間14ヵ月である今回の検討時には中央値に至っておらず、12ヵ月PFS割合は77%、OS割合は83%であり、長期の生存延長効果が期待される(図3)。
図3 Progression-free and overall survival(発表者の許可を得て掲載)
薬剤関連有害事象に関しては、皮膚関連有害事象(33%)、内分泌関連(24%)、肝臓関連(13%)、消化管関連(11%)、肺関連(2%)、腎臓関連(2%)を含め全体で78%の症例に副作用を認めたが、grade 3以上の重篤な有害事象割合は16%であり、治療中止に至る有害事象も7%と低く、忍容可能と考えられた。
(レポート:関西医科大学附属病院 がんセンター 学長特命准教授 佐竹 悠良)
References
- 1) Le DT, et al.: ASCO, 2015 #LBA100[ClinicalTrials.gov][Journal of Clinical Oncology]
- 2) Le DT, et al.: N Engl J Med. 372(26): 2509-2520, 2015[PubMed]
- 3) Overman MJ, et al.: Lancet Oncol. 18(9): 1182-1191, 2017[PubMed]
- 4) Overman MJ, et al.: J Clin Oncol. 36(8): 773-779, 2018[PubMed][Journal of Clinical Oncology]
- 5) BEACON試験:van Cutsem E, et al.: ASCO-GI, 2018 #627[ClinicalTrials.gov][ASCO Meeting Library]
- 6) BEACON試験:van Cutsem E, et al.: WCGC, 2018 #O-027[Annals of Oncology]
- 7) KEYNOTE-177試験:Diaz LA, et al.: ASCO-GI, 2018 #TPS877[ClinicalTrials.gov][Journal of Clinical Oncology]
- 8) Lee JJ, et al.: Clin Adv Hem Onc. 14(1): 46-54, 2016[Clinical Advances in Hematology & Oncology]
- 9) Heinemann V, et al.: ASCO, 2018 #3591[ASCO Meeting Library]
- 10) Venderbosch S, et al.: Clin Cancer Res. 20(20): 5322-5330, 2014[PubMed]
関連サイト
- ・CheckMate 142試験:ASCO 2017 #3531[学会レポート][ClinicalTrials.gov]

結城 敏志 先生
北海道大学病院 消化器内科 助教