TRIBE2試験:切除不能進行・再発大腸癌(mCRC)に対する一次治療と二次治療における戦略的研究(無作為化第III相試験;GONOグループ)
TRIBE2: a phase III, randomized strategy study by GONO in the 1st- and 2nd-line treatment of unresectable metastatic colorectal cancer (mCRC) patients (pts).
Chiara Cremolini, et al.
監修コメント
FOLFOXIRI[Fluorouracil(5-FU)+Leucovorin(LV)+Oxaliplatin(OX)+Irinotecan(IRI)]+Bevacizumab(Bmab)療法はイタリアのGONOグループが行ったTRIBE試験1,2)で有効性と安全性が示され、一次治療における標準治療の1つとして認識されるに至った。しかし、TRIBE試験では有効性の指標とされる無増悪生存期間(PFS)、全生存期間(OS)、奏効割合(RR)のすべてで有効性を示したものの、主要評価項目が一次治療のPFSであり、殺細胞性抗癌薬3種すべてを使用するTriplet+Bevacizumab(Bmab)と2種を使用するDoublet+Bmabを比較するには主要評価項目の設定が不適切であったのでは?といった疑問も挙がっていた。また、Triplet+Bmab療法での病勢進行(PD)後の二次治療として、Triplet再導入の有効性が過去の前向き試験の統合解析より示唆されていたが、すでに導入療法において殺細胞性抗癌薬3種すべてを使用してしまっているため、二次治療として最適なレジメンが明確になっていなかった。
そこで、TRIBE2試験では対照群を一次治療FOLFOX(5-FU+LV+OX)+Bmab療法から二次治療FOLFIRI(5-FU+LV+IRI)+Bmab療法に移行する戦略とし、試験群を一次、二次治療ともFOLFOXIRI(5-FU+LV+OX+IRI)+Bmab療法を行う戦略として、主要評価項目は2回目のPD(PFS2)に設定された。
結果、中間解析において主要評価項目が達成され、Doublet+Bmab逐次治療(FOLFOX+Bmab療法 → FOLFIRI+Bmab療法)に対するFOLFOXIRI+Bmab療法のPFS2における有用性が示された。また、本試験ではTRIBE試験よりも、RAS変異型、BRAF変異型、右側結腸癌の症例が多く登録されており、時代背景を反映しているものと思われるが、今後はOSデータ、およびRAS/BRAFステータス、腫瘍占居部位別といったサブグループ解析の結果が待たれる。
一方、二次治療への移行率および二次治療におけるプロトコール治療(FOLFIRI+Bmab療法、FOLFOXIRI+Bmab療法再導入)実施率は比較的高かったが、二次治療におけるFOLFOXIRI+Bmab療法再導入のFOLFIRI+Bmab療法に対するPFSの有効性は示せなかった。したがって、現時点ではTriplet+BmabでのPD後のFOLFOXIRI+Bmab療法再導入は、すべての症例に対して推奨されるかどうか疑問が残る。今後、PFS以外の二次治療の有効性(二次治療開始時点からのOSやRRなど)、相対用量強度(RDI)などの詳細なデータの報告が待たれる。
いずれにせよ本試験の結果よりTriplet+Bmabが切除不能進行・再発大腸癌(mCRC)初回治療例に対する大切な治療選択肢の1つであることが再認識され、今後のさらなる開発が期待される。
(コメント・監修:静岡県立静岡がんセンター 消化器内科 医長 山﨑 健太郎)
FOLFOXIRI(5-FU+LV+OX+IRI)+Bevacizumab(Bmab)療法は、一次治療として各国ガイドラインで推奨
TRIBE試験では、FOLFOXIRI[Fluorouracil(5-FU)+Leucovorin(LV)+Oxaliplatin(OX)+Irinotecan(IRI)]+Bevacizumab(Bmab)療法はFOLFIRI(5-FU+LV+IRI)+Bmab療法と比較し、奏効割合(RR)65% vs. 53%(p=0.006)、無増悪生存期間(PFS)12.1ヵ月vs. 9.7ヵ月[ハザード比(HR)=0.75、p=0.003]、全生存期間(OS)29.8ヵ月vs. 25.8ヵ月(HR=0.80、p=0.030)と、いずれも有意に良好であったことが報告され1,2)、切除不能進行・再発大腸癌(mCRC)に対する一次治療の有用な選択肢の1つとして各国のガイドラインで推奨されている。しかし、殺細胞性抗癌薬である3薬剤(フッ化ピリミジン系薬剤、OX、IRI)を逐次的に使用した場合との比較ではなかったことや、病勢進行(PD)後の二次治療の有効性と安全性が不明確であるといった臨床的な疑問が挙げられていた。一方、一次治療から二次治療にかけて血管新生阻害薬を継続することの有用性は多くの臨床試験で示されている3-6)。
TRIBE2試験の目的は、3種の殺細胞性抗癌薬を一次治療および二次治療で逐次的に使用するsequential strategy[FOLFOX(5-FU+LV+OX) → FOLFIRI療法]に対するTripletレジメン(FOLFOXIRI療法)の治療戦略の有用性を、血管新生阻害薬であるBmabの継続下にて検証することであった。
FOLFOX+Bmab療法 → FOLFIRI+Bmab療法と、FOLFOXIRI+Bmab療法の治療戦略を比較検討
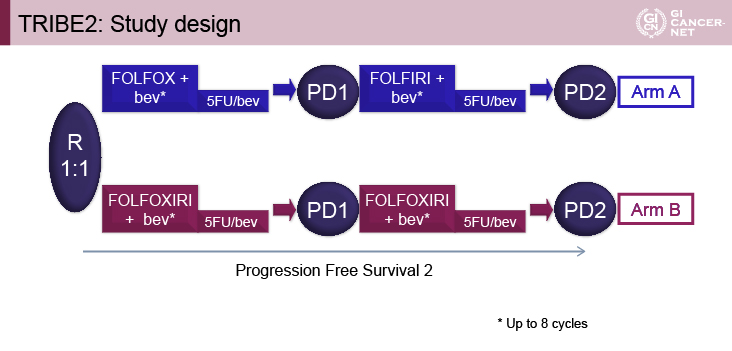
本試験は、一次治療としてFOLFOX+Bmab療法後に二次治療としてFOLFIRI+Bmab療法を行う群(A群)と、一次治療としてFOLFOXIRI+Bmab療法後に二次治療として再度同レジメンを行う群(B群)に、1:1に無作為化し比較検討した第III相試験である(図1)。一次治療、二次治療ともに併用療法(FOLFOX+Bmab、FOLFIRI+Bmab、FOLFOXIRI+Bmab)を最大8コース施行後は、5-FU+BmabをPDまで継続することとされた。適格基準は18歳から75歳、ECOG PS(performance status)0-2(71歳から75歳では0)、測定可能病変あり(RECIST ver1.1)、化学療法歴のない切除不能進行・再発大腸癌などである。
主要評価項目はPFS2で、無作為化から二次治療開始後のPDもしくは死亡までの期間と定義された。15ヵ月時点のPFS2割合をA群50%、B群60%(HR=0.77)、有意水準両側5%、検出率80%と設定し、必要イベント数は466(症例数654例)と計算された。中間解析が全体の3分の2イベント(303イベント)の時点で計画された。
図1 TRIBE2: study design(発表者の許可を得て掲載)
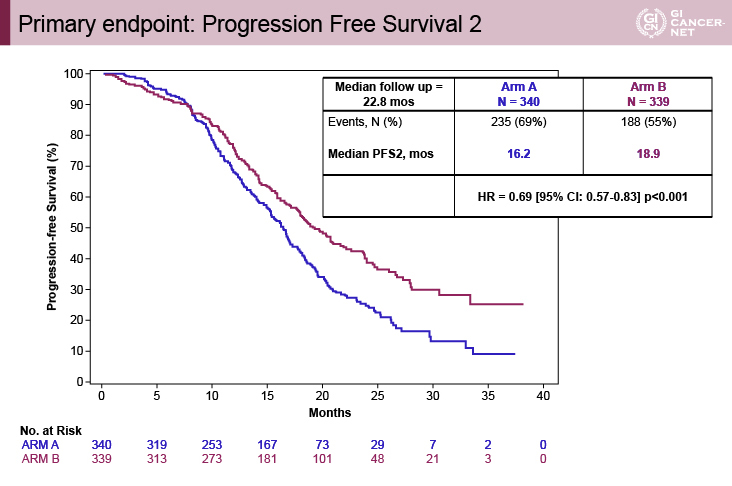
主要評価項目であるPFS2(無作為化から二次治療開始後の病勢進行もしくは死亡までの期間)は、FOLFOXIRI+Bmab療法が有意に良好
2015年2月から2017年5月の間に679例が登録され、2018年7月にPFS2のイベント数が423(A群235、B群188)の時点で中間解析が行われた。
患者背景は両群に大きな差はみられなかった。両群ともにRAS変異型が60%程度、BRAF変異型が10%含まれていた(表1)。
主要評価項目であるPFS2の中央値は、A群16.2ヵ月、B群18.9ヵ月[HR=0.69(95%信頼区間(CI):0.57-0.83、p<0.001]とB群で有意に良好であった(図2)。
表1 Patients’ characteristics ? ITT population(発表者の許可を得て掲載)
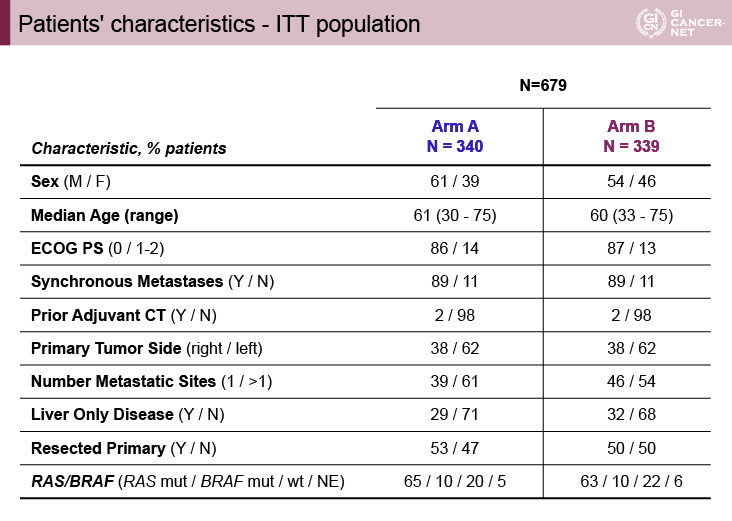
図2 Primary endpoint: progression free survival 2(発表者の許可を得て掲載)
一次治療におけるRRはA群50%、B群61%[Odds ratio=1.55(95% CI: 1.142-2.10)、p=0.005)とB群で有意に良好であった。一次治療におけるPFSはA群9.9ヵ月、B群12.0ヵ月(HR=0.73、p<0.001)とB群で有意に良好であったが、二次治療におけるPFSの中央値はA群5.5ヵ月、B群6.0ヵ月[HR=0.86(95% CI: 0.70-1.05)、p=0.120)と両群で有意差を認めなかった。A群の86%(248/288例)、B群の74%(194/261例)が二次治療に移行しており、規定された二次治療が、A群では88%(FOLFIRI±Bmab)、B群では76%(FOLFOXIRI±Bmab)に行われていた。
一次治療における安全性は、grade 3以上の有害事象のうち、下痢(A群5% vs. B群17%、以下同様)、好中球減少(21% vs. 50%)、発熱性好中球減少症(3% vs. 7%)の発現がB群で有意に多かった。
まとめ
中間解析において本試験の主要評価項目は達成され、sequential strategy(FOLFOX+Bmab療法 → FOLFIRI+Bmab療法)に対するFOLFOXIRI+Bmab療法の有効性が示された。本報告でFOLFOXIRI+Bmab療法はTRIBE試験と同様の成績が得られており、二次治療以降への悪影響はみられなかった。OSに関してはイベントが未だ40%程度のため、2019年報告の予定である。
(レポート:石川県立中央病院 腫瘍内科・消化器内科 医長 木藤 陽介)
References
- 1) Loupakis F, et al.: N Engl J Med. 371(17): 1609-1618, 2014[PubMed]
- 2) Cremolini C, et al.: Lancet Oncol. 16(13): 1306-1315, 2015[PubMed]
- 3) Bennouna J, et al.: Lancet Oncol. 14(1): 29-37, 2013[PubMed]
- 4) Masi G, et al.: Ann Oncol. 26(4): 724-730, 2015[PubMed]
- 5) Van Cutsem E, et al.: J Clin Oncol. 30(28): 3499-3506, 2012[PubMed]
- 6) Tabernero J, et al.: Lancet Oncol. 16(5): 499-508, 2015[PubMed]
関連サイト
- ・TRIBE試験[ClinicalTrials.gov][論文紹介]
- ・TRIBE2試験[ClinicalTrials.gov][PubMed][BMC Cancer]

山﨑 健太郎 先生
静岡県立静岡がんセンター 消化器内科 医長