難治切除不能進行・再発胃癌におけるFTD/TPI(TAS-102)vs. プラセボの無作為化二重盲検第III相試験(TAGS試験)
TAGS: a phase 3, randomised, double-blind study of trifluridine/tipiracil (TAS-102) versus placebo in patients with refractory metastatic gastric cancer.
Hendrik-Tobias Arkenau, et al.
監修コメント
本邦における胃癌薬物療法は、ここ数年の新規薬剤承認により選択の幅が広がってきた。胃癌治療ガイドライン(2018年1月改訂第5版)では、現在推奨される三次化学療法としては、Nivolumab(Nivo)(エビデンスレベルA)とIrinotecan(IRI)(エビデンスレベルB)が列挙されているが、今回、TAGS試験(TAS-102 Gastric Study)で対象とされた患者集団はまさにこのポジションに一致する。FTD/TPI(TAS-102)が胃癌への適応拡大を取得する際には、三次化学療法としてNivo、TAS-102、IRIの使い分けが必要となることが容易に想像できる。
TAS-102はすでに大腸癌領域で使用されている薬剤で、安全性も確認されており、「使い慣れた」薬剤であることは間違いない。今回報告されたサブグループ解析では、どのサブグループにおいてもTAS-102によって良好な成績が得られており、「患者を選り好みしない」薬剤である印象を受けた。今後、本剤においては、1)他の薬剤との使い分け(免疫チェックポイント阻害薬のnegative selectionを含む)、2)他の薬剤との併用療法、などさらなる研究、開発が進むことを期待したい。
本試験結果は演題発表日の2018年10月21日付でLancet Oncology誌にonline firstで掲載された1)。本論文は国立がん研究センター東病院の設楽紘平先生が筆頭著者となっており、本邦発の薬剤であるTAS-102の重要論文が日本人の手によって掲載されたことを誇らしく感じる。
(コメント・監修:北海道大学病院 消化器内科 助教 結城 敏志)
TAS-102群vs. プラセボ群の主要評価項目は全生存(OS)期間
TAGS試験(TAS-102 Gastric Study)は、標準治療に抵抗性となった切除不能進行・再発胃癌患者に対するFTD/TPI(TAS-102)の、プラセボに対する生存期間延長を検証した国際共同第III相試験である。すでに2018年6月にバルセロナで開催されたWCGC 2018において、その主要評価項目である全生存(OS)期間の効果が報告されている2)。
本試験は、2レジメン以上前治療を受けた18歳以上のECOG PS(performance status)0もしくは1の切除不能進行・再発胃癌患者を対象とし、TAS-102群とプラセボ群に2:1に無作為化された(TAS-102群337例、プラセボ群170例)。いずれの群も28日を1サイクルとし、1~5日目および8~12日目にTAS-102またはプラセボ35mg/m2を1日2回内服した。主要評価項目はOS期間、副次評価項目は無増悪生存(PFS)期間、全奏効割合(ORR)、病勢制御割合(DCR)、QOL、ECOG PSが2以上になるまでの期間である。
患者背景には両群間で大きな違いはなく、本試験治療終了後の後治療移行率も、TAS-102群25%、プラセボ群26%と差を認めなかった。
主要評価項目であるOS期間は、TAS-102群において有意に良好
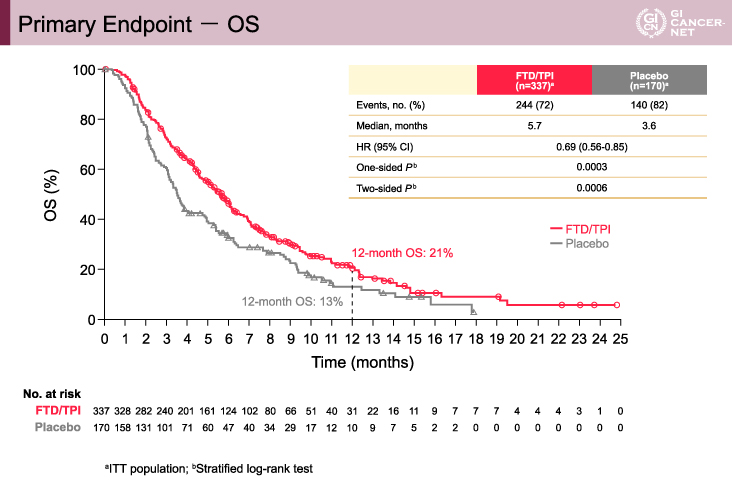
WCGC 2018で報告されたとおり、主要評価項目であるOS期間(中央値/12ヵ月OS割合)は、プラセボ群3.6ヵ月/13%に対して、TAS-102群は5.7ヵ月/21%[ハザード比(HR)=0.69(95% CI: 0.56-0.85、片側p=0.0003)]であり、TAS-102群が有意に良好であった(図1)。OS期間については、サブグループ解析の結果が今回初めて報告され、各サブグループにおいてTAS-102群が良好な結果であった。
図1 Primary endpoint ? OS(発表者の許可を得て掲載)
TAS-102群では、各副次評価項目も有意に良好
副次評価項目であるPFS期間(中央値/6ヵ月PFS割合)はWCGC 2018で報告されたとおり、プラセボ群1.8ヵ月/6%に対して、TAS-102群は2.0ヵ月/15%[HR=0.57(95% CI: 0.47-0.70)、p<0.0001]であり、TAS-102群において有意に良好であった(図2)。また、PFS期間についてもサブグループ解析の結果が今回初めて報告され、各サブグループにおいてTAS-102群が良好な結果であった。
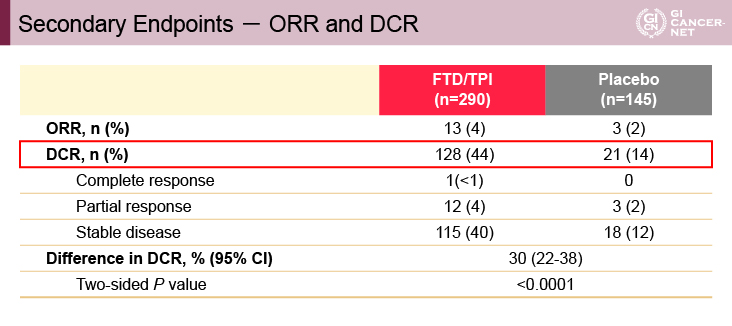
副次評価項目のORR、DCRに関しても初めて報告があった。腫瘍縮小効果はTAS-102群で1例の完全奏効(CR)と部分奏効(PR)12例を認め、ORRは13例4%であった。安定(SD)も含めたDCRはTAS-102群で44%であり、プラセボ群の14%に比べ有意に良好であった(p<0.0001)(表1)。
ECOG PSが2以上に悪化するまでの期間も、TAS-102群において有意に良好であった[4.3ヵ月vs. 2.3ヵ月、HR=0.69(95% CI: 0.56-0.85)、p=0.0005]。
図2 Secondary endpoint ? PFS(発表者の許可を得て掲載)
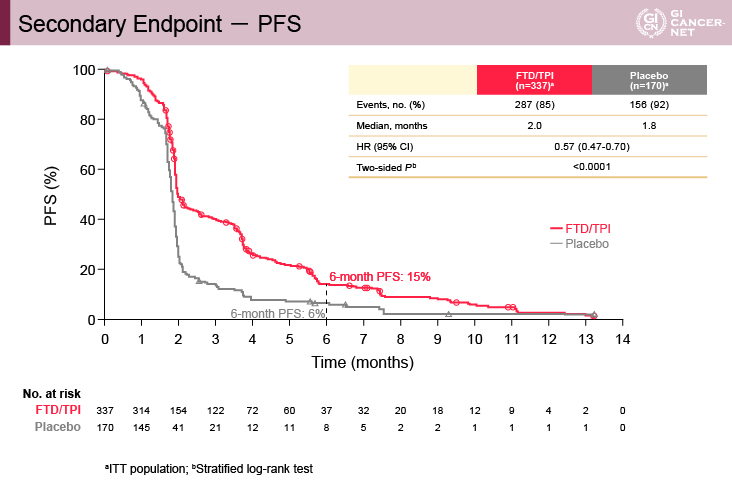
表1 Secondary endpoint ? ORR and DCR(発表者の許可を得て掲載)
有害事象による減量・休薬は約半数
有害事象に関しては既にWCGC 2018で報告されているとおりであるが、TAS-102群においてgrade 3以上の有害事象が多くみられ(TAS-102 80% vs. プラセボ58%)、好中球数減少(38% vs. 0%)や白血球減少(21% vs. 0%)、貧血(19% vs. 7%)、血小板数減少(6% vs. 0%)などの血液毒性が主であった。これら有害事象によるTAS-102の減量・休薬は58%で、13%の症例は試験治療中止となり、16%の症例でG-CSFを投与した。
(レポート:関西医科大学附属病院 がんセンター 学長特命准教授 佐竹 悠良)
References
- 1) Shitara K, et al.: Lancet Oncol. Online: October 21, 2018[Lancet Oncology]
- 2) TAGS試験:WCGC 2018 #LBA-002[ClinicalTrals.gov][ESMO]

結城 敏志 先生
北海道大学病院 消化器内科 助教