肝細胞癌に対するAtezolizumab+Bevacizumab投与の第Ib相試験における安全性と有効性のアップデート(GO30140試験)
Updated safety and clinical activity results from a Phase Ib study of atezolizumab + bevacizumab in hepatocellular carcinoma (HCC).
Michael J. Pishvaian, et al.
監修コメント
近年、肝細胞癌においては血管新生阻害薬の開発が盛んに行われ、Sorafenib、Lenvatinib、Regorafenib、Ramucirumab、Cabozantinibなどが標準治療として確立されている。次世代の治療として免疫チェックポイント阻害薬が注目され、複数の無作為化第III相試験が進行中である。特に、肝細胞癌は世界的に患者数が多く、グローバル製薬企業のもとで新規治療の開発が積極的に行われている。免疫チェックポイント阻害薬単体の開発を第一世代とすると、既に第二世代として併用療法の開発が始まっている。近年は、血管新生阻害薬と免疫チェックポイント阻害薬の併用により、腫瘍内でのTリンパ球の活性が増強することが報告されている。
本試験でも、血管新生阻害薬であるBevacizumab(Bmab)と、免疫チェックポイント阻害薬であるAtezolizumabの併用療法が行われた。本併用療法は、ASCO 2018において6割を超える奏効割合(RR)が報告され注目されていた治療であり、そのアップデートの結果である。今回RRが低下した理由は明確ではないが、症例数の増加により状態の悪い症例も加わった可能性、主治医判定の評価であるためその評価がばらついていた可能性なども挙げられる。いずれにしても併用療法により単独治療よりもRRは高いことが予想され、既に第III相試験が進行中であることから、その結果に期待したい。
(コメント・監修:神奈川県立がんセンター 消化器内科 医長 上野 誠)
進行肝細胞癌に対する血管新生阻害薬と免疫チェックポイント阻害薬併用投与の有効性が示唆されている
進行肝細胞癌患者に対する標準治療は、血管新生阻害薬も含むチロシンキナーゼ阻害薬であるが、LenvatinibとSorafenibの奏効割合(RR)はそれぞれ19%、7%と限定的である1)。一方、PD-1/PD-L1免疫チェックポイント阻害薬は単独投与で23%のRRが報告されており2)、血管新生阻害薬であるBevacizumab(Bmab)とPD-L1阻害薬であるAtezolizumabの併用投与は相乗効果が期待され、非臨床試験成績および他癌種での臨床試験成績が報告されている3)。そこで、進行肝細胞癌患者に対し、AtezolizumabとBmabを併用投与した際の安全性、忍容性、抗腫瘍効果を検討することを目的とした非盲検単群第Ib相試験が実施された。
AtezolizumabとBevacizumab(Bmab)を併用投与した第Ib相試験
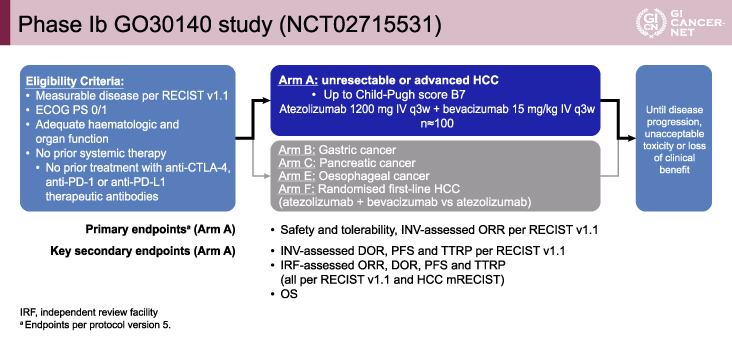
対象は、RECIST ver1.1に基づく測定可能病変を有する切除不能または進行肝細胞癌患者とされた。その他の主な適格基準として、全身化学療法未治療、ECOG PS(performance status)0または1、Child-Pughスコア7点まで、主要臓器機能保持、などが設定された。患者は、3週間を1サイクルとして、Atezolizumab 1,200mg+Bmab 15mg/kgを3週間隔で投与された(図1)。
主要評価項目には、安全性、忍容性、investigatorによってRECIST ver1.1に基づき評価された全奏効割合(ORR)が設定された。副次評価項目として、全生存(OS)期間のほか、investigatorによってRECIST ver1.1に基づき評価された奏効期間(DR)、無増悪生存(PFS)期間、無増悪期間(time to radiographic progression:TTRP)が、また、独立評価委員会によってRECIST ver1.1およびmodified RECISTに基づき評価された全奏効割合(ORR)、DR、PFS期間、TTRPがそれぞれ設定された。
図1 Phase Ib GO30140 study(NCT02715531)(発表者の許可を得て掲載)
Atezolizumab+Bevacizumab(Bmab)療法が良好な有効性を示唆
2018年7月26日のデータカットオフ時点で、Atezolizumab+Bmab療法を受けた103例が安全性の解析対象とされ、少なくとも16週経過観察された73例が有効性の解析対象とされた。
安全性解析対象となった103例の患者背景として、地域は日本を除くアジアから57%、日本または米国から41%、Child-Pughスコアは5点が74%、6点が20%、7点が6%、肝細胞癌の成因は、B型肝炎ウイルス(HBV)が50%、C型肝炎ウイルス(HCV)が29%、非ウイルス性(Non-viral)が21%であった。71%の患者で肝外病変、53%の患者で主要な脈管への侵襲(macrovascular invasion: MVI)を有し、α-フェトプロテイン(AFP)値400ng/mL以上は36%であった。
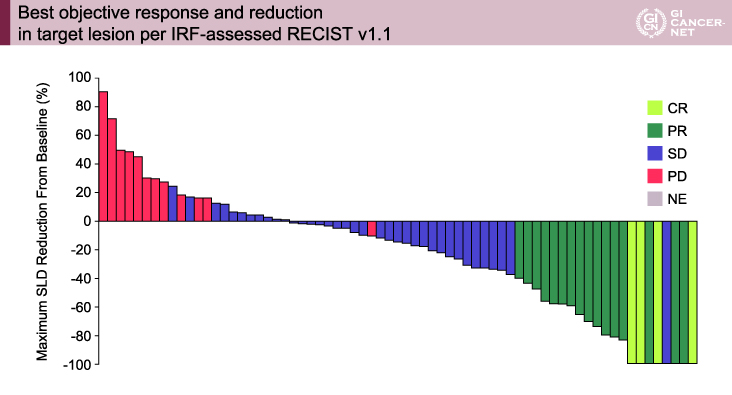
InvestigatorによってRECIST ver1.1に基づき評価された主要評価項目であるORRは32%(23/73例)であり(図2)、地域、肝細胞癌の成因、AFP値、肝外病変/主要脈管への侵襲の有無別において大きな差はみられず、同様に副次評価項目であるPFS期間中央値は14.9ヵ月であった。副次評価項目のうち独立評価委員会によってRECIST ver1.1に基づき評価されたORRは27%(20/73例)(図3)、PFS期間中央値は7.5ヵ月、modified RECISTに基づき評価されたORRは34%(25/73例)、PFS期間は7.5ヵ月であった。
安全性について、治療に関連したgrade 3または4の有害事象を27%、grade 5の有害事象を2%、重篤な有害事象を18%に認めた。20%以上の患者に認められた有害事象は食欲低下(28%)、疲労(20%)、皮疹(20%)、発熱(20%)であり、5%以上の患者に発現したgrade 3以上の有害事象は高血圧(10%)であった。
図2 Best objective response and reduction in target lesion per INV-assessed RECIST v1.1(発表者の許可を得て掲載)
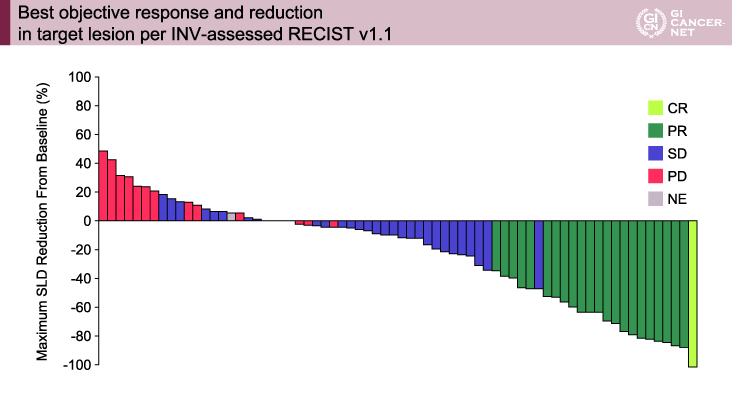
図3 Best objective response and reduction in target lesion per IRF-assessed RECIST v1.1(発表者の許可を得て掲載)
まとめ
進行肝細胞癌に対するAtezolizumabとBmabの併用投与による有害事象は管理可能であり、有望な抗腫瘍効果を示した。現在、進行肝細胞癌に対する一次治療としての有用性をSorafenibと比較する第III相試験が実施中である。
(レポート:金沢大学 先進予防医学研究センター 特任准教授 寺島 健志)
References
- 1) Kudo M, et al.: Lancet. 391(10126): 1163-1173, 2018[PubMed]
- 2) El-Khoueiry AB, et al.: Lancet. 389(10088): 2492-2502, 2017[PubMed]
- 3) McDermott DF, et al.: Nat Med. 24(6): 749-757, 2018[PubMed], McDermott DF, et al.: Nat Med. doi: 10.1038/s41591-018-0235-z[Epub ahead of print]
関連サイト
- ・GO30140試験[ClinicalTrials.gov]

上野 誠 先生
神奈川県立がんセンター 消化器内科 医長