腫瘍組織または血中循環腫瘍DNA(circulating tumor DNA:ctDNA)による、HER2陽性RAS遺伝子野生型切除不能進行・再発大腸癌(mCRC)に対するTrastuzumab(Tmab)+Pertuzumab併用療法の有効性:TRIUMPH試験のGOZILA Sub-study
TRIUMPH: Primary Efficacy of a Phase II Trial of Trastuzumab (T) and Pertuzumab (P) in Patients (pts) with Metastatic Colorectal Cancer (mCRC) with HER2 (ERBB2) Amplification (amp) in Tumor Tissue or Circulating Tumor DNA (ctDNA): A GOZILA Sub-study
Yoshiaki Nakamura, et al.
監修コメント
HER2陽性/RAS遺伝子野生型大腸癌に対するHER2標的併用療法の有効性は、HERACLES試験やMyPathway試験から報告されていたが、今回のESMOでは、本試験も含めてHER2陽性/RAS遺伝子野生型大腸癌を対象としたHER2標的療法の有効性が三演題発表された。
HER2陽性大腸癌は4%程度と希少な集団であり、第III相試験の実施は現実的ではない。本療法も、この第II相試験と疾患レジストリのデータを合わせて承認申請が行われると聞いている。
最新のNCCNガイドラインColon Cancer Version 3.2019では、Trastuzumab(Tmab)+Pertuzumab療法およびTmab+Lapatinib療法がHER2遺伝子増幅大腸癌の治療としてcategory 2Aで推奨され、米国では実質使用可能となった。本邦でも、がんゲノムプロファイリング検査が保険償還され、HER2陽性大腸癌も発見される可能性が高まってきた。治療薬も早々に本邦でも使用可能となって欲しい。
また、本発表では、腫瘍組織と血中循環腫瘍DNA(circulating tumor DNA:ctDNA)でHER2ステータスの一部不一致があったものの、ctDNAによる遺伝子解析でも、腫瘍組織とほぼ同様の治療効果が得られたことは興味深い。発表者の中村先生、およびTucatinibのデータを発表した米国のStrickler先生はともに若手腫瘍内科医のホープである。30歳代の2人の先生による素晴らしいディスカッションを聞いて、低侵襲で正確な新しい個別化医療の時代の到来をひしひしと感じた。
(コメント・監修:国立がん研究センター東病院 消化管内科 医長 谷口 浩也)
HER2陽性切除不能進行・再発大腸癌(mCRC)に対して、Trastuzumab(Tmab)+Pertuzumab併用療法は有効か?
切除不能進行・再発大腸癌(mCRC)において4%程度にERBB2遺伝子の増幅が認められる。ERBB2遺伝子増幅mCRCに対するHER2を標的とした治療の有効性が前臨床および臨床試験において報告されてきた。
本試験は、腫瘍組織または血中循環腫瘍DNA(circulating tumor DNA:ctDNA)でERBB2遺伝子増幅を検出したmCRC患者を対象として、Trastuzumab(Tmab)+Pertuzumab併用療法の有効性と安全性を評価する第II相試験である。
主要評価項目は腫瘍組織とctDNA各グループでの全奏効割合(ORR)
主な適格規準は、組織学的にmCRCと診断されていること、フッ化ピリミジン系薬剤、Irinotecan(IRI)、Oxaliplatin(OX)、抗EGFR抗体薬に不応・不耐であること、ECOG PS(Eastern Cooperative Oncology Group performance status)0/1、腫瘍組織でRAS遺伝子野生型、腫瘍組織でHER2陽性[IHC 3+またはFISH陽性(ERBB2/CEP17比≧2.0)]またはGuardant360を用いたctDNA検査でERBB2遺伝子増幅かつRAS遺伝子野生型であることであった。
Tmabはloading doseを8mg/kg、その後は6mg/kg、Pertuzumabはloading doseを840mg/回、その後は420mg/回で、3週毎に投与した。
主要評価項目は、腫瘍組織およびctDNAそれぞれでERBB2遺伝子増幅が確認されたグループでの担当医判断によるobjective response rate(objective RR)とした。サンプルサイズはobjective RRの閾値5%、期待値30%、検出力90%、片側α=0.025と設定し、それぞれのグループで25症例ずつと算出した。
腫瘍組織およびctDNAそれぞれのグループで良好な抗腫瘍効果が示された
初回評価が2019年1月17日に実施され、今回の発表となった。7施設から19症例が登録され、18症例でオッズ比(OR)が評価された。観察期間中央値(範囲)は5.7ヵ月(1.2-11.4ヵ月)であった。腫瘍組織でRAS遺伝子野生型かつHER2陽性が診断された17例中14例は、ctDNAでもERBB2遺伝子増幅かつRAS遺伝子野生型であった。ctDNAの結果が使用できなかった1例を含む3例はctDNAではERBB2遺伝子増幅またはRAS野生型が認められなかった。腫瘍組織ではHER2陰性であった1症例でctDNAでのERBB2遺伝子増幅かつRAS野生型が認められた(表1)。
表1 No. of Pts by Tissue/ctDNA ERBB2 Status(発表者の許可を得て掲載)

腫瘍組織HER2陽性グループ(17例)では、主要評価項目であるobjective RRは35.3%(95% CI: 14.2-61.7)であった。無増悪生存(PFS)期間中央値は4.0ヵ月(95% CI: 1.4-5.6)、ctDNAでRAS/BRAF/PIK3CA/ERBB2遺伝子のすべてが野生型症例は、いずれかが変異型の症例よりもPFS期間中央値が長かった[5.6ヵ月(95% CI: 2.8-7.7)vs. 1.4ヵ月(95% CI: 0.5-1.8)]。
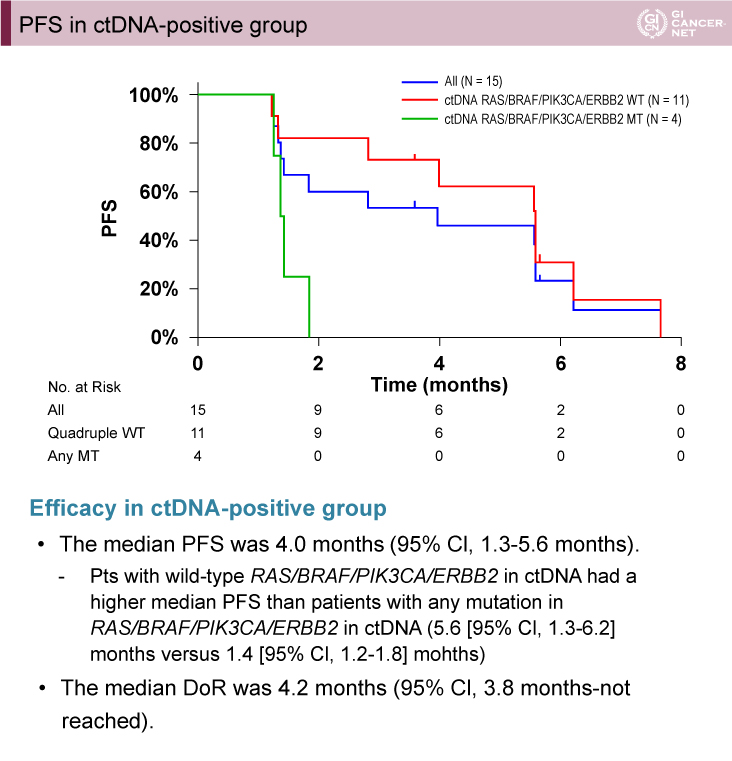
ctDNAでERBB2陽性であったグループ(15例)では、主要評価項目であるobjective RRは33.3%(95% CI: 11.8-61.6)であった。PFS期間中央値は4.0ヵ月(95% CI: 1.3-5.6)、ctDNAでRAS/BRAF/PIK3CA/ERBB2遺伝子のすべてが野生型症例は、いずれかが変異型の症例よりもPFS期間中央値が長かった[5.6ヵ月(95% CI: 1.3-6.2)vs. 1.4ヵ月(95% CI: 1.2-1.8)](図1、図2)。
安全性のプロファイルは既報と同様であった。重篤な有害事象を4例で認め、肺炎がGrade 2、インフュージョンリアクション(IRR:急性輸注反応)がGrade 2とGrade 3、呼吸困難がGrade 2、心拍出量低下がGrade 3であった。治療関連死は認めなかった。
図1 PFS in tissue-positive group(発表者の許可を得て掲載)
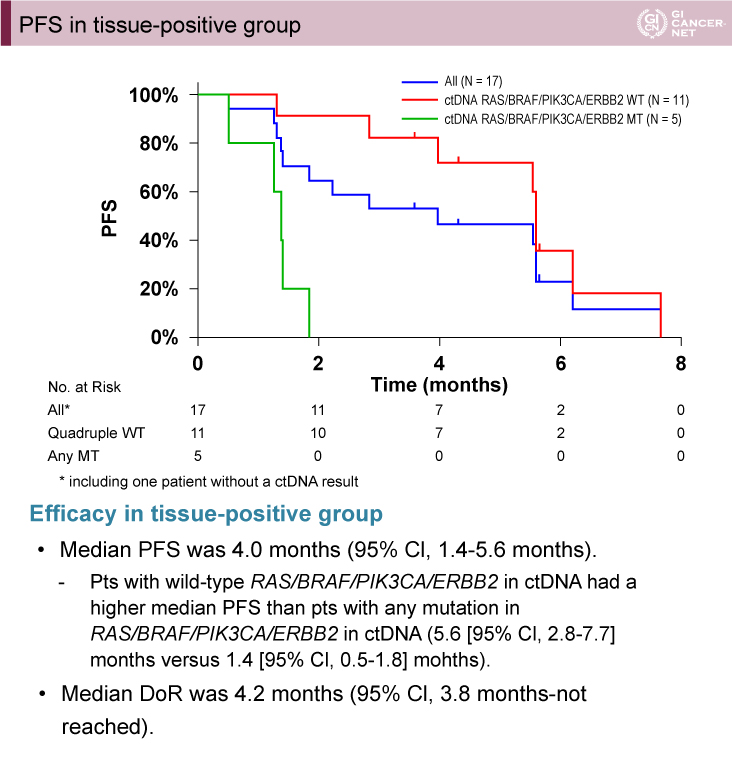
図2 PFS in ctDNA-positive group(発表者の許可を得て掲載)
まとめ
TRIUMPH試験は、ERBB2遺伝子増幅mCRCに対するHER2標的療法の有効性と安全性の評価を行った前向き試験である。組織およびctDNAいずれのERBB2遺伝子増幅の検出方法でも既治療mCRCに対してTmab+Pertuzumab併用療法は有効性が示され、忍容可能な毒性プロファイルであった。
(レポート:大分大学医学部附属病院 腫瘍内科 小森 梓)
関連サイト
- ・TRIUMPH試験(EPOC1602) [UMIN-CTR]
- ・HERACLES試験 [ClinicalTrials.gov][学会レポート(ASCO 2015 #3508)][論文紹介]
- ・MyPathway試験 [ClinicalTrials.gov][学会レポート(ASCO-GI 2017 #676)][論文紹介]
- ・NCCN Guidelines [NCCN]

谷口 浩也 先生
国立がん研究センター東病院 消化管内科 医長