IDH1遺伝子変異を有する進行胆道癌に対するIvosidenibの有効性を検証する二重盲検グローバル第III相試験(ClarIDHy試験)
ClarIDHy: A global, phase 3, randomized, double-blind study of ivosidenib vs placebo in patients with advanced cholangiocarcinoma with an isocitrate dehydrogenase 1 (IDH1) mutation
Ghassan K. Abou-Alfa, et al.
監修コメント
肝胆膵領域で最もインパクトがあった発表は、Plenary Sessionで発表された胆道癌に対するIvosidenibの有用性が示されたPhase IIIの結果であろう。本試験では既治療の胆道癌患者を対象とし、主要評価項目である無増悪生存(PFS)期間の有意な延長が認められた。Kaplan-Meier曲線も圧倒的に開いており、クロスオーバーが許容されていたにもかかわらず、全生存(OS)期間のKaplan-Meier曲線もIvosidenib群が明らかに上をいっていた。主要評価項目の結果は既にプレスリリースされており期待はしていたが、実際のKaplan-Meier曲線は期待以上の開きであった。
胆道癌に対する薬物療法として、昨年のESMOでは一次治療としてGCS療法[Gemcitabine(GEM)+Cisplatin(CDDP)+S-1]がOS期間を延長させたことが本邦から報告され、本年のASCOでは、二次治療としてmodified FOLFOX療法[Fluorouracil(5-FU)+Leucovorin(LV)+Oxaliplatin(OX)]の有用性が報告された。このように、胆道癌では殺細胞性抗癌薬が標準治療であり、これまで分子標的薬の開発は成功していなかった。
一方近年、胆道癌では、今回標的とされたIDH1/2(isocitrate dehydrogenase 1/2)遺伝子変異やFGFR融合遺伝子が比較的高い割合で認められることが報告されており、同様に、BRAFやHER2遺伝子に変異のある患者を対象とした治療開発も進められている。このうちIDH1遺伝子を標的としたIvosidenibの有用性が今回初めて示された。
胆道癌は海外では希少癌に分類され、しばしば臓器横断的なバスケットトライアルに組み込まれる。本邦でも遺伝子パネル検査が導入され、今回の成功を契機に胆道癌領域でも、遺伝子変異に基づき対象を限定した治療開発が進んでいくことが想定される。
(コメント・監修:金沢大学 先進予防医学研究センター 特任准教授 寺島 健志)
IDH1遺伝子変異は胆道癌の約20%でみられる
IDH(isocitrate dehydrogenase)遺伝子に変異をきたすと、DNAのヒストン脱メチル化が阻害され、細胞の癌化に寄与することが知られている1)。癌種別の遺伝子変異頻度は、神経膠腫(60~90%)や急性骨髄性白血病(10~40%)、血管免疫芽球性T細胞リンパ腫(angioimmunoblastic T-cell lymphoma:AITL)(10~40%)、軟骨腫瘍(50~70%)で高く、胆道癌では約20%の症例で遺伝子変異を有することが報告されている2,3)。
Ivosidenib(AG-120)はIDH1遺伝子変異蛋白を阻害する低分子化合物であり、米国では既に急性骨髄性白血病に対して米国FDA承認を受けている薬剤である。進行胆道癌に対しては、IDH1遺伝子変異を有する既治療の進行胆道癌73症例を対象とした第I相試験においてOS期間中央値13.8ヵ月、PFS期間中央値3.8ヵ月と有望な結果が報告され、今回、ClarIDHy試験が立案された4)。
主要評価項目は無増悪生存(PFS)期間、進行胆道癌に対するIvosidenib療法の有効性を検証
本試験の主な適格基準は、18歳以上、病理組織学的に診断された進行胆道癌、IDH1遺伝子変異が中央判定により次世代シークエンサー(next generation sequencer:NGS)装置(OncomineTM Focus Assay)を用いて確認されていること、ECOG PS(Eastern Cooperative Oncology Group performance status)0/1、前治療歴有り[少なくともGemcitabine(GEM)あるいはFluorouracil(5-FU)含有レジメンによる治療を受けていること]、測定可能病変を有すること、骨髄/肝/腎機能が保たれていることであった。
登録患者は前治療数で層別化され、Ivosidenib群(500mg/日)とプラセボ群に2:1に二重盲検法で割り付けられた。病勢増悪(disease progression)時にはプラセボからIvosidenib群へのクロスオーバーが許容された。
主要評価項目は、盲検下の独立中央画像判定機関(independent radiology center:IRC)による無増悪生存(PFS)期間(RECIST 1.1に基づく判定)、副次評価項目は、安全性および忍容性、主治医判定によるPFS期間、全生存(OS)期間、objective response rate(objective RR)、QOL、薬物動態学/薬力学であった。
PFS期間のハザード比(HR)を0.5と仮定し、有意水準片側2.5%、検出力96%と設定し、必要症例数は186例と算出された。
Ivosidenib群はプラセボ群に対し、PFS期間における優越性を示した
本試験は6ヵ国(本邦を含まない)49施設で実施され、780例がNGSスクリーニング検査を受けた。最終的に185例が登録され、Ivosidenib群に124例、プラセボ群に61例が割り付けられた。
患者背景に関しては両群の群間差は認められなかった。部位別には肝内胆管癌がIvosidenib群111例(89.5%)、プラセボ群58例(95.1%)とIDH1遺伝子変異例の大多数が肝内胆管癌であった(表1)。プラセボ群のうち、35例(57.4%)が病勢増悪後にクロスオーバーしてIvosidenibの投与を受けた。
主要評価項目の独立中央画像判定機関(IRC)によるPFS期間は(以下、Ivosidenib群vs. プラセボ群)、HR=0.37(95% CI: 0.25-0.54、p<0.001)、PFS期間中央値2.7ヵ月vs. 1.4ヵ月、6ヵ月PFS割合32% vs. NE、1年PFS割合22% vs. NEであり、Ivosidenib群の統計学的な優越性が示された(図1)。また、いずれのサブグループでもIvosidenib群で良好な結果であった。
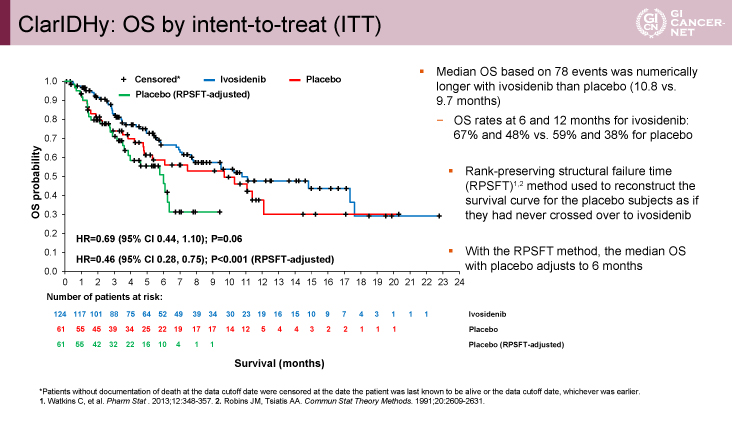
副次評価項目のOS期間に関しては、intent-to-treat(ITT)解析においてはHR=0.69(95% CI: 0.44-1.10、p=0.06)でIvosidenib群の統計学的な優位性が示せなかったものの、OS期間中央値10.8ヵ月vs. 9.7ヵ月、6ヵ月OS割合67% vs. 59%、1年OS割合48% vs. 38%であり、Ivosidenib群で良好な傾向であった。一方、rank-preserving structural failure time(RPSFT)5,6)法を用いてプラセボ群のクロスオーバーの影響を除去した場合のOS期間に関しては、HR=0.46(95% CI: 0.28-0.75、p<0.001)、OS期間中央値10.8ヵ月vs. 6.0ヵ月であり、Ivosidenib群の優越性が明らかになった(図2)。objective RRに関しては、部分奏効(PR)2% vs. 0%、PR+安定(SD)の病勢コントロール割合(DCR)53% vs. 28%であり、Ivosidenib群で良好な結果であった。
有害事象に関しては、Grade 3以上の有害事象がIvosidenib群46.2%、プラセボ群35.6%に認められ、特に腹水(7.7% vs. 6.8%)、ビリルビン上昇(5.8% vs. 1.7%)、貧血(5.1% vs. 0%)、AST上昇(5.1% vs. 1.7%)がIvosidenib群において多く認められたものの、いずれも許容範囲内であった。また、今回の試験では、EQ-5D-5L、EORTC QLQ-C30およびQLQ-BIL、PGI questionsを用いたQOLを調査したが、Ivosidenib群で良好な結果であった。
表1 ClarIDHy: Baseline characteristics(発表者の許可を得て掲載)
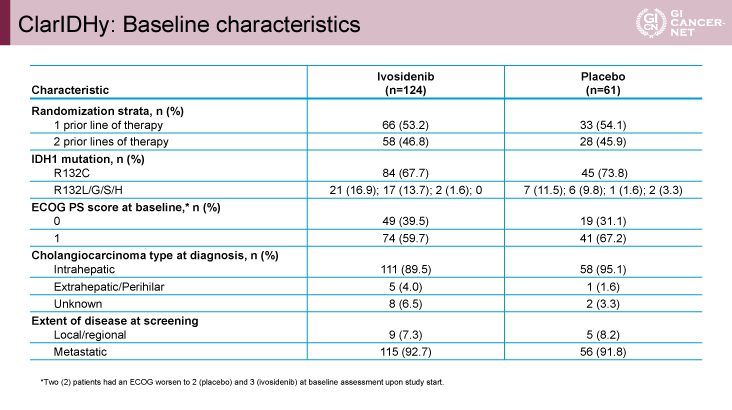
図1 ClarIDHy: PFS by IRC(発表者の許可を得て掲載)
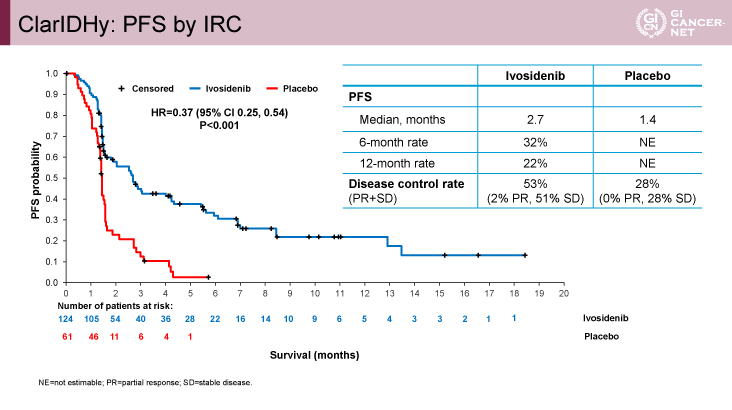
図2 ClarIDHy: OS by intent-to-treat (ITT)(発表者の許可を得て掲載)
まとめ
既治療のIDH1遺伝子変異を有する進行胆道癌に対し、Ivosidenib療法はプラセボに対し、PFS期間における優越性を示した。また、本試験の結果から、胆道癌においてがん遺伝子パネル検査等による遺伝子変異に基づく有用性が示唆された。
(レポート:慶應義塾大学病院 腫瘍センター 林 秀幸)
References
- 1) Lu C, et al.: Nature. 483(7390): 474-478, 2012 [PubMed]
- 2) Cairns RA, et al.: Cancer Discov. 3(7): 730-741, 2013 [PubMed]
- 3) Boscoe AN, et al.: J Gastrointest Oncol. 10(4): 751-765, 2019 [PubMed]
- 4) Lowery MA, et al.: Lancet Gastroenterol Hepatol. 4(9): 711-720, 2019 [PubMed]
- 5) Watkins C, et al.: Pharm Stat. 12(6): 348-357, 2013 [PubMed]
- 6) Robins JM, et al.: Commun Stat Theory Methods. 20(8): 2609-2631, 1991 [tandfonline.com]
関連サイト
- ・ClarIDHy試験 [ClinicalTrials.gov]
- ・KHBO1401試験 [UMIN-CTR]
- ・KHBO1002試験 [UMIN-CTR]

寺島 健志 先生
金沢大学 先進予防医学研究センター 特任准教授