IDEA FRANCE第III相試験における血中循環腫瘍DNA(ctDNA)の解析結果:術後補助化学療法の至適投与期間のための予後予測因子(IDEA collaboration)
Analysis of circulating tumor DNA (ctDNA) from patients enrolled in the IDEA-FRANCE phase III trial: prognostic and predictive value for adjuvant treatment duration
Julien Taieb, et al.
監修コメント
微小残存病変(minimal residual disease:MRD)検出に血中循環腫瘍DNA(circulating tumor DNA:ctDNA)測定が有用であることは多数報告されている1,2)。
今回、IDEA(International Duration Evaluation of Adjuvant chemotherapy)collaborationの1つであるIDEA FRANCE試験での血液検体を用いたTR(translational research)解析結果が報告された。本結果でも、やはり術後ctDNA陽性は強い予後不良因子となることが再現された。
しかし、そのハザード比(HR)は1.85と、従来報告されている5を超えるような大きな差ではなく、少し物足りない印象であった。その要因としては、ctDNA陽性群においても再発していない患者集団が一定程度含まれていることである。術後補助化学療法(adjuvant chemotherapy)により再発が抑えられているとも考えられるが、本報告ではメチル化マーカーを用いた独自法によるMRD検出が用いられている。また検体も古くEDTA管に保管されていたと聞いている。測定法や検体状況の違いが既報との結果の違いに影響しているのかもしれない。
予測因子(6ヵ月vs. 3ヵ月)の解析については、IDEA FRANCE試験がIDEA collaboration全体解析と異なる結果であることから、6ヵ月、3ヵ月の至適期間とctDNA陽性/陰性との関連については、慎重に解釈するべきと考える。
今後、他のIDEA試験による同様の解析結果が待たれる。演題発表前から本発表内容に期待していたが、発表後は少しもやもやが残った。
(コメント・監修:国立がん研究センター東病院 消化管内科 医長 谷口 浩也)
IDEA FRANCE試験では、FOLFOX療法の3ヵ月投与に比べ6ヵ月投与の3年無病生存(DFS)が有意に高い
IDEA collaborationは、結腸癌に対する術後補助化学療法(adjuvant chemotherapy)としてのFOLFOX療法[Fluorouracil(5-FU)+Leucovorin(LV)+Oxaliplatin(OX)]またはCapeOX療法[Capecitabine+Oxaliplatin(OX/L-OHP):XELOX療法]の投与期間について、3ヵ月間と6ヵ月間を比較した6つの前向き第III相無作為化試験[SCOT試験(英国、オーストラリア、デンマーク、スペイン、スウェーデン、ニュージーランド)、TOSCA試験(イタリア)、CALGB/SWOG C80702試験(米国、カナダ)、IDEA FRANCE試験(フランス)、ACHIEVE試験(日本)、HORG試験(ギリシャ)]を統合解析した研究である。
IDEA FRANCE試験には2,010例が登録され、その90%がFOLFOX(mFOLFOX 6)を投与された。本試験では、3ヵ月投与群と比較し6ヵ月投与群において3年無病生存(DFS)割合が有意に高い結果であることが報告されている[3ヵ月投与群72% vs. 6ヵ月投与群76%、ハザード比(HR)=1.24、95% CI: 1.05-1.46、p=0.0112]3)。
血中循環腫瘍DNA(circulating tumor DNA:ctDNA)で微小残存病変(minimal residual disease:MRD)を検出
末梢血中のctDNAは治癒切除後の患者のMRD検出に有用であることが報告されており1,2)、今回、IDEA FRANCE試験内でのctDNA解析結果が報告された。
検体は、術後補助化学療法開始前にEDTA採血管を用いて採取された。ctDNA解析は、WIF1遺伝子とNPY(神経ペプチドY:neuropeptide Y)のメチル化マーカーをデジタルPCR(polymerase chain reaction)により解析するhomebrew assayが用いられた。
2,010例のうち1,346例から血液検体が採取され、そのうち805例がctDNAの解析対象となった。696例(86.5%)がctDNA陰性、109例(13.5%)がctDNA陽性であった。
患者背景において、ctDNA陽性群は陰性群と比較し、穿孔率(陽性群8.3% vs. 陰性群3.9%、p=0.0476)、低分化型の割合(陽性群13.6% vs. 陰性群7.1%、p=0.0224)が有意に高かった。その他の患者背景に差は認めなかった。
ctDNA陽性は予後不良であり、再発高リスク群(T4またはN2)患者での差が著明
2年DFS割合は、ctDNA陽性群64.12%(95% CI: 54.19-72.44)vs. 陰性群82.39%(95% CI: 79.32-85.05)で、HR=1.85、95% CI: 1.31-2.61、p<0.001とctDNA陽性群で不良であった(図1)。多変量解析でもctDNA陽性(HR=1.85、p=0.0005)、N2(≧4)(HR=2.09、p<0.0001)は予後不良因子であった。
治療期間別の解析では、ctDNA陽性群における3ヵ月間の治療期間で最も再発が高い結果であった(p<0.0001)(図2)。
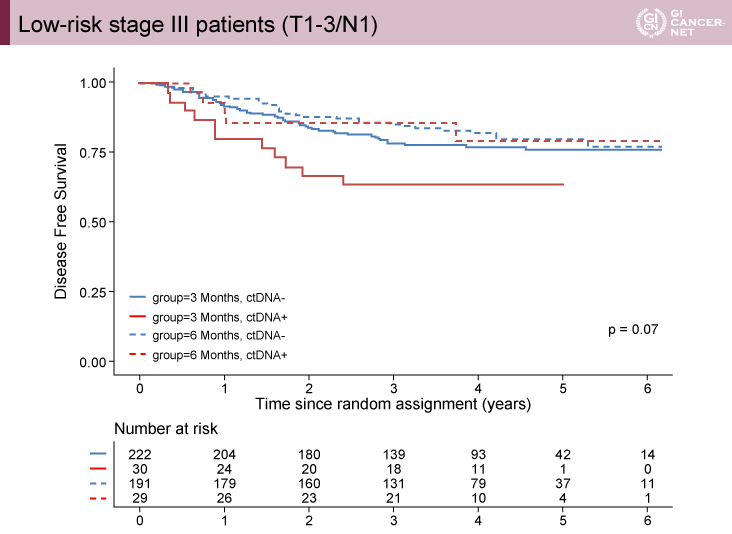
さらに、T4またはN2(≧4)の高リスクStage III群ではctDNA陽性群が有意であり(p<00001)、T1-3かつN1(1-3)の低リスクStage III群では有意差は認めなかった(p=0.07)(図3、図4)。
図1 ctDNA prognostic value(発表者の許可を得て掲載)
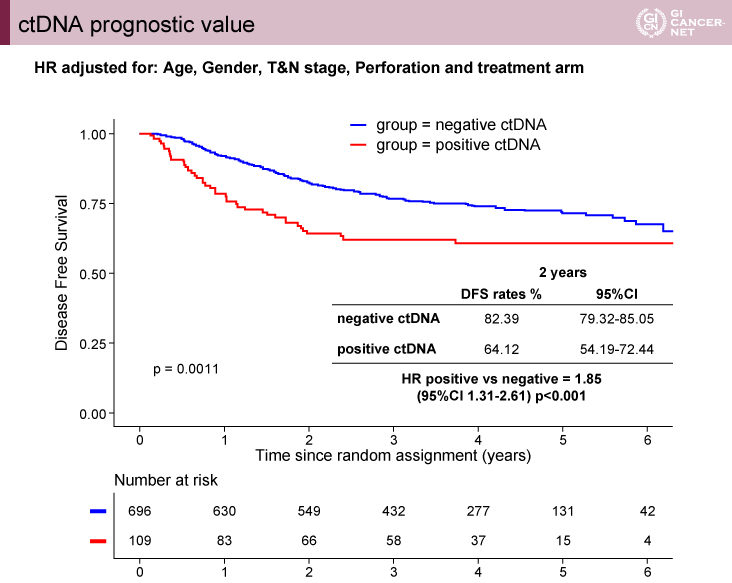
図2 ctDNA and treatment arm(発表者の許可を得て掲載)
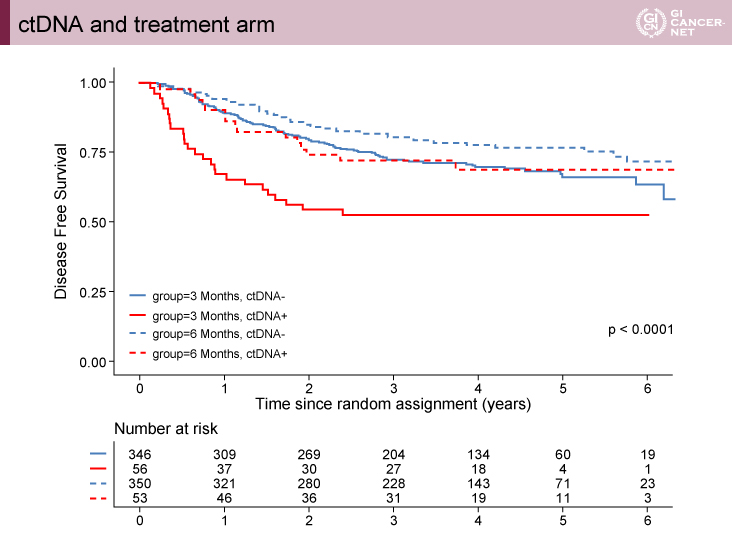
図3 High-risk stage III patients (T4, N2 or both)(発表者の許可を得て掲載)
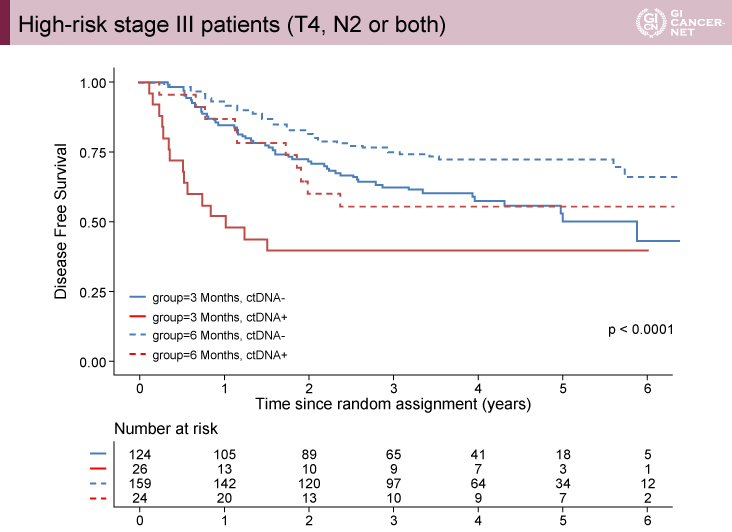
図4 Low-risk stage III patients (T1-3/N1)(発表者の許可を得て掲載)
まとめ
Stage III結腸癌の術後補助化学療法開始前にctDNA陽性割合は13.54%であり、低分化型および穿孔例で多かった。また、化学療法開始前ctDNA陽性は独立した予後予測因子であり、ctDNA陽性・陰性にかかわらずFOLFOXの6ヵ月投与群が良好な結果であった。6ヵ月投与群と3ヵ月投与群の比較では、再発高リスク(T4またはN2)患者においてctDNA陽性群での差が著明であり、6ヵ月の術後補助化学療法が推奨される。再発低リスク群(T1-3かつN1)ではctDNA陽性群と陰性群の差は有意ではなかった(p=0.07)。
(レポート:国立がん研究センター東病院 消化管内科 三島 沙織)
References
- 1) Tie J, et al.: Sci Transl Med. 8(346): 346ra92, 2016 [PubMed]
- 2) Reinert T, et al.: JAMA Oncol. May 9, 2019 [Epub ahead of print]
- 3) André T, et al.: J Clin Oncol. 36(15): 1469-1477, 2018 [PubMed]
関連サイト
- ・IDEA FRANCE試験 [ClinicalTrials.gov][Journal of Clinical Oncology]
- ・IDEA collaboration [PubMed][学会レポート(2017 ASCO #LBA1)][学会レポート(ESMO 2017 #LBA21)][学会レポート(ASCO 2019 #3501)][論文紹介]

谷口 浩也 先生
国立がん研究センター東病院 消化管内科 医長