BRAF V600E変異を有する切除不能・進行再発大腸癌に対するEncorafenib+Binimetinib+Cetuximab(Cmab)の3剤併用療法群、Encorafenib+Cmabの2剤併用療法群と、Irinotecan(IRI)またはFOLFIRI+Cmab療法を比較した第III相無作為化試験の中間解析結果(BEACON CRC試験)
Encorafenib plus Cetuximab With or Without Binimetinib for BRAF V600E-Mutant Metastatic Colorectal Cancer: Expand Results from a Randomized, 3-Arm, Phase 3 Study vs. the Choice of Either Irinotecan or FOLFIRI plus Cetuximab (BEACON CRC)
Josep Tabernero, et al.
監修コメント
本試験は、BRAF V600E変異大腸癌に対する新しい標準治療を確立した大変貴重な試験となった。本試験がWCGC 2019で初めて発表された際に、2剤併用療法でも十分な効果が期待できるのではないかという点が議論されていた。本試験の主要評価項目は、3剤vs. 標準治療の、全生存(OS)期間ならびに全奏効割合(ORR)であり、3剤vs. 2剤を比較する統計学的パワーはない。しかしながら、この2群のKM曲線は開きがなく似ていたため、2剤併用療法の有用性について検討することが望まれていた。今回の発表では、本試験の結果が改めて示されるとともに、この3剤vs. 2剤にフォーカスした試験結果が報告された。
二次治療におけるORRは3剤併用療法群のほうが2剤併用療法群よりも高いこと(34% vs. 22%)、毒性は下痢と貧血が3剤併用療法群でやや高いものの、逆に抗EGFR抗体薬関連の皮膚毒性が低く、QOL評価では2剤併用療法群と差がないことから、BRAF V600E変異大腸癌に対する治療は3剤併用療法が良いということになろう。
本邦では日常臨床ですでにBRAF V600E変異の検査が可能である。予後が悪いとされるこの集団を把握できる状況にあり、予後を延ばすための治療が望まれている。本邦の大腸癌治療ガイドラインではBRAF V600E変異を有する大腸癌に対する一次治療のpreferred regimenは、FOLFOXIRI療法[Fluorouracil(5-FU)+Leucovorin(LV)+Irinotecan(IRI)+Oxaliplatin(OX)]+Bevacizumab(Bmab)であるが、本試験の結果に基づき、二次治療で3剤併用療法が保険償還され、目の前の患者さんに使用することができる日が早く来ることを期待したい。
(コメント・監修:聖マリアンナ医科大学 臨床腫瘍学 准教授 砂川 優)
BRAF V600E変異を有する切除不能・進行再発大腸癌に対するBRAF阻害薬+MEK阻害薬+抗EGFR抗体薬の3剤併用療法群の第III相試験において、2剤併用療法群との比較に焦点を当てさらに検証
BRAF V600E変異を有する大腸癌は10~15%の頻度で認められ、予後不良な集団である1-3)。BRAF変異陽性の大腸癌では、上皮成長因子受容体(EGFR)のポジティブフィードバックを受けて活性化されるためBRAF阻害薬単剤では効果を認めず、腫瘍増殖へ導く4,5)。このフィードバック機構についてはMAPK(mitogen-activated protein kinase)経路の複数の分子を同時に抑えることで解除できると考えられた。
BEACON CRC試験の安全性導入期試験では、BRAF V600E変異を有する大腸癌においてEncorafenib+Binimetinib+Cetuximab(Cmab)の3剤併用療法群、Encorafenib+Cmabの2剤併用療法群を、FOLFIRI[Fluorouracil(5-FU)+Leucovorin(LV)+Irinotecan(IRI)]+Cmab療法またはIRI+Cmab療法のコントロール群とそれぞれ比較し、生存期間の延長と安全性を示した6)。この結果はWCGC 2019で発表された。
ESMO 2019では、2剤併用療法群と3剤併用療法群の治療効果と有害事象のプロファイルの比較を中心とした中間解析が報告された。
主要評価項目は3剤併用療法群とコントロール群の全生存(OS)期間と全奏効割合(ORR)で、3剤併用療法群と2剤併用療法群の有効性、安全性、QOLについても比較
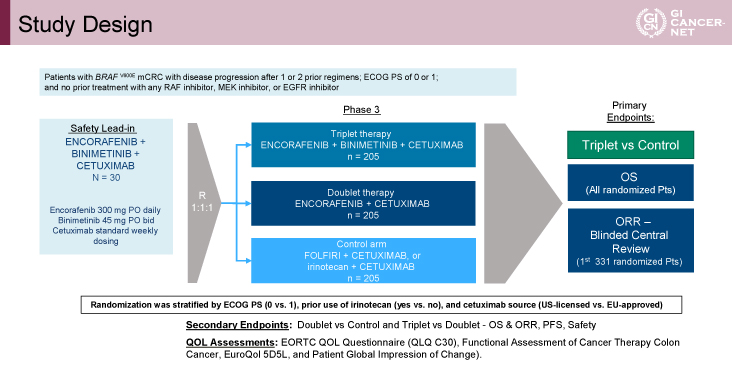
本試験は、BRAF V600E変異を有する切除不能・進行再発大腸癌において、一次治療もしくは二次治療後に腫瘍進行を認めたPS(performance status)0もしくは1、RAF/MEK/EGFR阻害薬の使用歴のない患者を対象とした無作為化第III相試験である。
対象患者665例は、Encorafenib+Binimetinib+Cmabの3剤併用療法群、Encorafenib+Cmabの2剤併用療法群、FOLFIRI+Cmab療法またはIRI+Cmab療法のコントロール群の3群に、1:1:1で無作為に割り付けられた(図1)。
主要評価項目は3剤併用療法群とコントロール群を比較した際の全生存(OS)期間、最初に無作為化された331例における全奏効割合(ORR)であった。副次評価項目は2剤併用療法群とコントロール群、3剤併用療法群と2剤併用療法群のOS期間、無増悪生存(PFS)期間、ORR、安全性、QOLであった。QOLの評価は、EORTC QOL Questionnaire(QLQ-C30)とFunctional Assessment of Cancer Therapy Colon Cancer(FACT-C)等で行われた。
主な統計学的手法としては、3剤併用療法群とコントロール群、2剤併用療法群とコントロール群のOS期間はそれぞれハザード比(HR)=0.67、HR=0.70、両側α=0.05、検出力90%、ORRは10~30%の上昇、両側α=0.01、検出力88%が必要であるとされた。また、3剤併用療法群と2剤併用療法群の有効性の比較に関しては、両群の差を検討するに十分な統計学的な検出力はない、としたうえで中間解析をもとにOS期間を比較した。
図1 Study Design(発表者の許可を得て掲載)
統計学的検出力はないものの、3剤併用療法群で良好な有効性と安全性、QOLの維持が示された
全体で665例が解析対象となり、3剤併用療法群224例、2剤併用療法群220例、コントロール群221例であった。観察期間中央値は全例で7.8ヵ月、最初の無作為化された331例で12.5ヵ月であった。患者背景に関しては病変を認める臓器数≧3個、肝転移、CEA(carcinoembryonic antigen)>5ug/L、CRP(C反応性蛋白)>10mg/L、CA(carbohydrate antigen)19-9>35U/mLの割合は3群で差を認めなかった。
OS期間中央値は、3剤併用療法群vs. コントロール群で9.0ヵ月vs. 5.4ヵ月(p<0.0001)、2剤併用療法群vs. コントロール群で8.4ヵ月vs. 5.4ヵ月(p<0.0003)、最初の331例のORRは3剤併用療法群vs. コントロール群で26% vs. 2%(p<0.0001)、2剤併用療法群vs. コントロール群で20% vs. 2%(p<0.0001)であり、主要評価項目を達成した(表1)。
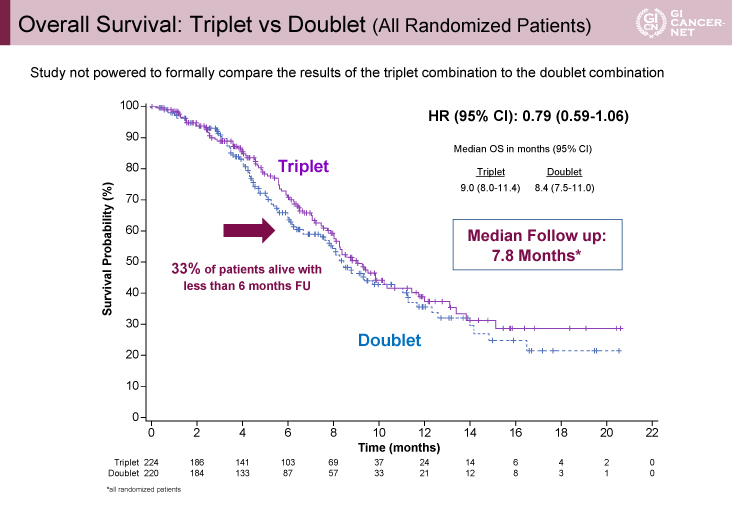
また、OS期間は全例において3剤併用療法群9.0ヵ月、2剤併用療法群8.4ヵ月(HR=0.79、95% CI: 0.59-1.06)と3剤併用療法群で良好な成績を認めながらも、33%が6ヵ月以下の観察期間であり、現時点で統計学的な検出力はないとされた(図2)。また、ORRは最初の331例において前治療が1レジメンの症例では、3剤併用療法群34%、2剤併用療法群22%であった(表1)。
表1 Objective Response Rate (first 331 randomized patients)(発表者の許可を得て掲載)
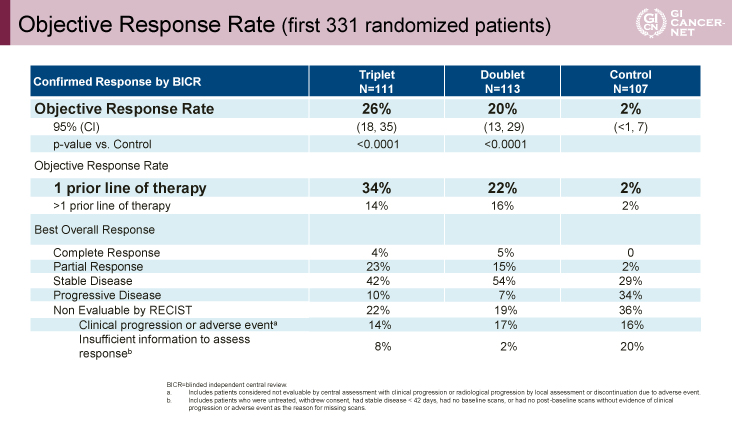
図2 Overall Survival: Triplet vs Doublet (All Randomized Patients)(発表者の許可を得て掲載)
相対用量強度(RDI)は3剤併用療法群では、Encorafenib 91%、Binimetinib 87%、Cmab 91%、2剤併用療法群では、Encorafenib 98%、Cmab 93%、コントロール群では74~85%、Grade 3以上の有害事象割合は、3剤併用療法群58%、2剤併用療法群50%、コントロール群61%であった。
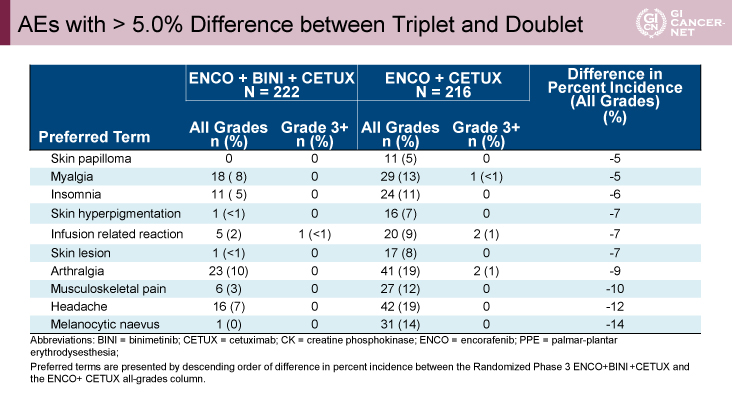
Grade 3以上の有害事象は、3剤併用療法群で下痢10%、貧血11%が高く(表2)、全Gradeの有害事象において2剤併用療法群で筋肉痛(13%)、関節痛(19%)、頭痛(19%)などの頻度がやや高かった(表3)。
QOLに関してはQLQ-C30、FACT-Cにおいて10%の低下を認めるまでの期間を評価し、両群においてそれぞれHR=1.00(95% CI: 0.79-1.27)、HR=1.05(95% CI: 0.81-1.35)と差を認めなかった。
以上から、3剤併用療法群において良好な有効性を認め、高いRDIを維持しながらも、管理可能な有害事象のプロファイルとQOLの維持を認めた。
表2 Grade ?3 Adverse Events and Laboratory Abnormalities*(発表者の許可を得て掲載)
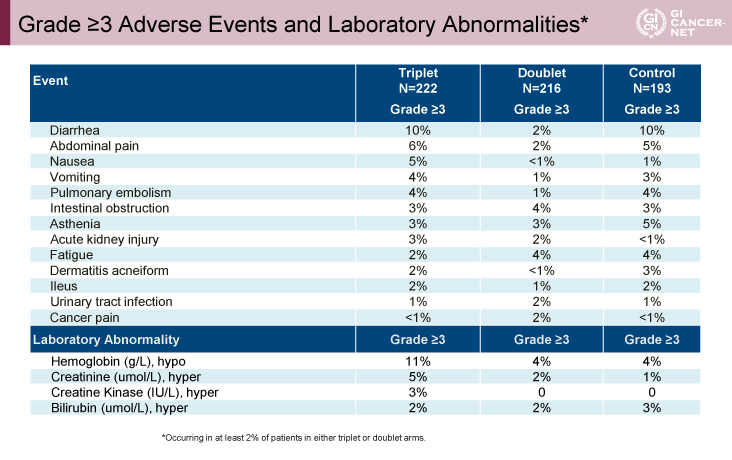
表3 AEs with > 5.0% Difference between Triplet and Doublet(発表者の許可を得て掲載)
まとめ
前治療歴のあるBRAF V600E変異を有する切除不能・進行再発大腸癌に対して、新たな標準療法としてEncorafenib+Binimetinib+Cmabの3剤併用療法とEncorafenib+Cmabの2剤併用療法の意義が示された。2剤併用療法と3剤併用療法の比較に関してはさらなる観察期間による検討が必要であるものの、今回の解析結果から2剤併用療法に対する3剤併用療法の有用性が示唆される結果となった。
(レポート:聖マリアンナ医科大学 臨床腫瘍学 梅本 久美子)
References
- 1) De Roock W, et al.: Lancet Oncol. 11(8): 753-762, 2010 [PubMed]
- 2) Sorbye H, et al.: PLoS One. 10(6): e0131046, 2015 [PubMed]
- 3) Loupakis F, et al.: Br J Cancer. 101(4): 715-721, 2009 [PubMed]
- 4) Corcoran RB, et al.: Cancer Discov. 2(3): 227-235, 2012 [PubMed]
- 5) Prahallad A, et al.: Nature. 483(7387): 100-103, 2012 [PubMed]
- 6) Van Cutsem E, et al.: J Clin Oncol. 37(17): 1460-1469, 2019 [PubMed]
関連サイト
- ・BEACON CRC試験 [ClinicalTrials.gov][論文紹介]

砂川 優 先生
聖マリアンナ医科大学 臨床腫瘍学 准教授