進行肝細胞癌に対する一次化学療法としてのNivolumab(Nivo)療法とSorafenib療法の有効性を検証:CheckMate 459試験(無作為化多施設共同第III相試験)
CheckMate 459: A Randomized, Multi-Center Phase 3 Study of Nivolumab vs Sorafenib as First-Line Treatment in Patients with Advanced Hepatocellular Carcinoma
Thomas Yau, et al.
監修コメント
CheckMate 459試験は進行肝細胞癌に対する一次化学療法として、Nivolumab(Nivo)とSorafenibをhead-to-headで比較した第III相臨床試験であり、主要評価項目として全生存(OS)期間が設定されたが、結果としてハザード比(HR)は0.85でその95%信頼区間(CI)の上限は1を超えており、統計学的に有意な延長は認められなかった。
発表後のDiscussionでは、約半数の症例で後治療が導入されたことからSorafenib群のOS期間が14.7ヵ月とこれまで実施された試験と比較して最も長かったことが本試験の失敗の要因とされていた。確かに、チロシンキナーゼ阻害薬や免疫チェックポイント阻害薬による後治療の導入率が高かったことが、OS期間を延長させた要因になり得ると考えられる。一方、後治療の影響を受けない無増悪生存(PFS)期間に着目すると、そのHRは0.93(95% CI: 0.79-1.10)とOS期間のHRよりも悪かった。これは、他癌種の免疫チェックポイント阻害薬の臨床試験でも認められる特徴であるが、後治療の実施がOS期間の差を薄めているとは限らないことを示している。
進行肝細胞癌における免疫チェックポイント阻害薬の第III相試験は、本年のASCOで発表されたPembrolizumabとともに、単独投与の有用性は示されなかった。ただし、Pembrolizumabは二次治療におけるプラセボとの比較であったのに対して、本試験は一次治療における実薬との比較であった。進行肝細胞癌の一次治療としてはLenvatinibが、Sorafenibに対する非劣性が検証された結果に基づいて、本邦を含めて承認されている。LenvatinibのSorafenibに対するOS期間のHRは0.92であり、今回のCheckMate 459のHRはそれを下回っていることは一考に値すると考えられる。
(コメント・監修:金沢大学 先進予防医学研究センター 特任准教授 寺島 健志)
進行肝細胞癌に対する一次化学療法の新たな治療戦略が期待されている
進行肝細胞癌に対する全身化学療法においては、SHARP試験1)およびAsia-Pacific試験2)の結果、Sorafenib療法が一次化学療法として広く実施されてきた。これらの試験以降、Sorafenib療法をコントロール群として複数の第III相試験が実施されてきた。しかし、REFLECT試験3)においてLenvatinib療法のSorafenib療法に対する非劣性が報告された以外は、Sorafenib療法に勝る新たな治療は生まれてこなかった。以上の経過から、現在は進行肝細胞癌に対する一次化学療法として、Sorafenib療法あるいはLenvatinib療法が標準治療として行われている。
一方、新たな治療戦略として免疫チェックポイント阻害薬がさまざまな癌種において成功を収め、進行肝細胞癌においても、第I/II相試験(CheckMate 040試験4))でのNivolumab(Nivo)の持続的な有効性と忍容性の結果が報告され、Nivoの進行肝細胞癌における治療開発が期待されていた。
全生存(OS)期間を主要評価項目とし、Nivo療法のSorafenib療法に対する優越性を検証
本CheckMate 459試験は、進行肝細胞癌に対し、Nivo療法のSorafenib療法に対する優越性を検証した第III相試験の報告である。
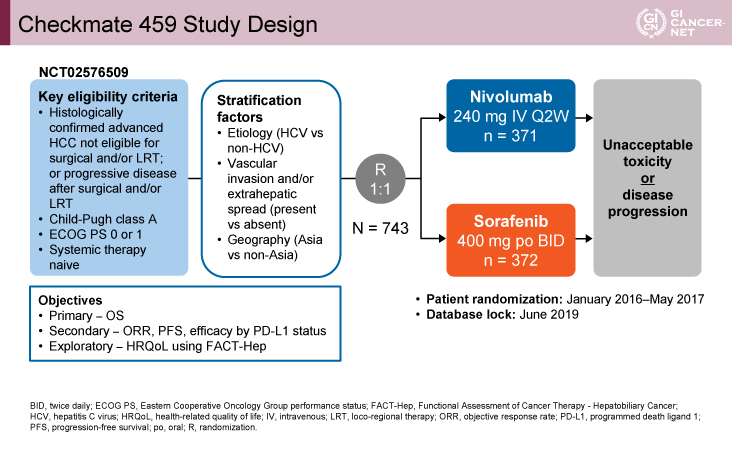
主な適格基準は、外科切除あるいは局所療法の適応とならない病理組織学的に診断された進行肝細胞癌、Child-Pugh分類A、ECOG PS(Eastern Cooperative Oncology Group performance status)0/1、全身化学療法未施行例であった。
登録患者を、病因[C型肝炎ウイルス(HCV)vs. non-HCV]、脈管侵襲または肝外病変の有無、地域(アジア圏vs. 非アジア圏)で層別化し、Nivo群(240mg/bodyを2週毎)とSorafenib群(400mg/1日2回)に1:1に割り付けた(図1)。
主要評価項目として全生存(OS)期間、副次評価項目として全奏効割合(ORR)、無増悪生存(PFS)期間、PD-L1 status別の有効性、探索的評価項目として健康関連QOLが設定された。
図1 CheckMate 459 Study Design(発表者の許可を得て掲載)
Nivo療法は、Sorafenib療法に対する統計学的な優越性を示さなかったが、OS期間の改善傾向を認めた
本研究は本邦を含めた22ヵ国で実施され、2016年1月から2017年5月までの間に743例が登録され、Nivo群に371例、Sorafenib群に372例が割り付けられた。患者背景に関しては両群間で差は認められなかった。
主要評価項目のOS期間に関しては、ハザード比(HR)=0.85(95% CI: 0.72-1.02、p=0.0752)であり、統計学的な優越性は示されなかったものの、Nivo群vs. Sorafenib群(以下、同順)のOS期間中央値は16.4ヵ月vs. 14.7ヵ月、1年OS割合は60% vs. 55%、2年OS割合は37% vs. 33%であり、Nivo群で良好な傾向を認めた(図2)。BCLC(Barcelona Clinic Liver Cancer)stage Bと脈管侵襲および肝外病変のない2つのサブグループではSorafenib群で良好な傾向を認めたが、その他のサブグループのいずれにおいてもNivo群で良好な傾向を示した。
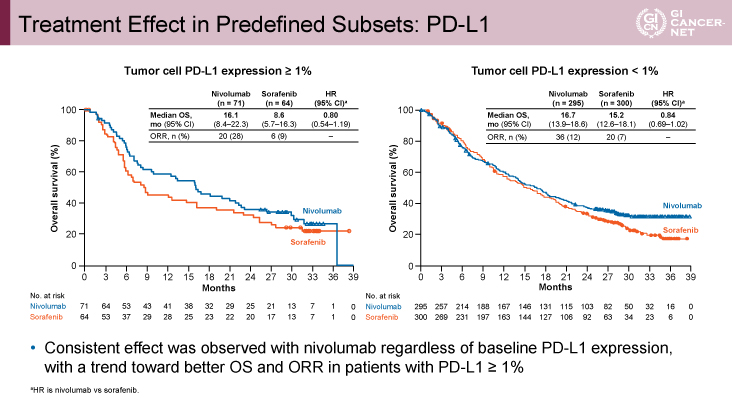
副次評価項目であるPFS期間は、HR=0.93(95% CI: 0.79-1.10、p=0.93)、期間中央値は3.7ヵ月vs. 3.8ヵ月、ORRは15% vs. 7%であり、病勢コントロール割合(DCR)は55% vs. 58%であった。PD-L1 status別の解析においては、PD-L1 statusにかかわらずNivo群でOS期間延長の傾向があったが、特に腫瘍細胞におけるPD-L1発現≧1%の症例においてその差は顕著であった(図3)。後治療移行率はNivo群で38%、Sorafenib群で46%であり、特にSorafenib群の20%の症例において、後治療として免疫チェックポイント阻害薬が投与されていた。
一方、有害事象に関してはGrade 3以上の有害事象がNivo群の22%、Sorafenib群の49%に認められ、安全性プロファイルはNivo群が全体的に良好な傾向であった。Nivo群の有害事象に関しては既報と同様であり、今回の試験で新たな問題点は報告されなかった。
今回の試験では探索的評価項目としてFACT-Hepを用いた健康関連QOL(HRQOL)を調査したが、全期間にわたってNivo群で良好な結果であった。
図2 Overall Survival(発表者の許可を得て掲載)
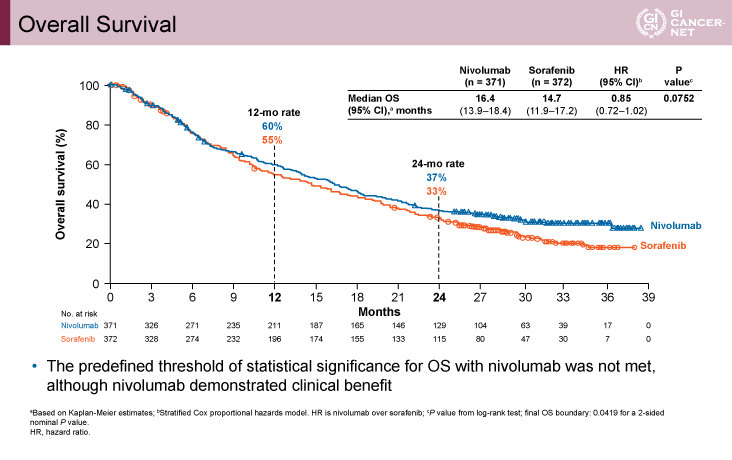
図3 Treatment Effect in Predefined Subsets: PD-L1(発表者の許可を得て掲載)
まとめ
進行肝細胞癌に対する一次化学療法において、Nivo療法はSorafenib療法に対し、統計学的な有意差をもってOS期間における優越性を示せなかったものの、OS期間、PFS期間、ORR、完全奏効(CR)割合、安全性、健康関連QOLのいずれにおいても良好な傾向を示した。その有効性はPD-L1 statusによらず、腫瘍細胞におけるPD-L1発現≧1%の症例においてより顕著な傾向であった。
(レポート:慶應義塾大学病院 腫瘍センター 林 秀幸)
References
- 1) Llovet JM, et al.: N Engl J Med. 359(4): 378-390, 2008 [PubMed]
- 2) Cheng AL, et al.: Lancet Oncol. 10(1): 25-34, 2009 [PubMed]
- 3) Kudo M, et al.: Lancet. 391(10126): 1163-1173, 2018 [PubMed]
- 4) El-Khoueiry AB, et al.: Lancet. 389(10088): 2492-2502, 2017 [PubMed]
関連サイト
- ・CheckMate 459試験 [ClinicalTrials.gov][Journal of Clinical Oncology]
- ・SHARP試験 [ClinicalTrials.gov]
- ・Asia-Pacific試験 [ClinicalTrials.gov]
- ・REFLECT試験 [ClinicalTrials.gov]
- ・CheckMate 040試験 [ClinicalTrials.gov]

寺島 健志 先生
金沢大学 先進予防医学研究センター 特任准教授