切除可能進行胃癌に対する、手術+術後S-1療法vs. Docetaxel(DTX)+Oxaliplatin(OX)+S-1併用の術前補助化学療法(DOS療法)+手術+術後S-1療法:PRODIGY試験(第III相試験)
A Phase III open label randomized study of neoadjuvant chemotherapy with docetaxel, oxaliplatin and S-1 (DOS) followed by surgery and adjuvant S-1, vs surgery and adjuvant S-1 for resectable advanced gastric cancer (PRODIGY Study)
Yoon-Koo Kang, et al.
監修コメント
この10年の切除可能癌に対する化学療法の戦略変化として、術後から、術前あるいは術前術後への変化というものがある。
術後化学療法の利点は、病理病期により術後化学療法を行うべき予後不良患者を見極めることができ、患者に対する過剰な侵襲が避けられることであるが、まずR0手術が可能であるということが大前提となる。一方、術前化学療法は、効果があればダウンステージが期待でき、より切除可能な患者の範囲が増える一方で、化学療法の効果がない場合には、根治術である手術を受ける機会を逸してしまうというリスクがある。
一般的に、乳癌など化学療法に対する奏効割合(RR)が5割を超える癌種において、術前化学療法が導入されてきた。術前に癌が縮小することで、切除範囲を狭めることができるなどのメリットも付加されている。一方、食道癌など術後の状態の影響であまり化学療法が十分に投与できない癌種でも、術前化学療法の優位性が報告され、標準治療となっている。胃癌は、標準的化学療法であるFluorouracil(5-FU)+プラチナ系薬剤併用療法のRRが30~50%、術後の状態も比較的保たれている。そして、術前のリンパ節転移診断が難しく、一部の患者には過剰診療になってしまう可能性があることなどから、術前化学療法については検討されるものの、アジアでは標準治療にはまだなっておらず、いわゆる切除可能境界型とされるBulky N(長径3cm以上のリンパ節転移)症例などに限られていた。
欧米では、FLOT4試験1)の結果、胃癌および食道胃接合部腺癌において術前術後に3剤併用療法を行うことが標準となり、化学療法の有効性の向上に伴い、最近の傾向として術前化学療法へシフトしているといえる。
PRODIGY試験は、術前治療を従来の2剤併用から、タキサン系薬剤のDocetaxel(DTX)を併用したDOSレジメンに変えることで、さらなる腫瘍縮小効果を期待し、ダウンステージングと切除可能症例を増やし、最終的には全生存(OS)期間を延長することを期待した試験である。臨床試験としては、代替エンドポイントである無増悪生存(PFS)期間が用いられ、結果的にハザード比(HR)=0.70前後で、術後S-1療法を行ったのみの患者群よりも、術前DOS療法を追加した患者群のほうが良好な結果を示している。発表者らはこの切除可能進行胃癌患者に対して、術前DOS療法を考慮すべきと結論している。
さて、日本にてこの試験をそのまま外挿できるのか? まず試験の内容であるが、DTX 50mg/m2を3週間毎に併用したDOS療法はdose intensity(用量強度:DI)も保たれており、有害事象は許容範囲、ほとんどの症例でD2郭清が行われた胃切除術のR0切除割合は想定の範囲、術後化学療法も両群で80%以上のDIであった。つまり、臨床試験の質としては申し分ないのであるが、主要評価項目であるPFS期間の曲線は、標準治療群では最初の段階で15%ほど落ちて、その後はDOS療法群とほぼ同じ傾きで低下していっている。R0切除の差がそのままPFS期間の差になった印象であるが、逆にR0切除可能な症例にとってはやや過剰な治療になるともとれる。
日本において、JCOG1509試験、JCOG1704試験の2つの胃癌における術前化学療法を検討する前向き試験が実施中である。前者はcT3-4N+M0(肉眼型大型3型および4型を除く)を対象に術前S-1+Oxaliplatin(OX)療法の優越性を無治療群と比較する第III相試験、後者はBulky Nがあるものを対象にしたDOS療法を評価する第II相試験である。より細かく対象を分けてリスク・ベネフィットのバランスを最大に高めるのが日本のやり方であるが、どの対象にどこまでの術前治療を行うべきか、この2つの試験の結果と、PRODIGY試験の結果を詳細に比べる必要がある。
(コメント・監修:国立がん研究センター中央病院 消化管内科 医長 加藤 健)
切除可能な局所進行胃癌の周術期治療の開発
切除可能な局所進行胃癌は手術と周術期治療の開発により予後の延長が得られているが、未だ改善の余地は残っている。
アジアではACTS-GC試験やCLASSIC試験の結果2,3)から、切除可能な局所進行胃癌の標準治療はD2リンパ節郭清を伴う胃切除術と術後補助化学療法である。一方ヨーロッパにおいてはMAGIC試験の結果4)から標準治療として確立している術前化学療法が、アジアにおいても同対象の予後を改善する可能性がある。
韓国で行われた切除可能な局所進行胃癌に対する、術前Docetaxel(DTX)+Oxaliplatin(OX)+S-1併用療法(DOS療法)の第II相試験では有望な結果5)を認めたことから、本試験(PRODIGY試験)は、術前DOS療法+手術+術後S-1療法が、標準治療である手術+術後S-1療法と比較して予後を改善するか検証するために行われた。
主要評価項目は3年無増悪生存(PFS)期間(FAS解析)
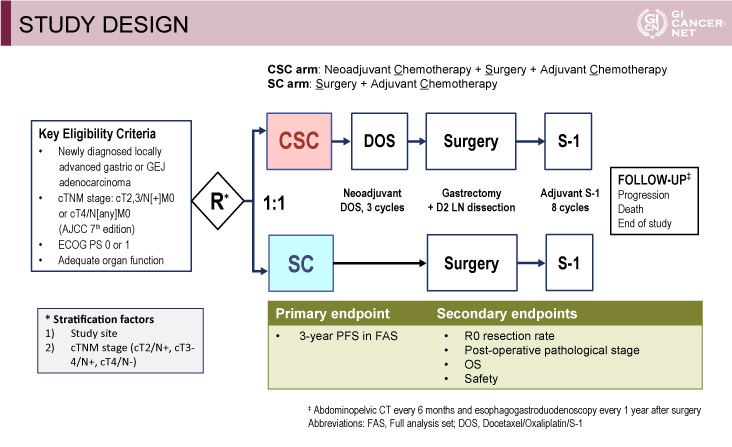
本試験のデザインは、cT2-3N+M0またはcT4NanyM0に対する術前DOS療法+手術+術後S-1療法(以下、CSC群)の、手術+術後S-1療法(以下、SC群)に対する優越性を検証する第III相無作為化比較試験である。
本試験の主な適格基準は、未治療の局所進行胃癌もしくは食道胃接合部癌で、cT2-3N+M0またはcT4NanyM0(UICC 7th)、ECOG PS(Eastern Cooperative Oncology Group performance status)0-1、適切な臓器機能を有することであった。
治療スケジュールは、CSC群では術前DOS療法を3コース施行し、D2郭清を伴う胃切除術後に術後S-1療法を8コース施行した。またSC群ではD2郭清を伴う胃切除術後に術後S-1療法を8コース施行した(図1)。
主要評価項目はFASでの3年無増悪生存(PFS)期間であり、CSC群70%、SC群60%[ハザード比(HR)=0.698]、有意水準5%、検出力80%と仮定し、全体症例数を530例と設定した。副次評価項目は、R0切除割合、術後病理学的stage、全生存(OS)期間、安全性であった。
図1 STUDY DESIGN(発表者の許可を得て掲載)
術前DOS療法はCSC群の89.9%で3コースを完遂、腫瘍増大症例は2.1%のみ
症例登録は2012年1月から2017年1月まで行われ、CSC群266例、SC群264例の計530例が登録され、最終的な解析対象(FAS)は484例であった。また135例のイベントが確認された2016年5月に中間解析を行うも試験続行となり、最終解析は2019年1月に有意水準4.9%、検出力67%で行われた。
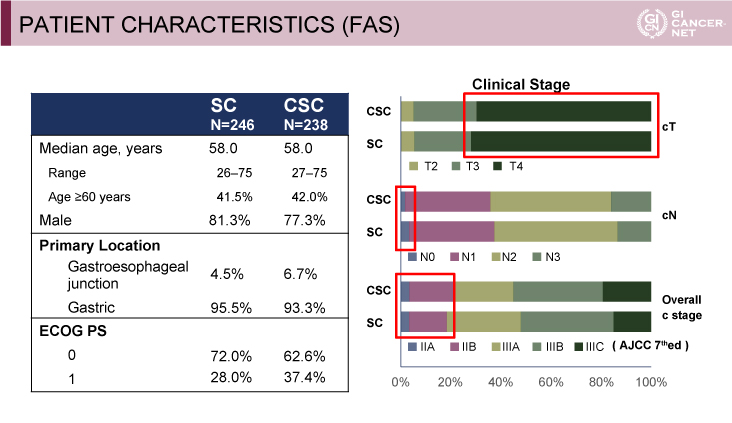
患者背景はCSC群(238例)、SC群(246例)それぞれで、年齢中央値(範囲)58.0歳(27-75歳)vs. 58.0歳(26-75歳)、食道胃接合部原発は6.7% vs. 4.5%、胃原発は93.3% vs. 95.5%、ECOG PS 0は62.6% vs. 72.0%、ECOG PS 1は37.4% vs. 28.0%であった(図2)。
図2 PATIENT CHARACTERISTICS (FAS)(発表者の許可を得て掲載)
術前DOS療法はCSC群の89.9%で3コース完遂されており、治療中に腫瘍増大を認めた症例は2.1%にとどまった。
CSC群におけるGrade 3以上の治療関連有害事象として、好中球減少12.6%、発熱性好中球減少9.2%、下痢5.0%を認め、術前治療中の治療関連死は0.8%であった。
手術におけるR0切除割合は、CSC群(238例)96.4% vs. SC群(246例)85.8%(p<0.0001)であり、そのうちD2リンパ節郭清割合はCSC群、SC群ともに98.1%であった。手術に関連したGrade 3以上の有害事象はCSC群6.3%、SC群8.5%に認められ、CSC群において1例(0.45%)の肺塞栓症による死亡を認めた。なお、CSC群では病理学的完全奏効(CR)が10.4%(p<0.0001)で認められた。
術後S-1療法の8コース治療完遂割合は、CSC群(204例)83.3%、SC群(187例)84.0%であり、Grade 3以上の治療関連有害事象は既知の血液毒性や消化器毒性を認めたのみであった。
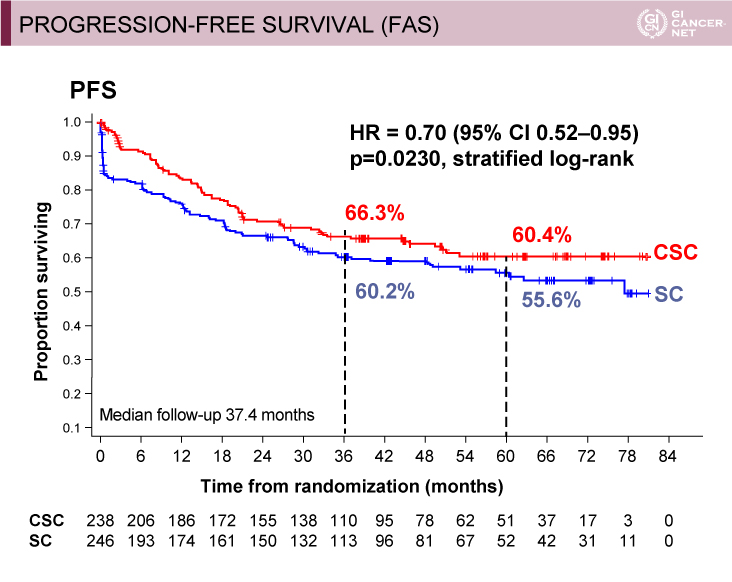
3年PFS(FAS解析)は、CSC群66.3% vs. SC群60.2%(HR=0.70、95% CI: 0.52-0.95、p=0.0230)であった(図3)。ITT解析では、CSC群66.2% vs. SC群60.0%(HR=0.69、95% CI: 0.51-0.93、p=0.0156)、6ヵ月のランドマーク解析ではCSC群66.1% vs. SC群59.9%(HR=0.71、95%CI: 0.54-1.00、p=0.0434)と一貫した結果であった。
主要評価項目であるPFS期間のサブ解析においては、CSC群においてほぼすべての項目で良好な傾向を認めた。
OS期間に関する解析は、HR=0.84(95% CI: 0.60-1.19)、p=0.3383であり、CSC群で29.3%、SC群で27.3%でしかイベントが生じておらず、検出力は17%にとどまっていた。
図3 PROGRESSION-FREE SURVIVAL (FAS)(発表者の許可を得て掲載)
まとめ
本試験では、CSC群において、SC群よりも高いR0切除割合およびダウンステージング割合、PFS期間の有意な延長を認め、忍容性も保たれていた。
そのため、切除可能な局所進行胃癌または食道胃接合部癌に対しては、術前DOS療法+手術+術後S-1療法を治療選択肢として考慮すべきである。
(レポート:国立がん研究センター中央病院 消化管内科 山本 駿)
References
- 1) Al-Batran SE, et al.: Lancet. 393(10184): 1948-1957, 2019 [PubMed]
- 2) Sakuramoto S, et al.: N Engl J Med. 357(18): 1810-1820, 2007 [PubMed]
- 3) Bang YJ, et al.: Lancet. 379(9813): 315-321, 2012 [PubMed]
- 4) Cunningham D, et al.: N Engl J Med. 355(1): 11-20, 2006 [PubMed]
- 5) Park I, et al.: Cancer Chemother Pharmacol. 72(4): 815-823, 2013 [PubMed]
関連サイト
- ・FLOT4試験 [ClinicalTrials.gov][学会レポート(ASCO 2017 #4004)]
- ・PRODIGY試験 [ClinicalTrials.gov]
- ・JCOG1509試験(NAGISA trial) [UMIN-CTR]
- ・JCOG1704試験 [JCOG][jRCT臨床研究実施計画・研究概要公開システム]
- ・ACTS-GC試験 [ClinicalTrials.gov]
- ・CLASSIC試験 [ClinicalTrials.gov]
- ・MAGIC試験 [ISRCTN][論文紹介]

加藤 健 先生
国立がん研究センター中央病院 消化管内科 医長