術前化学放射線療法後、切除を受けた食道および食道胃接合部癌に対する術後補助化学療法としてのNivolumabの多施設共同無作為化二重盲検第III相試験(CheckMate 577)の初回解析結果
Adjuvant Nivolumab in Resected Esophageal or Gastroesophageal Junction Cancer (EC/GEJC) Following Neoadjuvant Chemoradiation Therapy (CRT): First Results of the CheckMate 577 Study
Ronan J. Kelly, et al.
監修コメント
食道癌は、早期に診断され手術などの局所療法を行っても再発率が高く、難治癌である。そのため、集学的治療として、化学療法あるいは化学放射線療法を組み合わせて治療が行われる。日本では、JCOG9907試験の結果、術前化学療法(5-FU+CDPP)が標準とされ、欧米ではCROSS試験や、CALGB-9781試験の結果により、術前化学放射線療法(trimodality therapy)が標準的である。しかし、術前治療に反応しない患者は再発率が高く、かつ、食道癌術後は全身状態の改善に時間がかかるため、強力な術後化学療法は行えないことが問題点であった。CheckMate 577試験は、そのような対象に対し、有害事象の比較的軽微な免疫チェックポイント阻害剤であるNivolumabを術後に行うことで、再発を低減できるかどうかを検証した試験である。主要評価項目は無病生存期間(DFS)であるが、胃癌の試験を集めたGASTRIC研究では、全生存期間との相関が示され、胃癌の周術期試験では代替エンドポイントとして用いられている指標である。
結果は、Nivolumab群がプラセボ群に対して有意にDFSを延長しており、その差もHR=0.69と臨床的に意義のある差と思われた。また、組織型によるサブグループ解析においても、腺癌でHR=0.75、30%しか登録されていないが、扁平上皮癌でも0.61と十分な差が示された。DFSカーブが6ヵ月程度まではほぼ重なっており、その後別れているのは、Nivolumabでも抑えきれてない早期再発症例が一定の割合で存在すると考えられた。
この試験の結果により、術前化学放射線療法を行ったのちに、pCRに至らなかった場合には、術後にNivolumabを1年間投与したほうが良いということになったが、前述したように、日本の標準治療である術前化学療法の場合に同様の結果が得られるのかは、わかっていない。現在、術前5-FU+CDDP療法に、RTの上乗せを見る試験であるJCOG1109が行われており、その結果で標準治療が術前5-FU+CDDP+RT療法になった場合には、術後Nivolumabも標準となるが、術前5-FU+CDDP+Docetaxel療法が勝った場合には、その疑問を埋めるなんらかのエビデンスが求められることになると思われる。
(コメント・監修:国立がん研究センター中央病院 頭頸部内科 科長 加藤 健)
食道癌に対する術後補助化学療法は確立していない
術前化学放射線療法後に手術を行うtrimodality治療はstage II/III切除可能食道および食道胃接合部癌に対する標準治療の一つである1-3)。しかしながら、このtrimodality治療の再発率は高く、術前化学放射線療法で完全奏効に至らなかった70~75%の症例は特に再発率が高い。そして、現時点では術後補助化学療法は確立していない1-4)。Nivolumabは既治療例の切除不能進行食道扁平上皮癌および胃癌、食道胃接合部癌において生存の延長を示している5,6)。本CheckMate 577試験は食道および食道胃接合部癌に対してtrimodality治療後に術後補助療法としてのNivolumabの有効性と安全性を検証した多施設共同無作為化二重盲検第III相試験である。
術後補助化学療法におけるプラセボに対するNivolumab療法の優越性を検証
本試験の対象は、術前化学放射線療法後にR0切除を受けたstage II/IIIの食道および食道胃接合部癌であり、主な適格条件は化学放射線療法で完全奏効に至っていないこと、PS 0-1で腺癌・扁平上皮癌ともに対象であった。層別化因子は組織型(扁平上皮癌vs.腺癌)、リンパ節転移(≧ypN1 vs. ypN0)、PD-L1発現腫瘍割合(≧1% vs. <1%)であった。794例がNivolumab群とプラセボ群に2:1で割り付けられ、Nivolumab群に532例、プラセボ群に262例が割り付けられた。治療期間は1年間で、Nivolumabは16週までは240 mgを2週毎に、16週以降は480 mgを4週毎に投与された。
本試験の主要評価項目は無病生存期間(DFS)であった。観察期間は24.4ヵ月であった。欧州から38%、米国・カナダから32%、アジアから13%、その他の地域から16%が登録された。副次評価項目の全生存期間は今後解析される予定である。
DFSにおいて、Nivolumab群はプラセボ群に対して優越性を示した
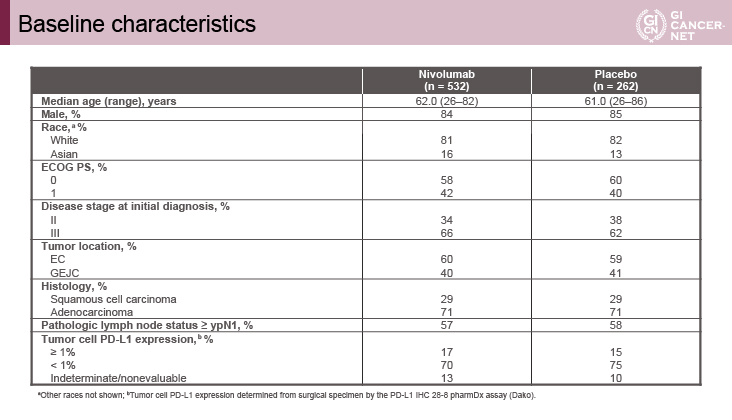
患者背景は、両群に偏りはなかった(表1)。両群ともに約60%の症例が食道癌でypN1以上であり、71%の症例が腺癌であった。PD-L1発現腫瘍割合が1%以上の症例はNivolumab群で17%、プラセボ群で15%であった。
表1 Baseline characteristics(発表者の許可を得て掲載)
治療期間の中央値はNivolumab群で10.1ヵ月、プラセボ群で9.0ヵ月であった。Nivolumab群の89%の症例はNivolumabの相対用量強度が90%以上であった。Nivolumab群の治療中止理由は治療完遂が最多(43%)でプラセボ群の治療中止理由は病勢進行が最多(43%)であった。
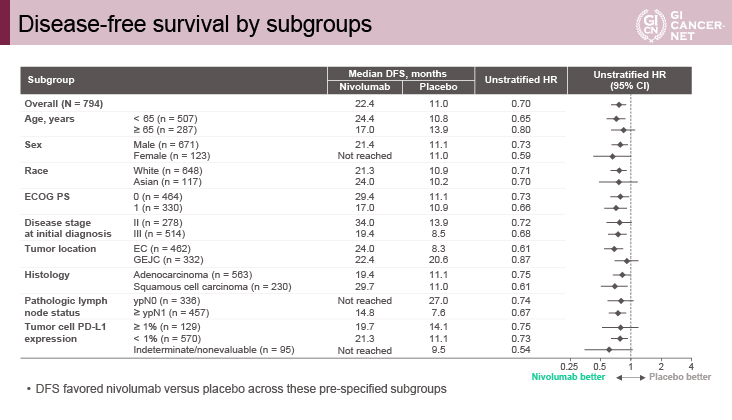
主要評価項目であるDFSの中央値はNivolumab群22.4ヵ月、プラセボ群11.0ヵ月であり、Nivolumab群で有意に良好であった[HR=0.69(96.4% CI: 0.56-0.86)、p=0.0003](図1)。プラセボ群はR0切除ができているとはいえ、化学放射線療法で完全奏効を得られていない症例であり、再発率が高く、早期再発も多いことからDFSの生存曲線は早期に分かれていた。DFSのサブグループ解析では、Nivolumab群が組織型、リンパ節転移、PD-L1発現腫瘍割合等にかかわらず、一貫して良好な結果であった(表2)。
図1 Disease-free survival(発表者の許可を得て掲載)
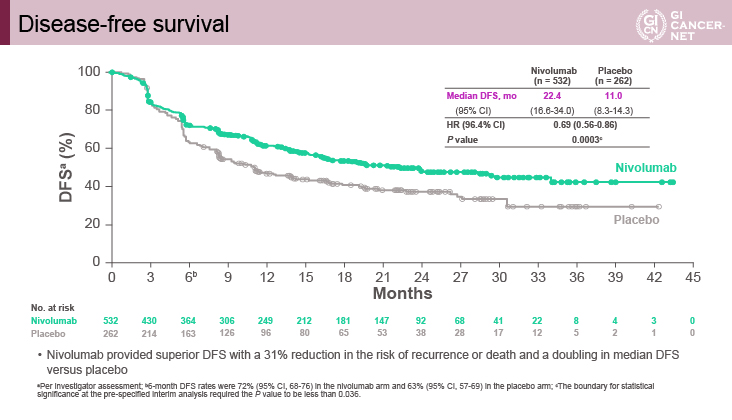
表2 Disease-free survival by subgroups(発表者の許可を得て掲載)
主な有害事象とQOL
治療関連の有害事象は両群ともに低gradeのものが多かった。重篤な治療関連の有害事象はNivolumab群で8%の症例に、プラセボ群で3%に発現し、治療中止に繋がる有害事象はそれぞれ9%/3%に発現した。頻度の高い治療関連有害事象は疲労、下痢、そう痒症、皮疹であった。
免疫関連有害事象は大部分が低gradeのものであり、Nivolumab群でgrade 3-4の免疫関連有害事象の頻度はいずれも1%以下、Nivolumab群では肺臓炎、皮疹をそれぞれ0.8%で認めた。Grade 5の免疫関連有害事象は認めなかった。
EQ-5D-3Lを用いたQOLの評価ではNivolumab群、プラセボ群ともに同程度のQOLを認めていた。
まとめ
術前化学放射線療法後、切除を受けた食道および食道胃接合部癌に対する術後補助化学療法としてのNivolumabはプラセボと比較して、DFSの統計学的に有意で臨床的に意味のある改善を示した。Nivolumabは忍容性があり、安全性も許容できるものであった。以上の結果より術前化学放射線療法後、切除を受けた食道および食道胃接合部癌に対するNivolumabによる術後補助化学療法は新たな標準治療となりうる。
(レポート:静岡県立静岡がんセンター 消化器内科 伏木 邦博)
References
- 1) NCCN Esophageal and Esophagogastric Junction Cancers Guidelines Version 4.2020
- 2) Lordick F, et al.: Ann Oncol. 27(suppl 5): v50-v57, 2016 [PubMed]
- 3) Shah MA, et al.: J Clin Oncol. 38(23): 2677-2694, 2020 [PubMed]
- 4) Murphy MB, et al.: Cancer. 123(21): 4106-4113, 2017 [PubMed]
- 5) Kang YK, et al.: Lancet. 390(10111): 2461-2471, 2017 [PubMed]
- 6) Kato K, et al.: Lancet Oncol. 20(11): 1506-1517, 2019 [PubMed]
関連サイト
- ・CheckMate 577試験 [ClinicalTrials.gov]
- ・JCOG9907試験 [学会レポート]
- ・CALGB-9781試験 [ClinicalTrials.gov]
- ・GASTRIC研究 [ホームページ]
- ・JCOG1109試験 [UMIN-CTR]

加藤 健 先生
国立がん研究センター中央病院 頭頸部内科 科長