既治療の進行胃癌および食道胃接合部癌に対するNivolumab単剤療法第3相試験(ATTRACTION-02); 最新結果とPD-L1発現の有無による解析
A phase III study of Nivolumab in previously treated advanced gastric or gastroesophageal junction cancer: Updated results and subset analysis by PD-L1 expression (ATTRACTION-02)
Narikazu Boku, et al.
監修コメント
Nivolumabは胃癌・食道胃接合部癌においてOS延長効果を証明した初めての免疫チェックポイント阻害剤であり、今回の長期追跡においてもその有効性が担保された。これらの結果を受け、2017年9月8日に開催された厚生労働省の薬事・食品衛生審議会医薬品第二部会において本薬剤の胃癌・食道胃接合部癌への適応拡大が了承され、臨床導入も間近に迫り、本薬剤の承認を心待ちにしていた患者さんには大変な福音となるだろう。消化器癌領域で臨床導入される初めての免疫チェックポイント阻害剤であり、我々医療者は先行している他癌種の同系薬におけるデータ、有害事象マネジメントを習熟し、本薬剤を実地臨床で安全に使用できるようにしなければならない。
また、他薬剤と同様に本薬剤の投与を受ける全ての患者さんが恩恵を受けられるとは言い難く、今後は効果を予測するバイオマーカーの開発が必要である。本試験においても、バイオマーカーとして腫瘍細胞におけるPD-L1発現の有無が検討されたが、評価可能症例が全登録例の40%未満と十分では無かったものの、残念ながら腫瘍細胞におけるPD-L1発現はバイオマーカーにはなり得なかったという結果であった。一方、同じ抗PD-1抗体薬であるPembrolizumabの胃癌・食道胃接合部癌に対する有効性、安全性を検討したKEYNOTE-059試験では、比較試験ではなかったもののPD-L1発現の有無で効果に差が出る可能性が示唆された。両試験におけるPD-L1発現の判定に用いた抗体や判定方法が異なることが結果の違いに影響を与えた可能性も考えられる。いずれにせよ、本薬剤は胃癌・食道胃接合部癌におけるkey drugになることは間違いなく、臨床導入以降も本薬剤の恩恵が受けられる患者さんを適切に選定できるようなバイオマーカーの検討が必要である。
(コメント・監修:静岡県立静岡がんセンター 消化器内科 医長 山﨑 健太郎)
PD-L1発現の有無は胃癌におけるバイオマーカーとなり得るか?
PD-1に選択的に結合するヒト化モノクローナル抗体であるNivolumab単剤療法は、標準治療不応・不耐の進行胃癌・接合部癌に対して有効な治療法であり、かつ管理可能な毒性であることが本年の消化器癌シンポジウムにて主要解析の結果として報告された(OS中央値:Nivolumab群5.3ヵ月, プラセボ群4.1ヵ月, HR=0.63, 追跡期間期間中央値8.9ヵ月)。
一方で、NivolumabをはじめとするPD-1/PD-L1抗体療法のバイオマーカーの1つとされるPD-L1の発現は、未だ一定した結果が得られておらず、さらなる評価が必要とされており、胃癌においてもPD-L1発現により有効性に差が生じるかどうかは検討課題であった。
既治療(2レジメン以上)の進行胃癌・食道胃接合部癌に対するNivolumab単剤とプラセボを比較する第III相試験
対象は、ATTRACTION-02試験に登録された2レジメン以上の標準治療に不応・不耐の進行胃癌・食道胃接合部癌患者493例(Nivolumab群: 3mg/kg, 2週毎, 330例、プラゼボ群: 163例)であった。層別因子として、国(日本 vs. 韓国 vs. 台湾)、ECOG PS(0 vs. 1)、転移臓器個数(2未満 vs. 2以上)が用いられ、Nivolumab群とプラセボ群に2:1で割り付けられた。
主要評価項目はOS、副次評価項目はPFS、奏効割合、TTR(time to tumor response)、DOR(duration of response)などであった。OS中央値をプラセボ群4ヵ月に対してNivolumab群6.15ヵ月(HR=0.65)と期待し、片側α=0.025、検出力90%で実施された。
PD-L1は、後ろ向きに免疫組織学的検査(DAKO 28-8 pharmDX assay)を用いて腫瘍細胞における発現が評価された。また、最後の症例が登録された日より1年超の追跡をもって有効性と安全性の最新の解析が実施された。
NivolumabはPD-L1の発現の有無によらず有効であった。
今回報告された長期追跡においてもNivolumab 群は有意にプラセボ群と比較してOSの延長が示された(図1)。追跡期間中央値 15.7ヵ月におけるOS中央値はNivolumab群5.3ヵ月、プラセボ群4.1ヵ月であった(HR=0.62, 95% CI: 0.50-0.76, p<0.0001)。また、12ヵ月生存割合は、Nivolumab群27%、プラセボ群12%、24ヵ月生存割合は、Nivolumab群12%、プラセボ群5%であった。
奏効割合は、Nivolumab群12%、プラセボ群0%であった。また、Nivolumab群の奏効期間中央値は9.8ヵ月(95% CI: 6.4-20.5)であり、Nivolumab群では40%の症例において腫瘍縮小が得られた。
図1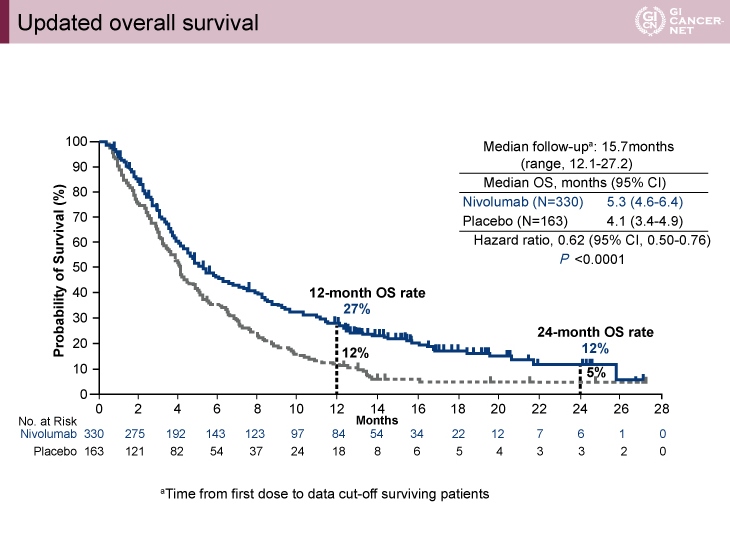
PD-L1発現は、Nivolumab群39%(130例)、プラセボ群35%(62例)において解析可能であり、そのうち腫瘍細胞の1%以上にPD-L1発現を認めた症例はNivolumab群12%(16例)、プラセボ群16%(10例)、5%以上の発現を認めた症例はそれぞれ8%(10例)、11%(7例)であった。
腫瘍細胞の1%以上にPD-L1発現を認めた症例におけるOS中央値は、Nivolumab群が5.2ヵ月、プラセボ群が3.8ヵ月であった(HR=0.58, 95% CI: 0.24-1.38)(図2)。一方、PD-L1発現が1%未満であった症例におけるOS中央値は、Nivolumab群6.1ヵ月、プラセボ群4.2ヵ月であった(HR=0.71, 95% CI: 0.50-1.01)。OSおよびPFSにおいてPD-L1の発現の有無(1%以上 vs. 1%未満, 5%以上 vs. 5%未満)にかかわらず、Nivolumab群がプラセボ群より良好な成績であった。
図2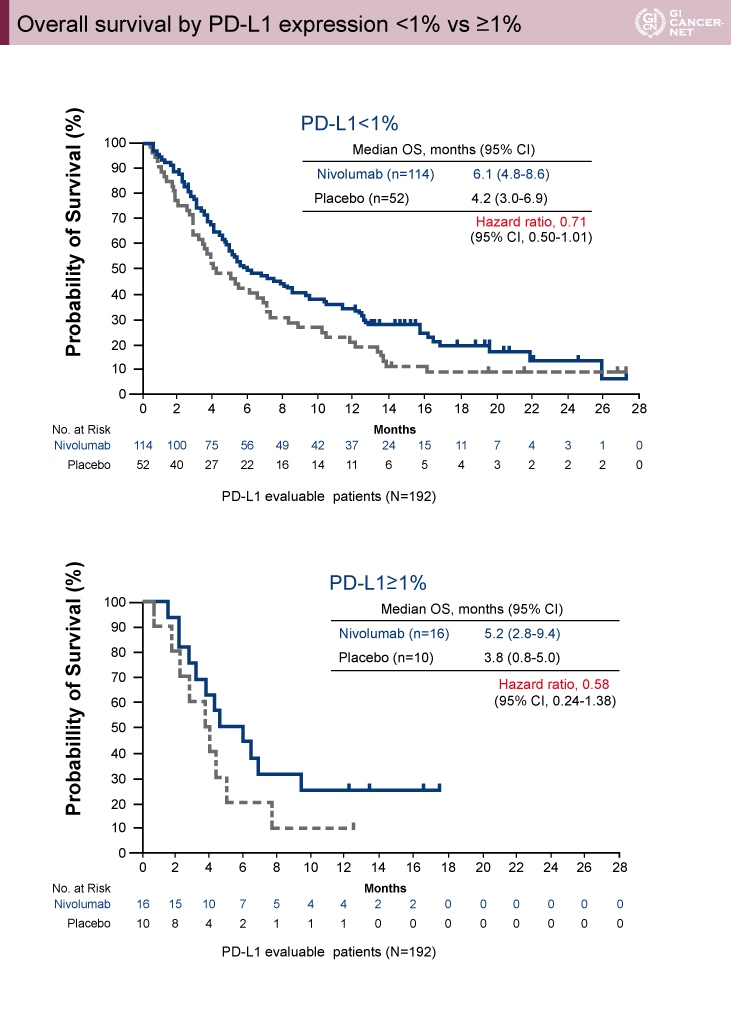
治療関連有害事象は管理可能であり、過去の報告と同様であった。また、多くの治療関連有害事象は投与開始後3ヵ月以内に認められていた。
結論
Nivolumabは2レジメン以上の標準治療に不応・不耐の進行胃癌・食道胃接合部癌において、PD-L1の発現の有無にかかわらず有効であった。
(レポート:国立がん研究センター東病院 消化管内科 久保木 恭利)

山﨑 健太郎 先生
静岡県立静岡がんセンター 消化器内科 医長