Stage III結腸癌に対するOxaliplatin併用術後補助化学療法の投与期間(3ヵ月 vs. 6ヵ月)に関する6つの第III相試験の前向き統合解析(IDEA collaboration)
Prospective pooled analysis of six phase III trials investigating duration of adjuvant Oxaliplatin-based therapy (3 vs. 6 months) for patients with stage III colon cancer: Updated results of IDEA (International Duration Evaluation of Adjuvant Chemotherapy)
Axel Grothey, et al.
監修コメント
本試験の結果は、2017年6月の米国臨床腫瘍学会年次集会にて報告されたことは記憶に新しい。そしてESMOでは、米国臨床腫瘍学会年次集会で報告のなかったACHIEVE試験などの個別の結果に加えて、各方面からの意見、解釈を総合的にディスカッションする場としてSpecial Sessionが組まれた。全体の試験の結果としては、Oxaliplatin併用の術後補助化学療法6ヵ月投与に対して3ヵ月投与が非劣性を証明できなかったということがすべてであるが、結果をどのように解釈して、いかに臨床に反映させるのかというところが今回のセッションの目的であった。
当セッションでは、SCOT試験、TOSCA試験、ACHIEVE試験、IDEA France試験、そしてIDEA全体の結果が報告され、その後臨床家と統計家より1名ずつ、ディスカッサントがプレゼンを行った。臨床家として英国のProf. Maughanから、神経毒性は患者にとって重要な問題であること、そして医療経済的にも6ヵ月投与が3ヵ月投与になることは重要であると指摘がなされた。
CAPOXがFOLFOXより効果的である理由としては、より持続的なフッ化ピリミジン系製剤の暴露や、Oxaliplatinの初回投与量が多いことなどが理由として考えられたが、一方で、切除不能進行・再発大腸癌に対する比較試験では差がないこともあり、単なる選択バイアスであり、実際には差がない可能性が指摘された。その上で、基本的にすべての患者にCAPOXの3ヵ月投与を選択すべきとし、より強力な治療を希望する患者(fighter)や、T4などのより進行した患者に対して+3ヵ月の治療を考慮すると結論した。ただ、これは医療経済に敏感な英国からの意見ということを考慮する必要があると思われる。そして、統計家として米国のProf. Buyseからは、全体の結果は非劣性を証明できなかったとしながら、FOLFOXとCAPOXの間で強い交互作用が認められていることを指摘しつつ、IDEAのデザインが2つのレジメンを無作為化していないことから、直接比較することができないとした。最終的には、高精度医療(precision medicine)には無作為化試験が必要であるが、患者一人一人にとっての優先すべきものは異なるため、個々に適切な医療(individualized medicine)を評価する新しい統計学的アプローチが必要と結論した。
もちろん日常診療で出会う患者に対しては、科学的エビデンスを基に、医療者の専門性と患者の希望を加味したうえで最善の医療を提供することになる。IDEAの全体の結果は非劣性を証明できなかったわけであるが、内容を吟味して現実の患者への適応を考えることが重要である。T4N2のような進行した患者では、FOLFOXあるいはCAPOXを6ヵ月投与すること(を目指す)に異を唱える臨床家は少ないと思われる。ただCAPOXに関しては、神経毒性が強い場合にはOxaliplatinを早めに中止しても患者のマイナスは少ないと感じられた。そして、T1-3N1に対しては、CAPOXであれば3ヵ月で十分というのが、セッションの最後に行われた研究者のディスカッションでも共通認識であった。
一方で、日本の研究者にとって新たな疑問点が生まれたともいえる。日本で行われたACHIEVE試験では、T1-3N1に対するCAPOXの3年DFS割合は6ヵ月投与で87.9%、3ヵ月投与で92.6%である一方で、JCOG0910試験は、stage IIIAが20%、IIIBが70%含まれており、術後Capecitabine単剤6ヵ月投与での、3年DFS 81.7%(Hamaguchi, ESMO2017)であった。よって、stage IIIAに対する3年DFS割合は90%に近いと推察される。異なる試験における数値を比較する時は、背景や治療内容について慎重に吟味する必要はあるが、ほぼ同等の有効性を示しているCAPOXの3ヵ月投与と、Capecitabine単剤6ヵ月投与のリスクベネフィットバランスについて、何が患者にとって最適かを議論すべきであると思われた。
(コメント・監修:国立がん研究センター中央病院 消化管内科 医長 加藤 健)
結腸癌に対する術後補助化学療法:治療効果の担保と神経毒性の軽減
Stage III結腸癌に対する術後補助化学療法は、6ヵ月間のFOLFOX(5-FU/LV+Oxaliplatin)もしくはCAPOX(Capecitabine+Oxaliplatin)が標準である1-3)。一方で、Oxaliplatinの神経毒性は用量依存的に生じ、時に不可逆的なものとなるため、短期的にも長期的にも患者のQOLを大きく損ねる原因となる4)。したがって、治療の有効性を低下させずに治療期間が短縮可能となれば、患者のベネフィットになるのみならず、医療資源の面からもメリットが大きいと考えられる。
IDEA(International Duration Evaluation of Adjuvant chemotherapy) collaborationは、結腸癌に対する術後補助化学療法としてのFOLFOXもしくはCAPOXの投与期間について、標準治療の6ヵ月投与に対する3ヵ月投与の非劣性を検証した、12ヵ国にまたがった6つの無作為化第III相試験[SCOT試験(英国、デンマーク、スペイン、オーストラリア、スウェーデン、ニュージーランド)、TOSCA試験(イタリア)、CALGB/SWOG C80702試験(米国、カナダ)、IDEA France試験(フランス)、ACHIEVE試験(日本)、HORG試験(ギリシャ)]を統合解析したものである。本試験の結果は2017年の米国臨床腫瘍学会年次集会にて報告され、本会ではそのアップデート、および結果の解釈についてのディスカッションが行われた。
Oxaliplatinベースの術後補助化学療法6ヵ月投与に対する3ヵ月投与の非劣性を検証
本試験のデザインは、stage III結腸癌に対するFOLFOXまたはCAPOX(治療医による選択)いずれかの術後補助化学療法の投与期間として、6ヵ月に対する3ヵ月の非劣性を比較検討した第III相無作為化試験の統合解析である。
主要評価項目はDFS (disease-free survival)であり、非劣性デザインとして、6ヵ月群に対する3ヵ月群の相対リスク減少率を12%とし、DFSのハザード比の信頼区間の上限が1.12を超えないことが必要とされた。
リスクおよびレジメンを選択することで3ヵ月投与の非劣性が示唆された
全体で12,834例のstage III結腸癌患者が解析対象となった。試験ごとの患者背景については、T4症例の割合がSCOT試験(29%)とACHIEVE試験(28%)で高く、CAPOXを投与された症例の割合は最大がACHIEVE試験の75%、最小がC80702試験の0%と偏りがみられた(表1)。また、観察期間中央値は各試験で35ヵ月から62ヵ月であったが、その他の患者背景には大きな偏りはみられなかった。
表1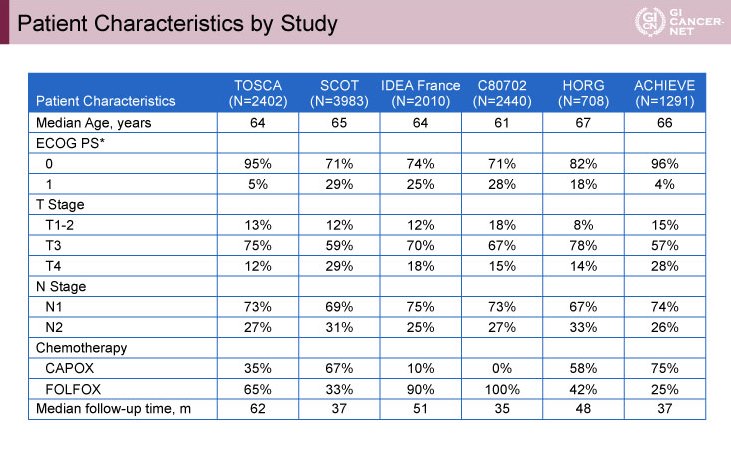
治療に伴うgrade 2以上の神経毒性の頻度は、3ヵ月群は6ヵ月群と比べてFOLFOX投与例(17% vs. 48%, p<0.0001)、CAPOX投与例(15% vs. 45%, p<0.0001)いずれにおいても有意に低い傾向がみられた。
主要評価項目である全症例のDFSは、3年DFS割合が3ヵ月群74.6%、6ヵ月群で75.5%であり、その差は0.9%と小さいものの、ハザード比は1.07(95% CI: 1.00-1.15)と95%信頼区間の上限が非劣性マージンである1.12を上回り、3ヵ月群の6ヵ月群に対する非劣性は証明されなかった。この結果は、2017年米国臨床腫瘍学会における報告と同様であった。
腫瘍の壁深達度およびリンパ節転移をもとにしたリスク分類(低リスク例:T1-3かつN1、高リスク例:T4またはN2)およびレジメン別に層別すると、低リスク例におけるCAPOXでは、3ヵ月投与の6ヵ月投与に対する非劣性が認められた(HR=0.85, 95% CI: 0.71-1.01)。一方、高リスク例におけるFOLFOXでは、3ヵ月投与は6ヵ月投与に対して有意にDFSが劣っていた(HR=1.20, 95% CI: 1.07-1.35)。また、その他の症例(低リスク例におけるFOLFOX、高リスク例におけるCAPOX)については、3ヵ月投与の6ヵ月投与に対する非劣性は証明されなかった。交互作用は、レジメンの差において強く観察されたが(p=0.0061)、リスクグループの差では顕著ではなかった(p=0.11)(表2)。なお、レジメンごとに患者背景を比較すると、CAPOX投与例はFOLFOX投与例に比べてECOG PSが良好であり(p<0.0001)、T4(p<0.0001)、高リスク例(p<0.0001)が多い傾向がみられた。
表2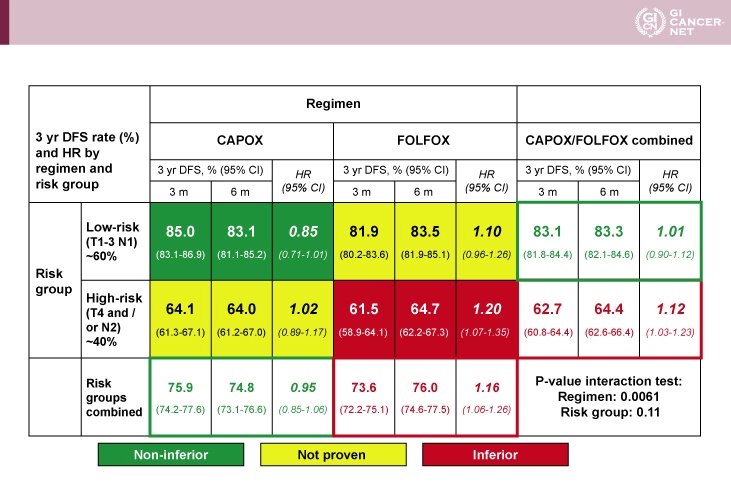
結論
Stage III結腸癌に対するOxaliplatinベースの術後補助化学療法の投与期間として、3ヵ月投与の6ヵ月投与に対する非劣性は、全体解析においては証明されなかった。一方で、3ヵ月投与では神経毒性の有意な軽減が認められ、CAPOX投与例においては、特に低リスク例に対して、3ヵ月投与は6ヵ月投与と遜色ないDFSが得られた。FOLFOX投与例においては、特に高リスク例で3ヵ月投与が有意に劣る結果となったが、本研究のデザインではCAPOXの3ヵ月投与例とFOLFOXの6ヵ月投与例の直接比較は困難である点に注意が必要である。
本試験の結果は、術後補助化学療法の個別化の必要性を提起するものであり、患者のリスク分類、投与レジメンに加え、患者の状態(医学的な状態に加え、経済的な状況も含まれる)を踏まえ、治療期間を検討する必要があると言えるだろう。
(レポート:がん研有明病院 総合腫瘍科 福田 直樹)

加藤 健 先生
国立がん研究センター中央病院 消化管内科 医長