進行胃癌のNivolumab(Nivo)治療に関する観察および橋渡し研究の中間解析:JACCRO GC-08(DELIVER試験)
Interim analysis of an observational/translational study for nivolumab treatment in advanced gastric cancer: JACCRO GC-08 (DELIVER trial)
Yu Sunakawa, et al.
監修コメント
胃癌に対するNivolumab(Nivo)治療について、前向きに集められたリアルワールドデータが示された。
ATTRACTION-2試験1)は三次治療以降のNivo単剤療法の有効性を示し、奏効割合(RR)が約11%、病勢コントロール割合(DCR)が約40%であった。日常臨床でこのATTRACTION-2試験のデータが再現されているのか、われわれの日常臨床での手ごたえはどうか。DELIVER試験は500例の胃癌に対するNivo治療の観察研究であり、今回は198例の中間解析結果ではあるが、日常臨床でわれわれが感じる数値が示されているのではないだろうか。
ATTRACTION-2試験には、PS(performance status)2、高度腹水・腹膜播種症例は含まれていなかった。DELIVER試験のRR、DCRが既報の数値より低いのは、このような点が影響しているものの、通常の日常臨床でよく診る症例が含まれていることを考えると、まさにこれがリアルワールドデータと言えよう。DCRのサブ解析結果には治療のヒントがあり、PS不良例や腹膜播種・腹水症例ではNivoの効果が少し弱いことが推測される。また、HPD(hyper-progressive disease:急速な腫瘍増大)に関するサブ解析の結果を見ると、想像以上に高い割合でHPDを認めている可能性が示された。しかし、HPDを解析した研究はいくつか報告されているが、HPDの定義は各試験で異なっており、現時点で明確な基準はない。今後HPDの定義について議論されていくだろう。
本試験はNivoの腸内細菌バイオマーカーを検証する試験でもある。500例の前向きな臨床データの発表とともに、Nivoの新しいバイオマーカーについて報告されることを期待したい。
(コメント・監修:聖マリアンナ医科大学 臨床腫瘍学 准教授 砂川 優)
進行胃癌のNivolumab(Nivo)治療に関する、前向きな初のリアルワールドデータの中間解析報告
Nivoは、切除不能進行・再発胃癌/胃食道接合部癌患者を対象とした第III相試験において、良好な全生存(OS)期間の延長と安全性が報告されている(ATTRACTION-2試験1))。同試験では、奏効割合(RR)11.2%、病勢コントロール割合(DCR)40.3%、12ヵ月OS割合は、Nivo群で26.2%、プラセボ群で10.9%である。しかしながら現在まで、胃癌患者に対するNivo療法を前向きに調査したリアルワールドの治療成績の報告はなく、特に、PS(performance status)2の患者や腹膜播種・高度腹水を伴う患者に対する効果や安全性については不明確であった。
さまざまなバイオマーカー研究において、Nivoの治療効果予測因子が探索されており、腫瘍検体のPD-L1(programmed cell death 1)発現、腫瘍内遺伝子変異量、高頻度マイクロサテライト不安定性(high-frequency microsatellite instability:MSI-H)などが報告されている。しかし、ATTRACTION-2試験のサブ解析ではPD-L1発現は治療効果の予測因子とならないことが示された。
宿主免疫の因子はヒトの免疫状態を測る新たな指標となる可能性があり、免疫療法の効果予測因子ともなり得る。DELIVER試験では、胃癌の実臨床におけるNivoの抗腫瘍効果と安全性を評価するとともに、Nivoに対する腸内細菌叢も含めた宿主免疫の新しいバイオマーカーを探索・検証する目的で行われた。今回はこの試験の中間解析の報告が行われた。
進行胃癌に対するNivo療法の抗腫瘍効果と、腸内細菌叢を含むバイオマーカーを検証
本試験のデザインは、PS 0-2、20歳以上の進行胃癌で、Nivo療法症例の臨床情報とバイオマーカーを解析する多施設共同観察研究である。Nivoの治療前と腫瘍進行または治療不耐後に採便と採血が行われ、採便では腸内細菌叢を、採血では遺伝子発現、SNPs(single nucleotide polymorphism:一塩基多型)、メタボローム解析が行われた。
バイオマーカー解析の主要評価項目は、Nivoの抗腫瘍効果[初回評価にて病勢進行(PD)か否か]と治療前の腸内細菌叢の遺伝学的情報との関連性であった。臨床試験の主要評価項目である全生存(OS)期間、無増悪生存(PFS)期間、RRについては、Nivoを1コース以上施行した患者を解析対象集団とし、抗腫瘍効果と安全性の解析が行われた。バイオマーカー解析は、同集団のうち腸内細菌叢の遺伝学的情報が得られた患者を対象とした。
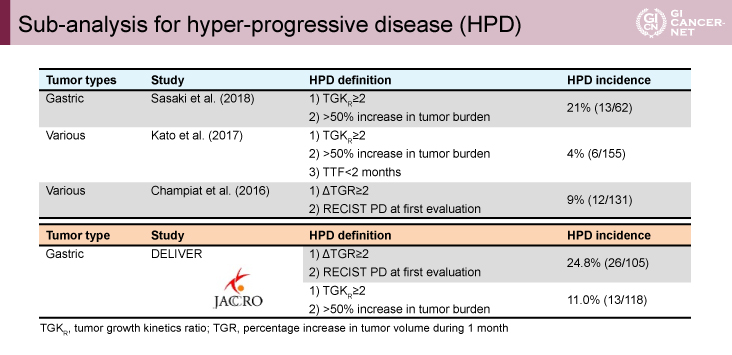
RRは5.6%、58.4%に初回評価で腫瘍増大速度の低下を認めた一方、24.8%にHPD(hyper-progressive disease:急速な腫瘍増大)を認めた
2018年3月から2019年8月までに登録された501例のうち、前半の198例が今回の中間解析対象となった。年齢中央値70歳、男性75%、ECOG(Eastern Cooperative Oncology Group)PSは0が47%、1が39%、2が14%、HER2陽性が20%、組織型は、管状腺癌(tub)47%、低分化腺癌(por)38%、印環細胞癌(sig)6%であった(表1)。
抗腫瘍効果に関しては、測定可能病変を有する119例中、RRは5.6%(95% CI: 2.3-11.3)、DCRは33.1%(95% CI: 24.9-42.1)であった(表2)。患者背景に関するDCRのサブ解析では、PS 0、PS 1、PS 2でそれぞれDCRは38.3%、35.1%、22.2%であり、また、sig、腹膜播種、腹水のある集団では低値であった(表3)。一方、HER2ステータスや好中球-リンパ球比の因子によってはDCRに差は認めなかった。また、今回は治療開始後のTGR(tumor growth rate:腫瘍増大割合)、HPD(TGRが治療前後で2倍以上、かつ、初回のRECIST評価にてPD)についても検討されている。TGRが評価可能な105例では、Nivo療法開始後の患者の58.4%でTGRが低下した。一方、24.8%にHPDを認め、胃癌をはじめとする既報と比較しても高率であった(表4)2-4)。
表1 Patient characteristics(発表者の許可を得て掲載)
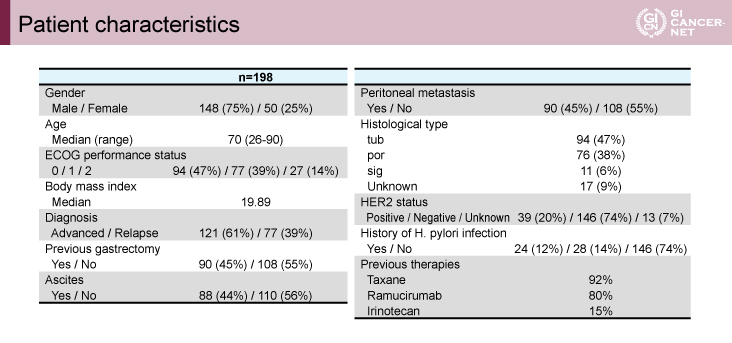
表2 Response(発表者の許可を得て掲載)
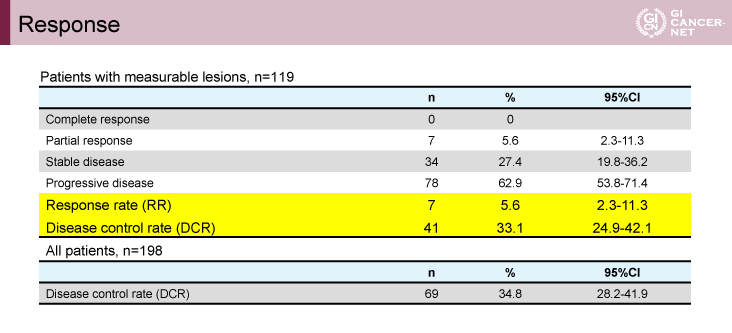
表3 Sub-analysis for DCR by patient characteristics(発表者の許可を得て掲載)
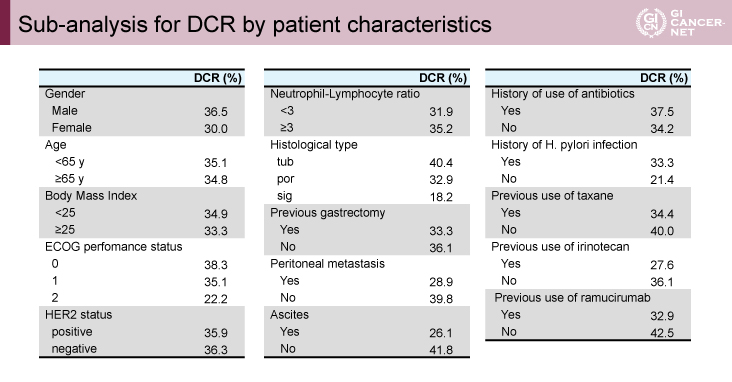
表4 Sub-analysis for hyper-progressive disease(HPD)(発表者の許可を得て掲載)
まとめ
本試験の中間解析の結果は、進行胃癌に対するNivo投与の抗腫瘍効果についてリアルワールドデータとしての最初の報告であり意義の高いものと考える。本試験ではPS 2、腹膜播種や高度腹水を有する患者のデータを含んでおり、Nivoの投与により腫瘍容積の減少をある一定の割合で認める一方で、既報に比して高率のHPDを認めた。実臨床でどのような症例にNivo投与の意義が高いのか、今後のバイオマーカー解析の結果が期待される。
(レポート:聖マリアンナ医科大学 臨床腫瘍学 梅本 久美子)
References
- 1) Kang YK, et al.: Lancet. 390(10111): 2461-2471, 2017 [PubMed]
- 2) Sasaki A, et al.: Gastric Cancer. 22(4): 793-802, 2019 [PubMed]
- 3) Kato S, et al.: Clin Cancer Res. 23(15): 4242-4250, 2017 [PubMed]
- 4) Champiat S, et al.: Clin Cancer Res. 23(8): 1920-1928, 2017 [PubMed]
関連サイト
- ・ATTRACTION-2試験 [ClinicalTrials.gov][学会レポート(ESMO 2018 #617PD)][論文紹介]
- ・DELIVER試験 [ClinicalTrials.gov][UMIN]

砂川 優 先生
聖マリアンナ医科大学 臨床腫瘍学 准教授