Fluoropyrimidine、Oxaliplatin、Irinotecanを含む化学療法に不応または不耐のRAS野生型切除不能進行・再発大腸癌に対する、RegorafenibとCetuximabの逐次投与とCetuximabとRegorafenibの逐次投与の無作為化比較第II相試験(REVERCE試験):バイオマーカー解析
REVERCE: Randomized phase II study of regorafenib followed by cetuximab versus the reverse sequence for metastatic colorectal cancer patients previously treated with fluoropyrimidine, oxaliplatin, and irinotecan - Biomarker analysis
Yasushi Tsuji, et al.
監修コメント

山﨑 健太郎先生
静岡県立静岡がんセンター 消化器内科 医長
ASCO GI 2018で発表されたREVERCE試験では、試験アームであるRegorafenib → Cetuximab逐次治療は従来のCetuximab → Regorafenib逐次治療より有意に全生存(OS)期間を延長していたが、このメカニズムは明らかでなかった。本研究はREVERCE試験におけるバイオマーカー解析であり、OS期間が有意に延長した理由が明らかになるか注目されていたが、残念ながら明確な結論は得られなかった。しかし、日本人における前向き試験において、既報と同様、抗EGFR抗体薬であるCetuximab投与後に遺伝子変異が増加することが確認されたことは重要な所見である。また、liquid biopsyによる遺伝子変異有無と全体集団におけるOS期間の解析において、治療1の開始前に遺伝子異常を認めた症例では最も生存が短く、次いで治療2の開始前に遺伝子異常を認めた症例で生存が短かったことは、抗EGFR抗体薬の有効性の有無を反映していると考えられ、liquid biopsyによる治療直前の遺伝子異常ステータスの確認が抗EGFR抗体薬の治療効果予測に適用できる可能性を示唆する所見であった。
(コメント・監修:静岡県立静岡がんセンター 消化器内科 医長 山﨑 健太郎)
REVERCE試験におけるバイオマーカー探索についての結果が報告された
血管新生阻害作用をもつマルチキナーゼ阻害薬であるRegorafenibは、Fluoropyrimidine、Oxaliplatin、Irinotecan、血管新生阻害薬、抗EGFR抗体薬(RAS野生型の場合)に不応不耐となった切除不能進行・再発大腸癌に対する標準治療の1つとして認識されている1)。REVERCE試験は、RAS野生型に対する標準治療であるCetuximab±Irinotecan → Regorafenib(C-R)療法の逐次投与に対する、投与順序を逆にしたRegorafenib → Cetuximab±Irinotecan(R-C)療法の逐次投与の有効性と安全性を比較検討した無作為化比較第II相試験であり、結果はASCO GI 20182)で報告された。2013年11月から2016年9月までにR-C療法群51例、C-R療法群50例が割り付けられ、主要評価項目である全生存(OS)期間はR-C療法群で有意に延長されていた。REVERCE試験ではバイオマーカー探索も行われ、ASCO GI 2018ではCetuximab±Irinotecan投与前後でのliquid biopsyによるRAS、BRAF遺伝子変異のみが報告された。本研究はそれ以外のバイオマーカー探索についての結果報告である。
Liquid biopsyにより、治療前後での遺伝子変異の出現、EGF、VEGF pathwayの関連蛋白を解析
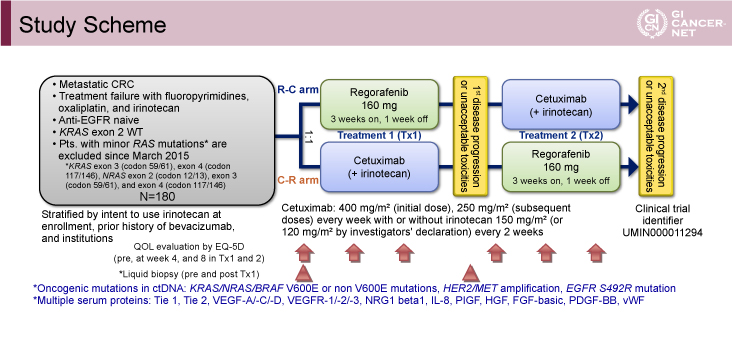
REVERCE試験では、Fluoropyrimidine、Oxaliplatin、Irinotecanを含む化学療法に不応または不耐となったECOG PS(performance status)0/1のKRAS野生型(RAS遺伝子変異検査が保険償還されて以降はRAS野生型)切除不能進行・再発大腸癌患者が対象とされた。両群ともに先に行われた治療1(R-C療法群ではRegorafenib、C-R療法群ではCetuximabを投与)前後で血液検体が採取された。治療1前後でのRASやBRAF変異、HER2/MET増幅などのliquid biopsyによる遺伝子解析や、EGFやVEGF pathwayに関連する蛋白が測定された(図1)。
図1 Study Scheme(発表者の許可を得て掲載)
C-R療法群においてCetuximab投与前後で新たに遺伝子変異が発現
ASCO GI 2018で報告された通り、主要評価項目であるOS期間の中央値(MST)は、R-C療法群17.4ヵ月、C-R療法群11.6ヵ月、ハザード比(HR)=0.61(95% CI: 0.39-0.96)とR-C療法群が有意に良好であった(p=0.029)。治療1の無増悪生存(PFS)期間(PFS1)の中央値は、R-C療法群2.4ヵ月、C-R群4.2ヵ月、HR=0.97(95% CI: 0.62-1.54)、p=0.91と統計学的な差を認めなかったが、治療1に続き行われた治療2のPFS期間(PFS2)の中央値は、R-C療法群5.2ヵ月、C-R療法群1.8ヵ月、HR=0.29(95% CI: 0.17-0.50)と有意にR-C療法群が良好であった。
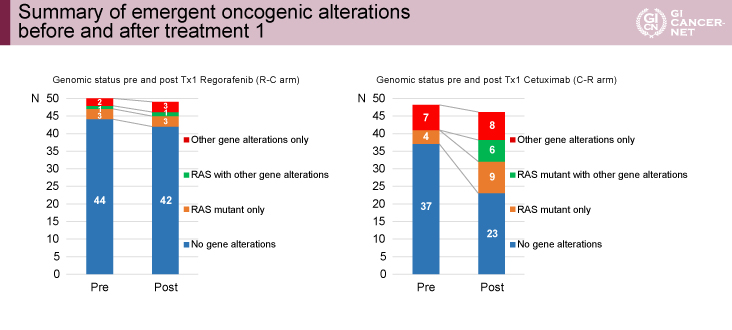
Liquid biopsyによる遺伝子変異解析では、R-C療法群の治療1前の遺伝子変異はRAS変異4例、BRAF V600E変異1例、HER2増幅1例、MET増幅1例であり、治療1後ではRAS変異4例、BRAF V600E変異1例、HER2増幅2例、MET増幅3例(重複含む)であった。一方C-R療法群では治療1前はRAS変異4例、BRAF V600E変異3例、HER2増幅1例、MET増幅4 例であったのに対し、治療1後にはRAS変異16例、BRAF V600E変異4例、HER2増幅5例、MET増幅9例(いずれも重複含む)と遺伝子変異が明らかに増加していた(図2)。
図2 Summary of emergent oncogenic alterations before and after treatment 1(発表者の許可を得て掲載)
サブグループ解析は、原発部位、治療前のliquid biopsyによるRAS変異の有無、RAS/BRAF変異の有無、RAS/BRAF変異もしくはHER2/MET増幅の遺伝子変異の有無で解析された。OSでは、左側原発集団(81例)、RAS野生型集団(90例)、RAS/BRAF野生型集団(86例)、RAS/BRAF野生型かつHER2/MET増幅陰性集団(81例)において、R-C療法群が良好な結果であった。これらの集団はPFS1ではR-C療法群とC-R療法群とで差を認めなかったが、PFS2ではいずれの集団においてもR-C療法群が良好な結果であった(図3)。
図3 Subgroup analysis of OS and PFS1/2 according gene status(発表者の許可を得て掲載)
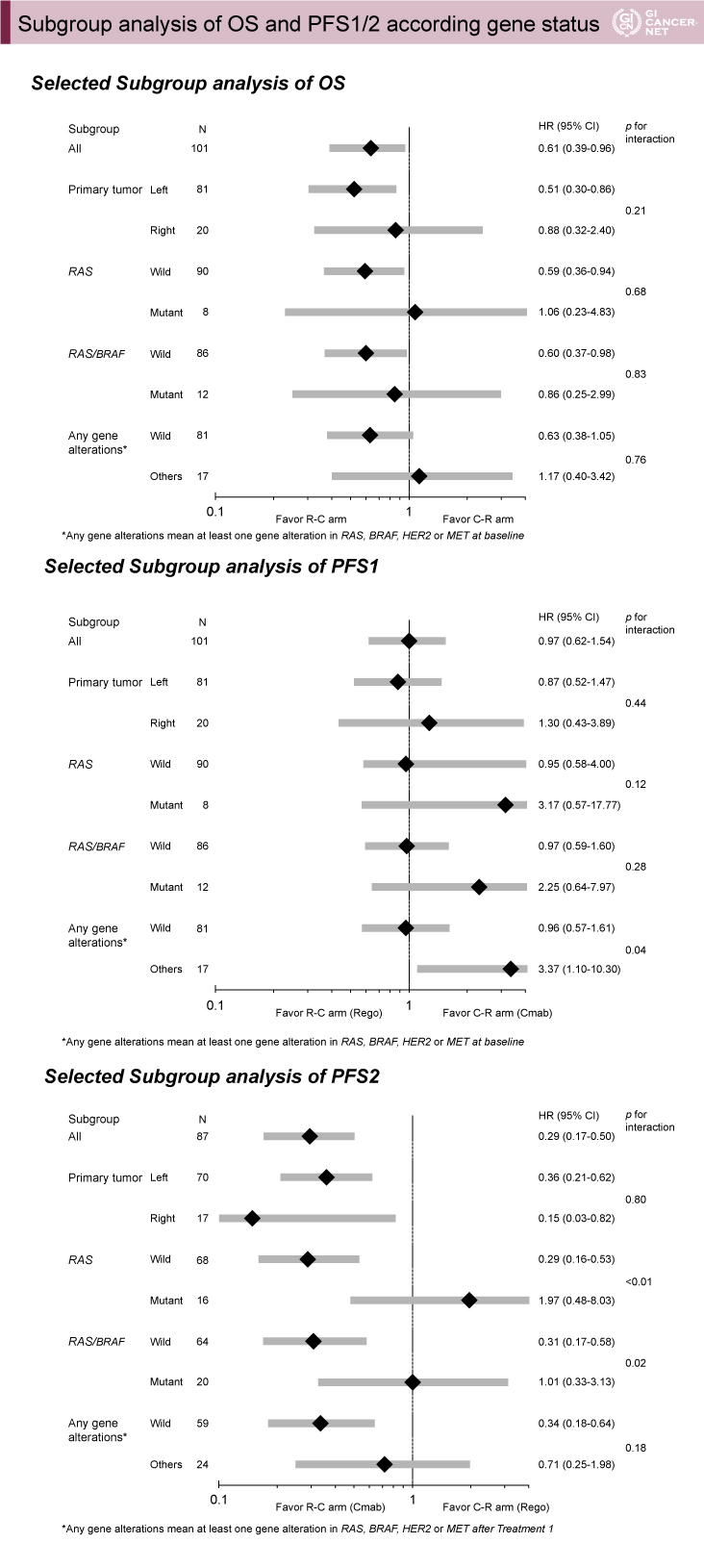
遺伝子変異の有無によるOSの層別解析では、MSTが、治療1前後でいずれも遺伝子変異を認めなかった集団(63例)で17.7ヵ月、治療1前から遺伝子変異が存在した集団(16例)で6.3ヵ月、治療1前後で遺伝子変異が出現した集団(15例)で10.0ヵ月であった。
血中蛋白によるサブグループ解析において、PFS1ではPlGF、VEGFR-3値と治療効果に交互作用を認めたが(それぞれp=0.02、p=0.01)、PFS2やOS期間では治療効果と交互作用を示したものはなかった。
まとめ
Regorafenibと比べCetuximab投与の前後でより多くの遺伝子変異が出現しており、それが予後に関連していた。血中のEGFやVEGF pathwayの関連蛋白の濃度に関係なく、OSはR-C群で良好であった。
(レポート:静岡がんセンター 消化器内科 古田 光寛)
References
1) NCCN Guidelines: Colon Cancer, Ver. 2.2018
2) Shitara K, et al.: ASCO GI 2018 Abstr #557[学会レポート]

監修
谷口 浩也先生
愛知県がんセンター中央病院
薬物療法部 医長
加藤 健先生
国立がん研究センター中央病院
消化管内科 医長
山﨑 健太郎先生
静岡県立静岡がんセンター
消化器内科 医長
上野 誠先生
神奈川県立がんセンター
消化器内科 医長
レポーター (50音順)
伊澤 直樹先生
聖マリアンナ医科大学
臨床腫瘍学
大北 仁裕先生
香川大学医学部
腫瘍内科
小林 智先生
神奈川県立がんセンター
消化器内科
佐藤 雄哉先生
国立がん研究センター中央病院
臨床研究支援部門
高橋 直樹先生
埼玉県立がんセンター
消化器内科
寺島 健志先生
金沢大学
先進予防医学研究センター
古田 光寛先生
静岡がんセンター
消化器内科
堀田 洋介先生
埼玉医科大学国際医療センター
消化器腫瘍科