肝転移単独切除不能進行・再発大腸癌に対するTripletレジメン+BiologicsとDoubletレジメン+Biologicsを比較した多施設共同無作為化第II相試験(METHEP2試験)
監修コメント

山﨑 健太郎先生
静岡県立静岡がんセンター 消化器内科 医長
TRIBE試験では、切除不能進行・再発大腸癌に対する初回治療として、Triplet(3剤併用療法)+BevacizumabはDoublet(2剤併用療法)+Bevacizumabより奏効率(ORR)が有意に良好であったが、R0切除率は両群間で有意差は認められなかった1)。本METHEP2試験はTRIBE試験とは異なり、肝転移単独の切除不能進行・再発大腸癌を対象にしたTriplet+BiologicsとDoublet+Biologicsの比較試験であり、その結果が注目されていたが、Triplet群はDoublet群と比較してR0/R1切除率が高かったものの、統計学的な有意差は示せなかった。一方、RAS野生型切除不能進行・再発大腸癌を対象にTriplet+PanitumumabとDoublet+Panitumumabを比較した第II相試験であるVOLFI試験においては、切除率がTriplet群で有意に良好であった(33.3% vs. 12.1%、p=0.029)2,3)。いずれも第II相試験の結果で、また対象やTripletレジメンの用法用量、併用するBiologicsも異なることから、明確に結論づけられないが、いずれの試験でもTriplet群で良好な傾向を認めていることより、根治切除を企図して化学療法を選択する際には、Tripletレジメンは重要なオプションになると考える。
METHEP2試験では全生存(OS)期間もTriplet群で良好な傾向を認めるものの、有意差は認めなかった。これまでにTripletレジメン+抗EGFR抗体薬療法の良好なORR、根治切除率が報告されているが、生存への寄与に関しては未だ不明であり、また安全性における懸念もあることから、Tripletレジメン+抗EGFR抗体薬療法は適切に設計された臨床試験で行うべき治療と考える。また、METHEP2試験ではRAS変異の有無により併用する分子標的治療薬が規定されており、本対象に対していずれの分子標的治療薬が適切かどうかまでは結論づけられない。しかし、本邦で行われたATOM試験ではRAS野生型の切除不能大腸癌肝限局転移例に対し、mFOLFOX6+Cetuximab療法とmFOLFOX6+Bevacizumab療法のどちらが有用であるかが比較され、主要評価項目の無増悪生存(PFS)期間、副次評価項目の肝切除率ともに分子標的治療薬間での有意差は認められなかったことが報告されている4)。
現在本邦において、RAS野生型切除不能進行・再発大腸癌を対象にTripletレジメン+CetuximabまたはBevacizumabを比較するJACCRO CC-13(DEEPER)試験が進行中であり5)、Tripletレジメンと併用する際の最適な分子標的治療薬が決定されることを期待する。
(コメント・監修:静岡県立静岡がんセンター 消化器内科 医長 山﨑 健太郎)
#3535
Induction chemotherapy (CT) with FOLFIRINOX or FOLFOX/FOLFIRI, plus cetuximab (CET) or bevacizumab (BEV) (by RAS status), in patients (pts) with primarily unresectable colorectal liver metastases (CRLM): results of the randomized UNICANCER PRODIGE 14-ACCORD 21 (METHEP-2) trial
Marc Ychou, et al.
#3548
FOLFIRINOX plus cetuximab (CET) or bevacizumab (BEV) in patients (pts) with initially unresectable colorectal liver metastases (CRLM) with BRAF mutated (mut) tumors: a subgroup analysis of the UNICANCER PRODIGE 14-ACCORD 21 (METHEP2) trial
Evelyne Lopez-Crapez, et al.
TripletレジメンではDoubletレジメンより肝切除率が高い
切除不能な肝転移を有する大腸癌に対して、化学療法奏効後に治癒を目指した切除を行った場合、全生存(OS)期間が延長することが報告されている。このような大腸癌に対する化学療法として、一般的にTriplet(3剤併用療法)またはDoublet(2剤併用療法)レジメンにBevacizumabまたは抗EGFR抗体薬が併用される。これまでに、METHEP2試験では肝転移切除不能進行・大腸癌に対する初回治療として、Tripletレジメン[FOLFIRINOX(5-FU+Leucovorin+Irinotecan+Oxaliplatin)+Cetuximab/Bevacizumab(RAS変異型の場合はBevacizumabを選択)]が、Doubletレジメン[FOLFIRI(5-FU+Leucovorin+Irinotecan)またはFOLFOX(5-FU+Leucovorin+Oxaliplatin)にCetuximab/Bevacizumabを併用]と比べて肝切除率が高いことが報告されてきた6)。今回は、有効性に関する長期フォローアップデータが報告された。
分子標的治療薬の比較ではなく、TripletレジメンとDoubletレジメンを比較検証
METHEP2試験では肝転移切除不能進行・大腸癌患者が対象とされ、主な適格基準は、KRAS/RAS statusが判明しており、同時性または異時性肝転移で、肺転移が2cm未満かつ3個以下、術後補助化学療法(adjuvant chemotherapy)としてフッ化ピリミジン系薬剤±Oxaliplatin投与終了後1年以上経過していることなどであった。30%の正常肝を温存できない、あるいは6個以上の肝転移巣や肝両側に転移した腫瘍学的に非切除と考えられる症例、および原発巣切除不能例は除外された。
対象患者は、Doubletレジメン群(2-CT群)とTripletレジメン群(3-CT群)に1:1に、さらに2-CT群はFOLFIRI群とFOLFOX群に、いずれも無作為に割り付けられた。2-CT群のFOLFIRI群は、5-FU(400mg/m2+bolus 2,400mg/m2)+Leucovorin 400mg/m2+Irinotecan 180mg/m2、FOLFOX群は、5-FU(400mg/m2+bolus 2,400mg/m2)+Leucovorin 400mg/m2+Oxaliplatin 85mg/m2であった。3-CT群は、FOLFIRINOXとして、5-FU(400mg/m2+bolus 2,400mg/m2)+Leucovorin 400mg/m2+Irinotecan 180mg/m2+Oxaliplatin 85mg/m2が投与され、IrinotecanとOxaliplatinは病勢進行(PD)または不耐となるまで継続された。分子標的治療薬は事前に規定され、RAS変異型にはBevacizumab 5mg/kg、RAS野生型にはCetuximab 500mg/m2が、いずれも2週毎に併用された。
主要評価項目はR0/R1肝切除率、副次評価項目は、4サイクル投与終了時点での奏効率(ORR)、最終治療(手術または化学療法)後6ヵ月間における完全奏効(CR)率、R0/R1/R2それぞれの割合、病理学的CR率、化学療法の毒性、術後合併症、無増悪生存(PFS)期間、全生存(OS)期間であった。統計学的な設定は、R0/R1肝切除率を2-CT群50%、3-CT群70%として、両側α=5%、検出力90%とされた。
3-CT群では主要評価項目であるR0/R1肝切除率が高かったが、統計学的有意差は示されなかった
総登録患者数は256例で、126例が2-CT群(FOLFIRI群56例、FOLFOX群70例)に、130例が3-CT群(FOLFIRINOX群)に割り付けられた。全256例中91例(35.5%)がKRAS変異型、109例(42.6%)がRAS変異型であった。
患者背景では、3-CT群と比べ2-CT群で治療前CEA(carcinoembryonic antigen)の中央値がやや高い傾向を示したが(96.0ng/mL vs. 58.7ng/mL)、年齢、性別、ECOG PS(performance status)、原発巣部位、肝転移の同時性/異時性、肺転移の有無、非切除理由(技術的理由/腫瘍学的理由/両方)などでは両群の差が認められなかった。
主要評価項目であるR0/R1肝切除率は、2-CT群48.4%(95% CI: 39-57) vs. 3-CT群56.9%(95% CI: 48-66)で、統計学的有意差は認められなかった(p=0.17)。一方、層別因子を用いたロジスティック回帰分析では、3-CT群におけるR0/R1肝切除率は2-CT群と比べ有意に良好であった[Odds Ratio=1.8(95% CI: 1.1-2.7、p<0.02)]。
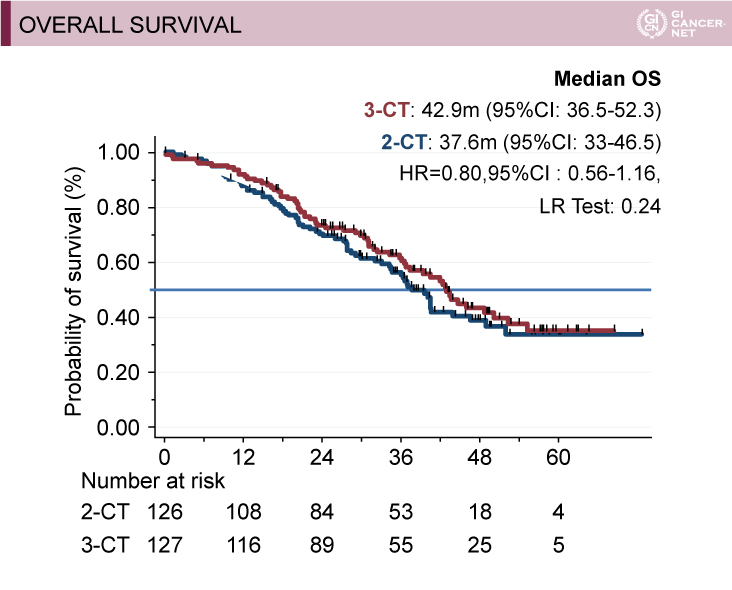
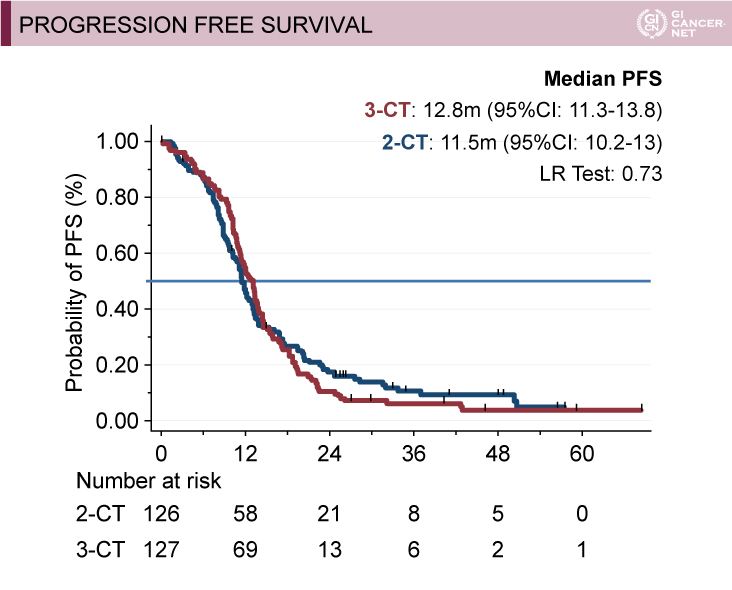
副次評価項目であるOS期間の中央値(MST)は、2-CT群37.6ヵ月 vs. 3-CT群42.9ヵ月、ハザード比(HR)=0.80(95% CI: 0.56-1.16)、PFS期間の中央値は、2-CT群11.5ヵ月 vs. 3-CT群12.8ヵ月であった(図1)。
図1 Secondary objectives: OS and PFS(Marc Ychouの許可を得て掲載)
Cetuximab併用153例とBevacizumab併用103例におけるサブグループ解析は、R0/R1肝切除率が56.2% vs. 47.6%、ORRが78.4% vs. 56.3%、PFS期間の中央値が12.8ヵ月 vs. 10.7ヵ月、OS期間のMSTが43.6ヵ月 vs. 34.2ヵ月で、3年OS率が66% vs. 46%であった。
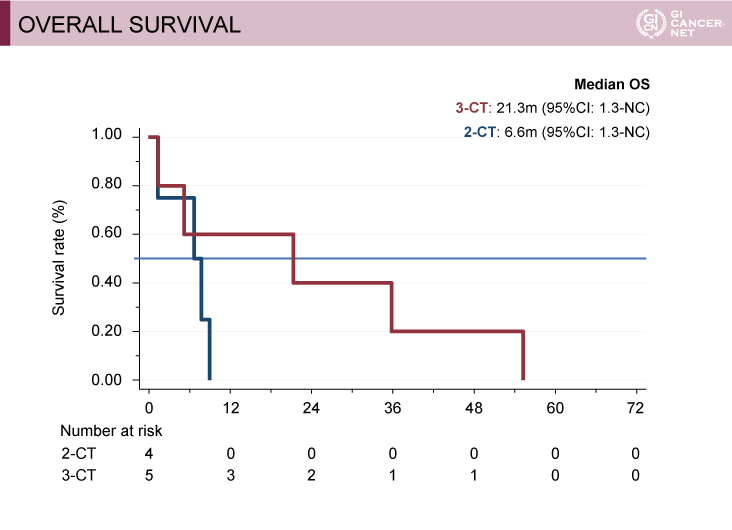
BRAF変異型におけるサブグループ解析では、3-CT群が良好な傾向を示した
BRAF遺伝子の評価が可能であった230例中9例(3.9%)がBRAF変異型であり、8例にCetuximabが、1例にBevacizumabが投与された。少数例の検討ではあるが、3-CT群では奏効例、R0/R1肝切除例を認めた。また2-CT群と比べ3-CT群では、PFS期間、OS期間ともに良好な傾向を示した(図2、図3、図4)。
図2 Efficacy results in BRAF population(subgroup analysis)(Evelyne Lopez-Crapezの許可を得て掲載)
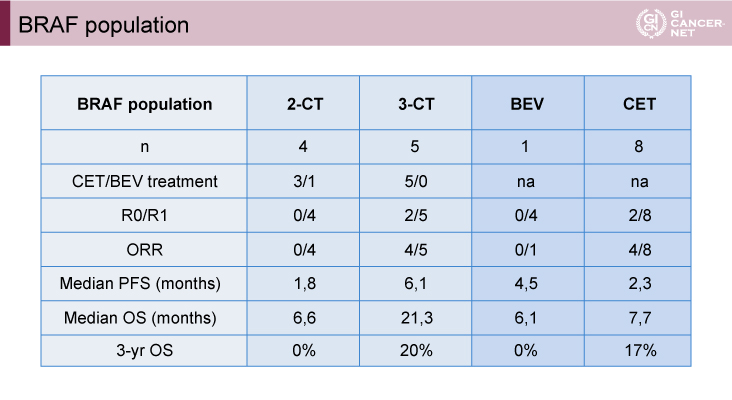
図3 Progression free survival(subgroup analysis)(Evelyne Lopez-Crapezの許可を得て掲載)
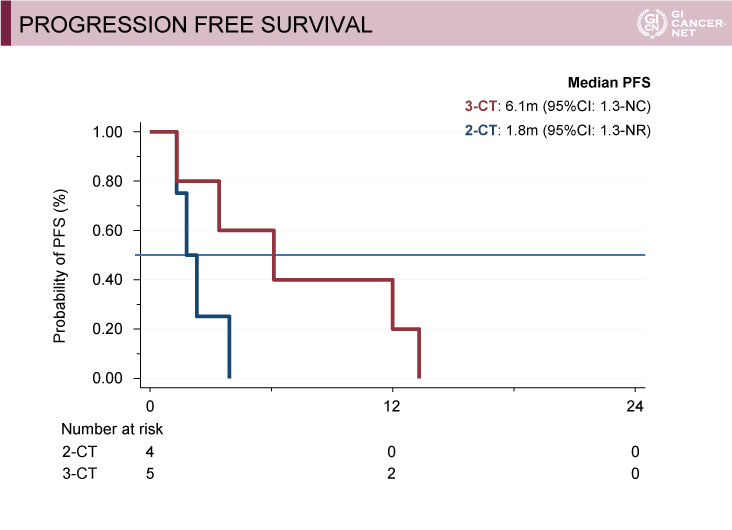
図4 Overall survival(subgroup analysis)(Evelyne Lopez-Crapezの許可を得て掲載)
まとめ
METHEP2試験では主要評価項目を達成できなかったが、2-CT群と比べ3-CT群ではR0/R1肝切除率が高かった。また、BRAF変異型のサブグループ解析では、Bevacizumab併用と比較してCetuximab併用で抗腫瘍効果が良好な傾向を認めた。
(レポート:香川大学医学部 腫瘍内科 大北 仁裕)
References
1) Loupakis F, et al.: N Engl J Med. 371(17): 1609-1618, 2014[PubMed]
2) Geissler M, et al.: ESMO 2017 #475O[学会レポート]
3) Geissler M, et al.: ASCO 2018 #3509
4) Uetake H, et al.: ASCO-GI 2018 #734[学会レポート][UMIN-CTR]
5) RAS野生型進行大腸癌患者におけるFOLFOXIRI+セツキシマブとFOLFOXIRI+ベバシズマブの最大腫瘍縮小率(DpR)を検討する無作為化第II相臨床試験[UMIN-CTR]
6) Ychou M, et al.: ASCO 2016 #3512

監修
谷口 浩也先生
愛知県がんセンター中央病院
薬物療法部 医長
加藤 健先生
国立がん研究センター中央病院
消化管内科 医長
山﨑 健太郎先生
静岡県立静岡がんセンター
消化器内科 医長
上野 誠先生
神奈川県立がんセンター
消化器内科 医長
レポーター (50音順)
伊澤 直樹先生
聖マリアンナ医科大学
臨床腫瘍学
大北 仁裕先生
香川大学医学部
腫瘍内科
小林 智先生
神奈川県立がんセンター
消化器内科
佐藤 雄哉先生
国立がん研究センター中央病院
臨床研究支援部門
高橋 直樹先生
埼玉県立がんセンター
消化器内科
寺島 健志先生
金沢大学
先進予防医学研究センター
古田 光寛先生
静岡がんセンター
消化器内科
堀田 洋介先生
埼玉医科大学国際医療センター
消化器腫瘍科