2018年1月18日~20日に米国サンフランシスコにて開催された2018年 消化器癌シンポジウム(2018 Gastrointestinal Cancers Symposium)より、大腸癌や胃癌、肝細胞癌などの注目演題のレポートをお届けします。演題レポートの冒頭には“Expert's view”として、臨床研究の第一線で活躍する監修ドクターのコメントを掲載しています。
大腸癌
切除不適な大腸癌肝限局転移例に対するmFOLFOX6+Bevacizumab療法とmFOLFOX6+Cetuximab療法の無作為化第II相臨床試験-ATOM試験-
A randomized phase II study of mFOLFOX6 plus bevacizumab versus mFOLFOX6 plus cetuximab for previously untreated, liver-limited metastatic colorectal cancer that is unsuitable for resection (ATOM trial)
Hiroyuki Uetake, et al.
Expert’s view

谷口 浩也先生
愛知県がんセンター中央病院 薬物療法部 医長
RAS野生型の切除不能大腸癌肝限局転移例に対するmFOLFOX6+Bevacizumab(Bmab)vs. mFOLFOX6+Cetuximab(Cmab)の世界初の直接比較試験である。本試験の対象例はconversionによる治癒を目指すのが治療目標のひとつである。過去に、Bmab療法(BOXER試験1)、OLIVIA試験2))、Cmab療法(CELIM試験3))それぞれの第II相試験は複数報告されている。しかし、切除不能(不適)肝転移の基準が試験毎に異なること、また肝転移切除基準の施設間差も大きいことから、本邦での直接比較試験である本試験の結果が注目されていた。
主要評価項目のPFSおよび重要なエンドポイントである肝転移切除率は両群に明らかな差を認めなかったことから、Bmab、Cmabともに治療選択肢として残ったと言える。早期腫瘍縮小率や8週間後の腫瘍縮小率はCmab群が良好であったが、その傾向が肝転移切除率には反映されなかった。Bmabは腫瘍サイズ縮小だけでなく、いわゆる形態学的奏効(morphologic response)も抗腫瘍効果のひとつとされている点が影響したのかもしれない。サブグループ解析では、肝転移個数4個以下でCmabの優位性が示唆された。本試験の適格基準から肝転移個数4個以下の集団は、腫瘍径が5cm以上のものが多く含まれていると考えられ、大きな転移巣がある集団では腫瘍縮小率の高いCmabのほうが適しているのかもしれない。今後、病理学的奏効に関する解析やOS結果などさらなる解析が進むにつれ、さらに抗VEGF薬と抗EGFR薬の治療選択のヒントが出てくることを期待したい。
(コメント・監修:愛知県がんセンター中央病院 薬物療法部 医長 谷口 浩也)
大腸癌肝限局転移例に対する抗VEGF薬 vs. 抗EGFR薬
RAS野生型の切除不能大腸癌に対する初回治療として抗VEGF薬と抗EGFR薬のどちらが有用か、については未だ結論が出ていない。また、最近の報告では、原発巣部位を考慮に入れた治療選択が提案されつつある。治療前に切除不能であった大腸癌肝転移が、化学療法により切除可能となり、根治切除が実施された例では5年生存率33%と報告されている4)。本試験は、切除不能の大腸癌肝限局転移例を対象に、mFOLFOX6+Bevacizumab療法とmFOLFOX6+Cetuximab療法を比較した、初めての報告である。
本邦で実施された多施設共同無作為化第II相試験
RAS野生型大腸癌肝限局転移(H2-3、技術的に切除困難)症例を対象に合計120例(片群60例)を、mFOLFOX6をベースにBevacizumab併用(Bmab)、もしくはCetuximab併用(Cmab)を無作為に割り付けした。主要評価項目は、無増悪生存期間(PFS)であった。
主な患者選択基準は、以下のとおりである。(1)大腸癌(腺癌)、(2)RAS野生型、(3)同時性あるいは異時性の初発肝限局転移であり、肝以外の遠隔転移・再発の併存、既往がない。(4)継続的評価が可能な画像診断(造影CTもしくは造影肝MRI)にて、長径1cm以上のRECIST v1.1測定病変を1個以上もつ症例で、次の①~⑤のいずれかに該当すること。①肝転移巣が5個以上、②肝転移巣の最大径が5cmを超えている、③残存する肝組織の機能に基づいて、技術的に切除不可能、④すべての肝静脈または下大静脈への浸潤が認められる、⑤左右の肝動脈、もしくは左右の門脈への浸潤が認められる。
PFSや肝転移切除率は両群差を認めず
2013年5月から2016年4月までに122人が登録された。適格基準を満たした116人(Bmab群57人、Cmab群59人)が解析された。
患者背景である年齢、性別、ECOG PS、補助化学療法の実施歴、Oxaliplatinの既治療歴、原発巣部位、同時性または異時性、肝転移個数、肝転移腫瘍径に両群差を認めなかった。
主要評価項目であるPFSは、中央値Bmab群11.5ヵ月(9.2~13.3ヵ月)、Cmab群で14.8ヵ月(9.7~17.3ヵ月)であり差を認めなかった[HR=0.803(95% CI: 0.513-1.256)、p=0.3333](図1)。
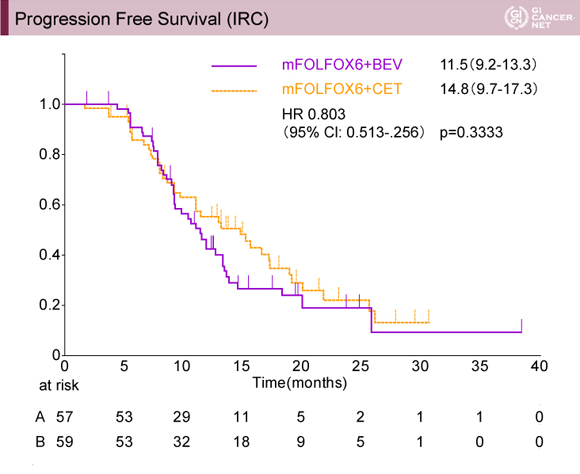
発表者の許可を得て掲載(approved by Hiroyuki Uetake)
副次評価項目であるoverall response rate(ORR)は、Bmab群68.4%、Cmab群84.7%であり、Cmab群が良好であった(p=0.0483)。また、8週間後の腫瘍縮小率もBmab群25.3%、Cmab群37.8%であり、Cmab群が良好であった(p<0.001)。肝転移切除術率はBmab群56.1%、Cmab群49.2%であり、両群に差は認めなかった。全生存期間についてはまだ観察期間が十分ではないが、今回の発表ではHR=0.827(95% CI: 0.437-1.564)と両群に差は認めなかった(p=0.5576)。
PFSについてのサブグループ解析では、肝転移個数4個以下ではCmab群が良好(HR=0.26、95% CI: 0.08-0.81)であった(図2)。
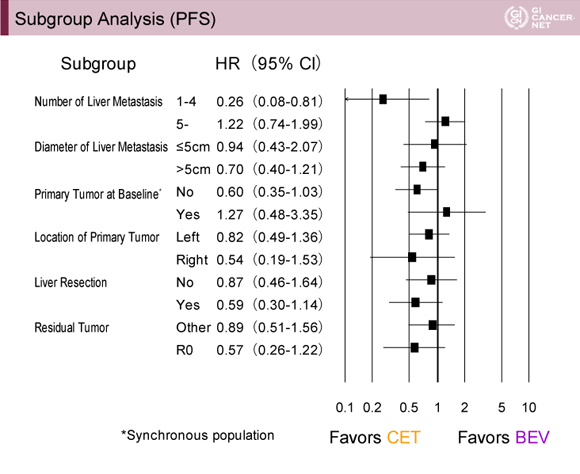
発表者の許可を得て掲載(approved by Hiroyuki Uetake)
一方、肝転移個数5個以上では、Bmab群がやや良好な傾向にあった(HR=1.22、95% CI: 0.74-1.99)(図2)。
両レジメンとも肝限局転移症例での治療選択肢
両方のレジメンは、ともに高い奏効率と肝切除率を示した。肝切除困難な肝限局転移症例に対する、mFOLFOX6+BevacizumabおよびmFOLFOX6+Cetuximab療法は同程度の有効性であった。
(レポート:関西ろうさい病院 下部消化器外科 副部長 賀川 義規)

監修・レポーター
監修
谷口 浩也先生
愛知県がんセンター中央病院 薬物療法部 医長
レポーター
賀川 義規先生
関西ろうさい病院 下部消化器外科 副部長
#745
監修
山﨑 健太郎先生
静岡県立静岡がんセンター 消化器内科 医長
レポーター
山本 祥之先生
筑波大学附属病院 消化器内科 病院講師
#557
監修
上野 誠先生
神奈川県立がんセンター 消化器内科 医長
レポーター
高橋 秀明先生
国立がん研究センター東病院 肝胆膵内科 医員
#207