進行性・転移性固形癌を対象とするRegorafenib(REG)とNivolumab(Nivo)の併用療法第Ib相臨床試験(REGONIVO試験)
Regorafenib plus nivolumab in patients with advanced gastric (GC) or colorectal cancer (CRC): an open-label, dose-finding, and dose-expansion phase 1b trial (REGONIVO, EPOC1603)
Shota Fukuoka, et al.
監修コメント

山﨑 健太郎先生
静岡県立静岡がんセンター 消化器内科 医長
近年、癌免疫療法の進歩が著しく、抗PD-1(programmed cell death 1)/PD-L1(programmed cell death ligand 1)抗体や抗CTLA-4(cytotoxic T-lymphocyte-associated protein 4)抗体薬などの免疫チェックポイント阻害薬(ICI)は多くの癌種において開発が行われ、臨床導入されている。
切除不能進行・再発胃癌に対し3次治療以降として抗PD-1抗体のNivolumab(Nivo)とプラセボを比較する第III相試験(ATTRACTION-2試験)1)が行われ、この結果に基づき2017年9月にNivoの適応が「がん化学療法後に増悪した治癒切除不能な進行・再発の胃癌」にも拡大されたが、他癌種と比較しその効果は限定的である。また大腸癌においては抗PD-1抗体薬の効果を検討した第I相試験の結果2-5)、マイクロサテライト不安定性(microsatellite instability-high: MSI-H)症例では高い効果が得られる可能性が示唆され、第II相試験において大腸癌を含むMSI-H固形癌に対するPembrolizumabの有効性が示されたことから、2018年12月に「がん化学療法後に増悪した進行・再発のMSI-Highを有する固形癌(標準的な治療が困難な場合に限る)」へ適応拡大されたが、マイクロサテライト安定性(microsatellite stable: MSS)/MSI-Low大腸癌では効果が期待できない。現在、胃癌のようにICIの有効性が示された症例に対しては有効性をさらに高めるために、またMSS/MSI-Low大腸癌のようにICIの効果が期待できない対象に対してその恩恵が得られようにするために、効果予測因子の同定や併用療法の開発が積極的に行われている。
本試験ではMSI-H 1例以外はMSS症例であったが、胃癌、大腸癌両癌種においてRegorafenib(REG)とNivoの併用療法による高い抗腫瘍効果が示された。大腸癌におけるREGの有効性を検証したCORRECT試験6)や、胃癌に対するNivoの有効性を検証したATTRACTION-2試験の結果1)と間接的に比較しても本併用療法による有効性の上乗せが期待されるが、あくまでも第I相試験の結果であること、またREGの最大耐量(maximum tolerated dose: MTD)および推奨用量(recommended dose: RD)が120mg/日と推定されたものの、拡大パートは有害事象に伴い80mg/日に減量されたように、有効性、安全性ともにさらなる検証は必要である。現在実施されているバイオマーカー解析も含め本併用療法のさらなる発展を期待したい。
(静岡県立静岡がんセンター 消化器内科 医長 山﨑 健太郎)
抗PD-1/PD-L1抗体薬耐性機序克服へ向けた研究
制御性T細胞または腫瘍関連マクロファージなどの免疫抑制細胞は、抗PD-1(programmed cell death 1)/PD-L1(programmed cell death ligand 1)阻害薬に対する耐性を誘導することが報告されている。マルチキナーゼ阻害薬であるRegorafenib(REG)は腫瘍関連マクロファージを減少させることがマウスモデルで示されており7)、実際、REGと抗PD-1抗体薬を併用することにより、単剤投与と比較し、より高い抗腫瘍効果が示された7)。
本試験は、進行胃癌・大腸癌患者を対象としたREGとNivolumab(Nivo)併用療法の第Ib相試験である。
REG+Nivo療法における推奨用量(recommended dose: RD)/最大耐量(maximum tolerated dose: MTD)推定のための用量制限毒性(dose-limiting toxicity: DLT)を評価
本試験の主な適格基準は、ECOG PS(performance status)0-1、評価および測定可能病変を有する(RECIST ver1.1)、REGおよびNivoの投与歴がない、標準治療不応・不耐の切除不能進行・再発胃癌および大腸癌で、試験は用量漸増パートと拡大パートに分けて行われた。
主要評価項目は、Nivo併用下のREGの推奨用量(RD)/最大耐量(MTD)推定のための用量制限毒性(DLT)評価とされた。また、奏効割合(ORR)、無増悪生存期間(PFS)、全生存期間(OS)、病勢コントロール割合(DCR)が副次評価項目に設定された。
胃癌および大腸癌において、REG+Nivo療法の良好な抗腫瘍効果が示された
用量漸増パートには、14例(胃癌:9例、大腸癌:5例)、拡大パートには36例(胃癌:16例、大腸癌:20例)が登録された。用量漸増パートの1例(大腸癌)がMSI-H症例であったが、その他49例はMSSであった(表1)。
用量漸増パートにおいて、REG 160mg/日で3例(皮疹、肺炎、結腸穿孔、各1例)のDLTを認め、Nivo併用時のREGのRD/MTDは120mg/日と決定された。しかし、拡大パートにおいて、Grade 3の皮膚障害を高頻度に認めたため(皮膚障害Grade 3 20%/120mg、0%/80mg)REGの用量は80mg/日に減量された(表2)。
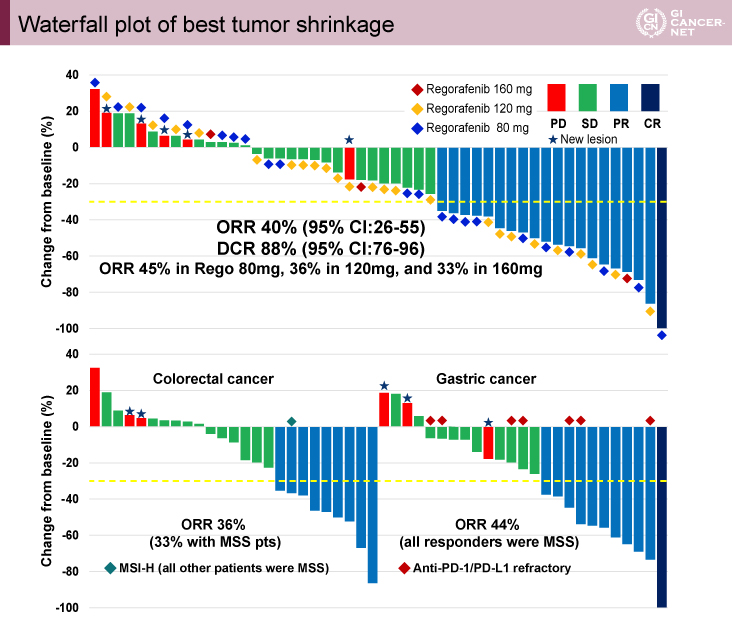
用量漸増パート、拡大パートを合わせた解析では、ORR 40%(95% CI: 26-55)、DCR 88%(95% CI: 76-96)であった(図1)。癌種別ORRは、大腸癌で36%(MSS 24例では33%)、胃癌44%であった。PFS中央値は全患者で6.3ヵ月(95% CI: 3.4-9.3、大腸癌:6.3ヵ月、胃癌:5.8ヵ月)であった。
さらに、胃癌患者9例における治療前後の生検検体のフローサイトメトリー分析では、奏効が得られた症例(4例)では全例に腫瘍浸潤している制御性T細胞の減少傾向を認めた。
表1 Patient characteristics(発表者の許可を得て掲載)
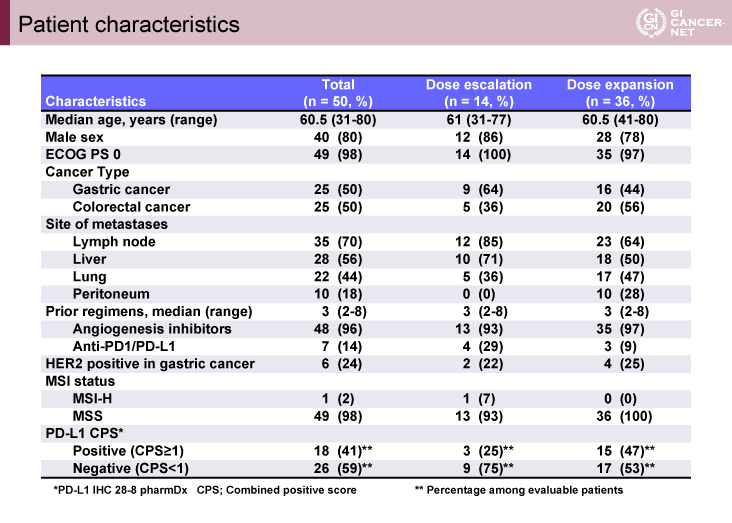
表2 Treatment-Related AE (≧10%)(発表者の許可を得て掲載)
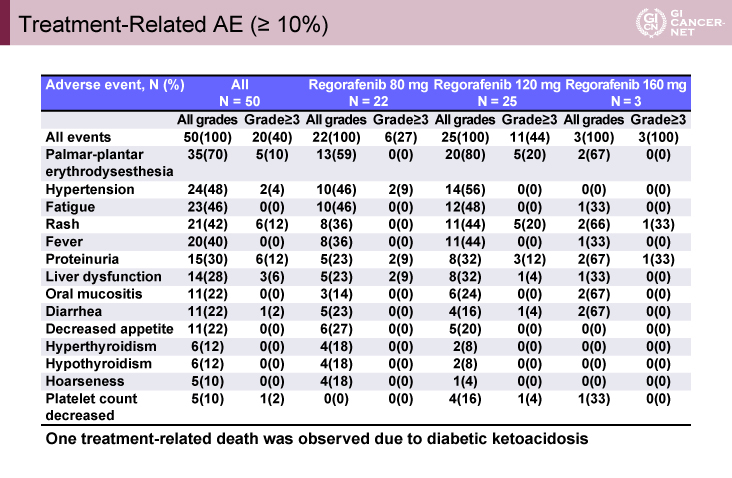
図1 Waterfall plot of best tumor shrinkage(発表者の許可を得て掲載)
まとめ
Nivo併用下でのREGの至適用量は80mg/日であり、同用量の忍容性は良好で有望な抗腫瘍効果が示された。今後、大規模コホートにおけるさらなる検証が必要である。
(レポート:国立がん研究センター東病院 消化管内科 三島 沙織)
References
1) Kang YK, et al.: Lancet. 390(10111): 2461-2471, 2017[PubMed]
2) Topalian SL, et al.: N Engl J Med. 366(26): 2443-2454, 2012[PubMed]
3) Brahmer JR, et al.: J Clin Oncol. 28(19): 3167-3175, 2010[PubMed]
4) Lipson EJ, et al.: Clin Cancer Res. 19(2): 462-468, 2013[PubMed]
5) Le DT, et al.: N Engl J Med. 372(26): 2509-2520, 2015[PubMed]
6) Grothey A, et al.: Lancet. 381(9863): 303-312, 2013[PubMed]
7) Hoff S, et al.: Ann Oncol. 28(suppl_5): abstr 1198P, 2017[Annals of Oncology]
関連サイト
・REGONIVO(EPOC1603)[ClinicalTrials.gov]
・ATTRACTION-2試験[ClinicalTrials.gov][論文紹介][学会レポート]

監修
谷口 浩也先生
国立がん研究センター東病院
消化管内科 医長
加藤 健先生
国立がん研究センター中央病院
消化管内科 医長
山﨑 健太郎先生
静岡県立静岡がんセンター
消化器内科 医長
寺島 健志先生
金沢大学先進予防医学研究センター
特任准教授
レポーター (50音順)
井上 博登先生
静岡がんセンター
消化器内科
大隅 寛木先生
がん研有明病院
消化器化学療法科
緒方 貴次先生
神戸市立医療センター中央市民病院
腫瘍内科
尾阪 将人先生
がん研有明病院
肝・胆・膵内科
川本 泰之先生
北海道大学病院
消化器内科
林 秀幸先生
慶應義塾大学病院
腫瘍センター
深堀 理先生
久留米大学病院
がん集学治療センター
三島 沙織先生
国立がん研究センター東病院
消化管内科