末梢血循環腫瘍細胞(CTC)≧3のRAS野生型切除不能進行・再発大腸癌(mCRC)における一次治療を比較した(FOLFOX+Bevacizumab療法vs. FOLFOXIRI+Bevacizumab療法)第III相無作為化試験(VISNU 1試験)
Randomized phase III study comparing FOLFOX+BEV vs FOLFOXIRI+BEV as 1st line treatment in patients with mCRC with metastatic colorectal cancer with ≧ 3 baseline circulating tumor cells (The VISNU 1 trial)
Javier Sastre, et al.
監修コメント

山﨑 健太郎先生
静岡県立静岡がんセンター 消化器内科 医長
TRIBE試験においてFOLFOXIRI[Fluorouracil(5-FU)+Leucovorin(LV)+Irinotecan(IRI)+Oxaliplatin(OX)]+Bevacizumab(Bmab)療法の有効性が検証されて以降、多くの臨床試験において同療法の有効性が報告され、標準治療のひとつとして世界的なコンセンサスが得られるようになった。また、最近ではFOLFOXIRI+抗EGFR抗体薬併用療法についても有望な結果が報告されている(VOLFI試験)。一方、doublet+分子標的治療薬と比較し有害事象の発現頻度が高いことは明らかであり、この従来の治療と比較し、有効ではあるものの安全性について懸念のある本療法の適切な対象を選定することが、実地臨床では必要になっている。
そのような背景のもと、予後不良とされる末梢血循環腫瘍細胞(circulating tumor cells: CTC)≧3のRAS野生型切除不能進行・再発大腸癌(metastatic colorectal cancer: mCRC)初回治療例に限定して、FOLFOXIRI+Bmab療法の有効性を検証した本試験の結果は、あらためて本療法の可能性を示したものと考える。一方、本年のASCOで報告されたTRIBE2試験では、現在実地診療で入手可能な予後不良因子である右側原発、RAS変異、BRAF変異が多く登録されたなか、FOLFOXIRI+Bmab療法の有用性が検証された。本VISNU 1試験は予後不良とされるCTC≧3を対象としているが、右側原発例は20%台、RAS変異は約50%、BRAF変異は約10%と一般的な分布と大きく変わらないことから、CTC≧3がこれらの予後不良因子と独立した因子であれば、本療法によるbenefitが得られる対象を広げつつさらなる最適化につながる可能性もあり、今後TRIBE試験など他試験との統合解析を含めた検討を期待したい。
(静岡県立静岡がんセンター 消化器内科 医長 山﨑 健太郎)
予後不良因子の末梢血循環腫瘍細胞(circulating tumor cells: CTC)≧3患者を対象に、FOLFOXIRI+Bmab療法の有効性を検証
TRIBE試験により、FOLFOXIRI[Fluorouracil(5-FU)+Leucovorin(LV)+Irinotecan(IRI)+Oxaliplatin(OX)]+Bevacizumab(Bmab)療法のFOLFIRI(5-FU+LV+IRI)+Bmab療法に対する抗腫瘍効果における優越性が示され1)、各国のガイドラインで一次治療の選択肢のひとつとして推奨されている。特に予後不良であるBRAF変異型に対しては、本邦の大腸癌治療ガイドライン(医師用2019年版)や、ESMOガイドラインをアジア人に適合させた汎アジアのコンセンサス・ガイドラインなどで第一選択レジメンとして記載されている。
一方、TRIBE試験のサブグループ解析により、左側大腸癌に対するFOLFOXIRI+Bmab療法の有効性は限定的であることが示唆され2)、またFOLFOXIRI+Bmab療法は発熱性好中球減少症(8.8%)を始めとした有害事象発現の頻度が高くなることから1)、本療法が真に対象となる症例を絞り込むことが重要である。
末梢血循環腫瘍細胞(CTC)は予後との関連が示されており、CTC≧3は予後不良因子として報告されている3-5)。本試験は、予後不良とされるCTC≧3の症例に対するFOLFOXIRI+Bmab療法の有効性を検証する試験である。安全性についてはASCO 2018で報告されており、今回は主に主要評価項目などの有効性に関する結果が報告された。
主要評価項目は無増悪生存期間(progression-free survival: PFS)
本試験の対象は70歳以下で、ECOG PS(performance status)0-1、層別化因子としてKRAS exon2ステータス、臓器転移個数が設定された。主要評価項目はPFS、副次評価項目は、全生存期間(OS)、奏効割合(ORR)、切除率、安全性が評価された。
FOLFOXIRI+Bmab療法の対照群としてFOLFOX+Bmab療法が設定されており、それぞれ2週間を1サイクルの投与とした。FOLFOXIRI+Bmab療法群では、Bmab 5mg/kg、IRI 165mg/m2、OX 85mg/m2、LV 400mg/m2をいずれもday 1に投与、5-FU 3,200mg/m2をday 1に投与後は2週間おきに48時間持続静注した。FOLFOX+Bmab療法群では、Bmab 5mg/kg、OX 85mg/m2、LV 400mg/m2、5-FU 400mg/m2急速静注をいずれもday 1に投与、5-FU 2,400mg/m2を2週間おきに46時間持続静注投与した。いずれの療法においても、病勢進行(PD)もしくは副作用が許容できなくなるまで投与を継続した。
統計学的設定として、PFS中央値がFOLFOX+Bmab療法群の8ヵ月からFOLFOXIRI+Bmab療法群の11.2ヵ月に延長することを期待し[ハザード比(HR=0.71)]、検出率80%、両側α=0.05で280イベントが必要とされ、目標症例数は350例(各群175例)と計画された。
なお、63例が登録されたのちにプロトコル改訂が行われ、FOLFOXIRI+Bmab療法群での顆粒球コロニー形成刺激因子製剤(G-CSF製剤)の予防的投与が推奨された。
PFSにおいて、FOLFOXIRI+Bmab療法のFOLFOX+Bmab療法に対する優越性が示された
2012年10月から2016年11月に1,252例がスクリーニングを受け、1,208例でCTCと分子マーカーの測定が行われた。CTC≧3が487例に認められ、349例が本試験に登録された。最終的に、FOLFOXIRI+Bmab療法群に177例、FOLFOX+Bmab療法群に172例が割り付けられた。患者背景は両群に有意差を認めなかった。
原発巣は右側原発がFOLFOXIRI+Bmab療法群48例(28.0%)vs. FOLFOX+Bmab療法群で39例(22.0%)であり(以下同順)、左側原発が119例(69.2%)vs. 137例(77.4%)であった。臓器転移として肝転移単独が62例(36.0%)vs. 62例(35.0%)であった。化学療法の投与歴ありは9例(5.2%)vs. 7例(3.9%)であった。分子生物学的プロファイルについてはRAS変異型が85例(49.4%)vs. 84例(47.5%)、BRAF変異型が17例(9.6%)vs. 16例(9.3%)であった。
主要評価項目であるPFS中央値は、FOLFOXIRI+Bmab療法群で12.4ヵ月、FOLFOX+Bmab療法群で9.3ヵ月[HR=0.64、95%信頼区間(CI):0.49-0.82、p=0.0006]であり、FOLFOXIRI+Bmab療法群で有意な延長を示した(図1)。
サブグループ解析[年齢、PS、腫瘍占居部位、CTC(<20 vs. ≧20)、RAS、BRAF、転移臓器個数などによる]においても、FOLFOXIRI+Bmab療法群がPFSを延長する傾向にあった。特にRAS野生型ではHR=0.503(95% CI: 0.345-0.733)、BRAF野生型ではHR=0.613(95% CI: 0.465-0.807)であった(図2)。
多変量解析においても、FOLFOXIRI+Bmab療法群は有意にPFSを延長することを示した(HR=0.66、95% CI: 0.51-0.87、p=0.003)。
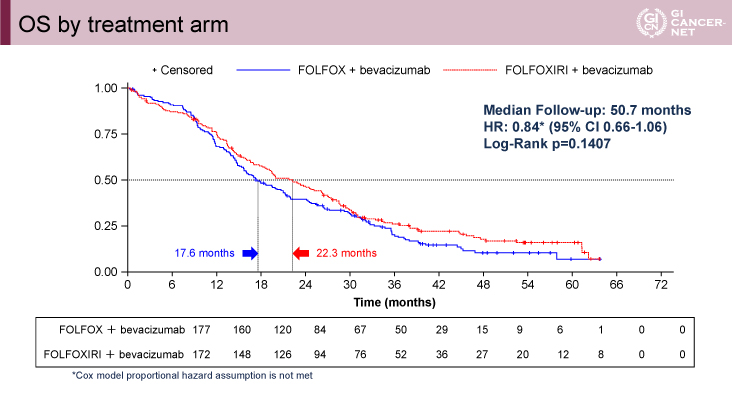
副次評価項目であるOS中央値は、FOLFOXIRI+Bmab療法群で22.3ヵ月vs. FOLFOX+Bmab療法群で17.6ヵ月(HR=0.84、95% CI: 0.66-1.06、p=0.1407)であった(以下同順)。二次治療移行率は69% vs. 73%、三次治療移行率は42% vs. 40%、四次治療移行率は20% vs. 15%であった(図3)。
ORRは、ITT解析では59.0% vs. 52.0%(p=0.1685)、評価可能症例における解析では69% vs. 57%(p=0.0381)であった。救済手術を施行された症例は31例(18.0%)vs. 33例(18.6%)であり、R0切除が施行できたのは12例(7%)vs. 14例(7.9%)であった。
Grade 3以上の有害事象は133例(78%)vs. 119例(67%)に認められた(p=0.022)。Grade 3以上の発熱性好中球減少症は16例(9%)vs. 4例(2%)(p=0.004)、倦怠感は27例(16%)vs. 12例(7%)(p=0.007)、下痢は35例(21%)vs. 10例(6%)(p<0.001)であった。
治療の投与サイクル中央値は13コースvs. 14コースで、治療延期は152例(89.4%)vs. 153例(86.4%)、減量を要した症例は109例(64.1%)vs. 95例(53.7%)であった。
図1 PFS by treatment arm(発表者の許可を得て掲載)
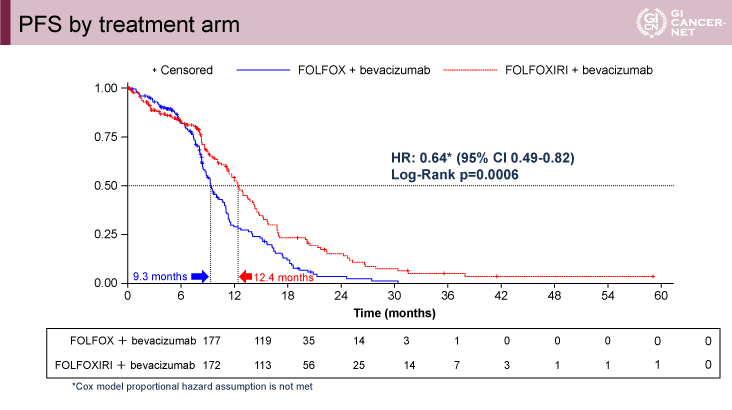
図2 PFS Subgroup analysis(発表者の許可を得て掲載)
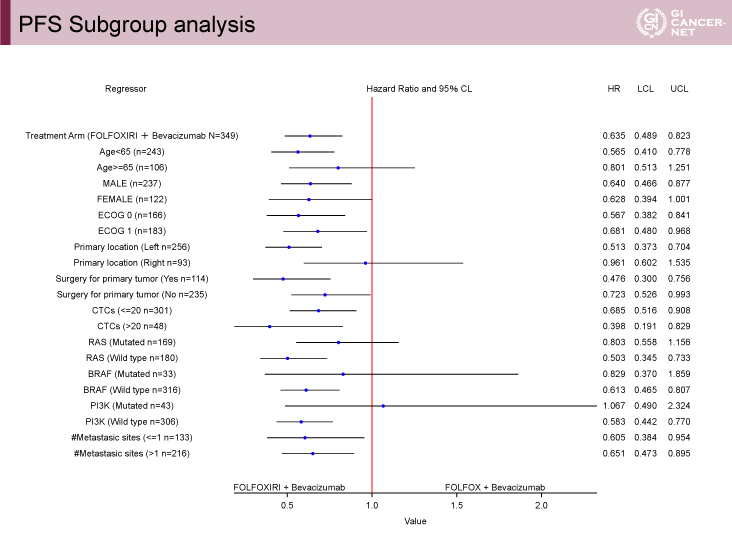
図3 OS by treatment arm(発表者の許可を得て掲載)
まとめ
CTC≧3 RAS野生型mCRCに対するFOLFOXIRI+Bmab療法群の有効性が示された。サブグループ解析の結果からRAS野生型、BRAF野生型に対して、より有効であることが示唆された。CTCによる治療選択の試験は本試験が初めてであり、今後追加検討が必要と考える。
(レポート:神戸市立医療センター中央市民病院 腫瘍内科 緒方 貴次)
References
1) Loupakis F, et al.: N Engl J Med. 371(17): 1609-1618, 2014[PubMed]
2) Cremolini C, et al.: Ann Oncol. April 20, 2018 [Epub ahead of print][PubMed]
3) Cohen SJ, et al.: J Clin Oncol. 26(19): 3213-3221, 2008[PubMed]
4) Sastre J, et al.: Oncologist. 17(7): 947-955, 2012[PubMed]
5) Tol J, et al.: Ann Oncol. 21(5): 1006-1012, 2010[PubMed]
関連サイト
・VISNU 1試験[ClinicalTrials.gov]
・TRIBE試験[ClinicalTrials.gov][学会レポート][論文紹介(2015)][論文紹介(2018)]
・VOLFI試験(AIO-KRK-0109試験)[ClinicalTrials.gov][学会レポート(ESMO 2017)][学会レポート(ESMO 2018)]
・TRIBE2試験[ClinicalTrials.gov][PubMed][学会レポート]

監修
谷口 浩也先生
国立がん研究センター東病院
消化管内科 医長
加藤 健先生
国立がん研究センター中央病院
消化管内科 医長
山﨑 健太郎先生
静岡県立静岡がんセンター
消化器内科 医長
寺島 健志先生
金沢大学先進予防医学研究センター
特任准教授
レポーター (50音順)
井上 博登先生
静岡がんセンター
消化器内科
大隅 寛木先生
がん研有明病院
消化器化学療法科
緒方 貴次先生
神戸市立医療センター中央市民病院
腫瘍内科
尾阪 将人先生
がん研有明病院
肝・胆・膵内科
川本 泰之先生
北海道大学病院
消化器内科
林 秀幸先生
慶應義塾大学病院
腫瘍センター
深堀 理先生
久留米大学病院
がん集学治療センター
三島 沙織先生
国立がん研究センター東病院
消化管内科