未治療の進行または転移性食道扁平上皮癌に対するCamrelizumab+化学療法と化学療法を比較した無作為化盲検第III相試験(ESCORT-1st試験)
ESCORT-1st: A randomized, double-blind, placebo-controlled, phase 3 trial of camrelizumab plus chemotherapy versus chemotherapy in patients with untreated advanced or metastatic esophageal squamous cell carcinoma (ESCC)
Rui-hua Xu, et al.
監修コメント
近年食道癌領域では、免疫チェックポイント阻害剤の新たなエビデンスの発表が相次いでいるが、昨年のESMOにおけるKEYNOTE-590(KN-590)に続き、今年のASCOでのCheckMate 648(CM-648)と同時に、中国国内で行われたESCORT-1st試験の結果が報告された。Camrelizumabは中国のHengrui Medicine社のPD-1抗体であり、すでにホジキンリンパ腫や、食道癌の2次治療において、承認が得られている。今回は中国における初回化学療法の標準治療であるタキサン系薬剤とプラチナ系薬剤の併用療法に対する上乗せ効果をみる試験として、ESCORT-1st試験が計画され、その結果が報告された。
約2年弱で600例もの患者が登録され、背景因子については両群でバランスが保たれていた。年齢やその他の背景因子については、グローバル試験であるKN-590や、CM-648と大きな差異はなく、CONSORTをみても、理由が不明な治療中止などが多いという傾向もない。PD-L1の評価は、独自の抗体である6E8抗体が用いられている。この抗体と28-8や、22C3などとの相関は不明であるが、PD-L1陽性1%以上の割合が約50%ということは、28-8抗体と同程度の陽性割合と推測された。
主要評価項目である、全体集団でのOSでは、HR 0.70と有意差をもって化学療法に対するCamrelizumabの上乗せ効果を示した。同じ対象でのHRは、KN-590では0.72、CM-648では0.74と同程度である。PD-L1陽性1%以上症例でのHRは不明であるが、forest plotから推測すると、HR 0.59程度で、こちらもその他の試験とほぼ同じとなっている。標準治療群のOS中央値は12ヵ月と、その他の試験よりも良好であり、その上で差を示している点は評価できる。後治療については言及がなかったため、どの程度チェックポイント阻害剤がクロスオーバーで化学療法群に入っているかは不明である。毒性についても特に特徴的な副作用はなく、Camrelizumabが入ることで若干増加するが、許容範囲であり、これも他の試験と同様である。
すでに中国からは、JUPITER-06試験(NCT03829969)の結果によりToripalimabが食道扁平上皮癌に対して初回化学療法に対する上乗せ効果があることが報告されている。また、中国BeiGene社のTislelizumabも、RATIONALE-306試験により、化学療法に対する上乗せを評価されている。Camrelizumabについては、食道扁平上皮癌における術前化学療法への併用効果を評価する第II相試験であるNIC-ESCC2019試験の結果もポスターで報告されており、この領域における、中国のプレゼンスが上昇していることがうかがえる。
(国立がん研究センター中央病院 頭頸部・食道内科 科長 加藤 健)
食道扁平上皮癌に対する化学療法
食道扁平上皮癌はアジアで多い組織型であり、特に中国では食道癌の90%にのぼり、世界の食道扁平上皮癌の半分以上が中国でみられる。
進行食道癌に対する1次化学療法として2剤併用化学療法が標準治療であり、中国では主にPaclitaxel+Cisplatinが使われているが、生存期間(OS)中央値は6.9ヵ月から13.0ヵ月と予後不良である。
CamrelizumabはPD-1に対するヒト化モノクローナル抗体であり、進行または転移性食道扁平上皮癌の2次治療において有望な抗腫瘍効果と許容可能な安全性を示した(ESCORT試験)1)。Camrelizumabと化学療法の比較において、OS中央値はそれぞれ8.3ヵ月vs. 6.2ヵ月、奏効割合(ORR)は20.2% vs. 6.4%、治療奏効期間(DoR)中央値は7.4ヵ月vs. 3.4ヵ月であり、この結果を受けて中国では食道扁平上皮癌の2次治療としてCamrelizumabが承認された。
ESCORT-1st試験は、進行または転移性食道扁平上皮癌の1次治療におけるCamrelizumab+化学療法と化学療法単独との有効性と安全性を比較する第III相試験である。
1次治療におけるCamrelizumabの上乗せ効果の検証
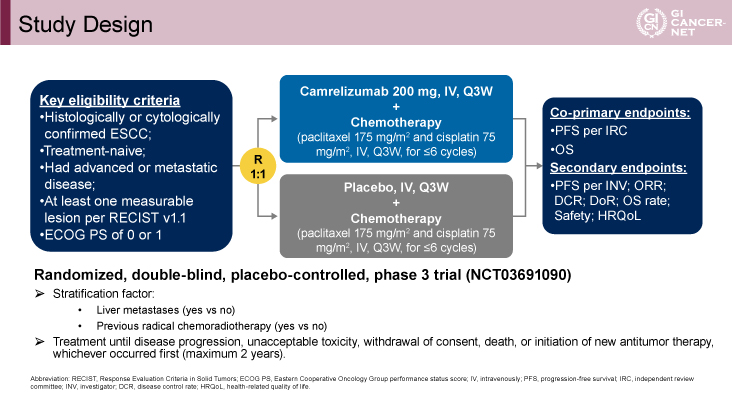
対象は、組織学的に確認された食道扁平上皮癌患者で、全身化学療法歴がない、進行または転移性病変を有する、ECOG PS 0または1、測定可能病変を1つ以上有することが適格基準とされた。肝転移の有無、根治的CRT歴の有無によって層別化された。
適格患者はCamrelizumab+化学療法群とプラセボ+化学療法群に1:1で無作為化され、day 1にCamrelizumab 200mgもしくはプラセボ、Paclitaxel(175mg/m2)、Cisplatin(75mg/m2)が静脈内投与され、3週間隔で施行された。Paclitaxel、Cisplatinは6サイクルまでの投与とされた。
主要評価項目には、独立審査委員会(independent review committee: IRC)によって評価された無増悪生存期間(PFS)とOSが設定された。副次的評価項目として、研究者評価のPFS、ORR、病勢コントロール率(DCR)、DoR、生存率、安全性および健康関連QOLが設定された(図1)。
図1 Study Design(発表者の許可を得て掲載)
OS、PFSにおいて化学療法に対するCamrelizumabの上乗せ効果が示された
中国の60施設において2018年12月から2020年5月まで症例登録が行われ、Camrelizumab群に298例、プラセボ群に298例、計596例が登録された。2020年10月のデータカットオフまでの追跡期間中央値は10.8ヵ月であった。表1に患者背景を示す。1%以上のPD-L1発現はCamrelizumab群で55.7%、プラセボ群で54.7%であった。
主要評価項目であるOSの中央値はCamrelizumab群で15.3ヵ月、プラセボ群で12.0ヵ月であり、Camrelizumab群で有意な改善を認めた[ハザード比(HR)=0.70、95% CI: 0.56-0.88、p=0.001](図2)。PFSの中央値はCamrelizumab群で6.9ヵ月、プラセボ群で5.6ヵ月とCamrelizumab群で有意に良好であった(HR=0.56、95% CI: 0.46-0.68、p<0.001)(図3)。OSとPFSのサブグループ解析では、Camrelizumab群においてほぼすべての項目で良好な傾向を認めた。
研究者評価のORRはCamrelizumab群で72.1%(95% CI: 66.7%-77.2%)、プラセボ群で62.1%(95% CI: 56.3%-67.6%)であり、DCRはそれぞれ91.3%(95% CI: 87.5%-94.2%)と88.9%(95% CI: 84.8%-92.3%)であった。DoR中央値はそれぞれ7.0ヵ月、4.6ヵ月であった(図4)。いずれもCamrelizumab群で良好な結果を示した。
治療関連有害事象(TRAEs)は、Camrelizumab群で99.3%、プラセボ群で97.0%に認め、そのうちgrade 3以上はそれぞれ63.4%、67.7%、治療関連死はそれぞれ3.0%と3.7%に認めた。Grade 3以上のTRAEsとして好中球減少、白血球減少、貧血が多く認められた。両群のTRAEsは類似していたが、reactive capillary endothelial proliferation(RCEP)はCamrelizumabに関連した有害事象であり約80%に認めた。
表1 Baseline Characteristics and prior therapy(発表者の許可を得て掲載)
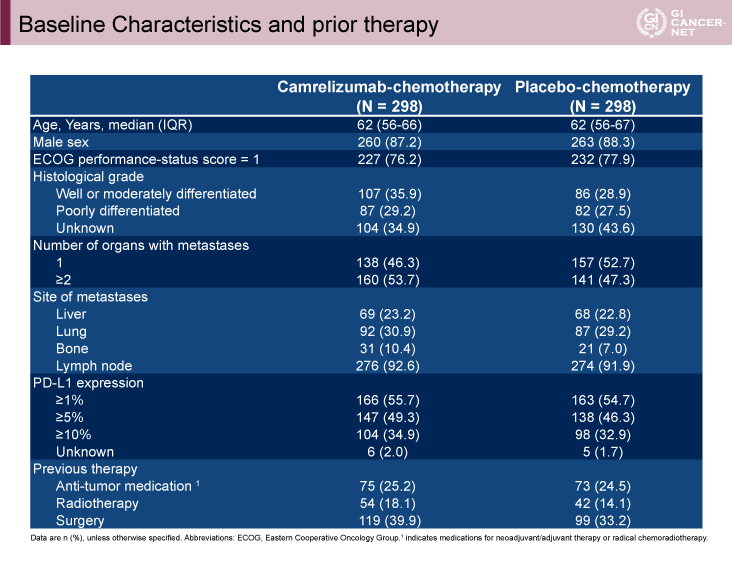
図2 OS(発表者の許可を得て掲載)
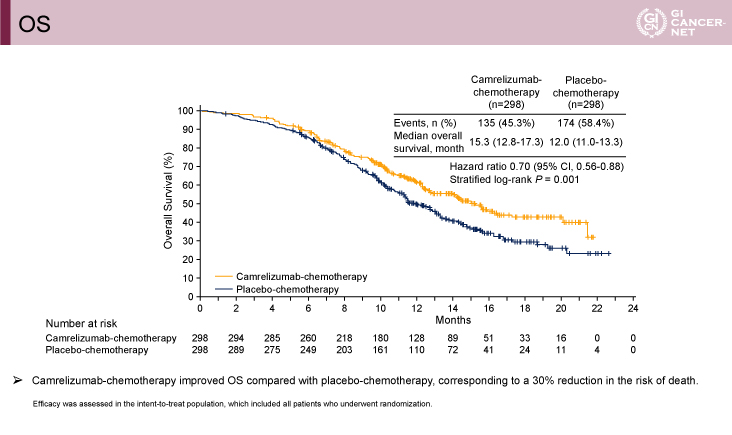
図3 PFS(per IRC)(発表者の許可を得て掲載)
.jpg)
図4 Tumor Response(per INV)(発表者の許可を得て掲載)
.jpg)
まとめ
Camrelizumab+化学療法は化学療法単独に比べてOS、PFSともに統計学的に有意な改善を認めた。安全面でも管理可能であり、新たな有害事象の報告はなかった。Camrelizumab+Paclitaxel+Cisplatin療法は進行または転移性食道扁平上皮癌の1次治療における新たな標準治療になりうる。
(レポート:千葉県がんセンター 治験臨床試験推進部 天沼 裕介)
Reference
1) Huang J, et al.: Lancet Oncol. 21(6): 832-842, 2020[PubMed]
関連サイト
・KEYNOTE-590試験[学会レポート][ClinicalTrials.gov]
・CheckMate 648試験[ClinicalTrials.gov]
・JUPITER-06試験[ClinicalTrials.gov][OncLive]
・RATIONALE-306試験[ClinicalTrials.gov]
・NIC-ESCC2019試験[ClinicalTrials.gov]
・ESCORT試験[ClinicalTrials.gov]
・ESCORT-1st試験[ClinicalTrials.gov]
加藤 健先生
国立がん研究センター中央病院 頭頸部・食道内科 科長