切除不能進行・再発食道扁平上皮癌に対する1次治療としてのNivolumab+IpilimumabまたはNivolumab+化学療法vs.化学療法:CheckMate 648試験結果の初回報告
Nivolumab plus ipilimumab or nivolumab plus chemotherapy versus chemotherapy as first-line treatment for advanced esophageal squamous cell carcinoma: first results of the CheckMate 648 study
Ian Chau, et al.
監修コメント
食道癌の初回治療に対する免疫チェックポイント阻害剤の有用性を検証した試験としては、昨年のESMO 2020にて報告されたKEYNOTE-590試験(KN-590)以来のものである。違いは、標準治療である5-FU+CDDPがKN-590では3週間毎で、それにPembrolizumab(Pem)が3週間毎に投与されていたのに対し、CheckMate 648試験(CM-648)では4週間毎であり、それにNivolumab(NIVO)が2週間毎に併用される投与法であることと、NIVOにCTLA-4抗体であるIpilimumab(IPI)を併用する治療群が設定されていたことである。また、KN-590は腺癌および扁平上皮癌ともに適格だったのに対して、CM-648は食道扁平上皮癌のみを対象とした。結果的にCM-648試験の報告は、多少遅くなったが、化学療法とNIVO併用化学療法の比較は、KN-590の扁平上皮癌コホートの結果を再現するものとなった。厳密にはPD-L1の陽性の規準は、KN-590のCPS 10と、CM-648のTPS 1は異なるが、陽性集団の割合は両試験とも約50%、そしてHRもほぼ同等と、改めて食道扁平上皮癌における免疫チェックポイント阻害剤の効果を確認できるものとなった。
CM-648の主要評価項目では腫瘍細胞におけるPD-L1陽性(TPS 1)集団における、chemo群に対する、NIVO+chemo群および、NIVO+IPI群の生存期間の延長が示されたが、全体集団においての優越性も証明された。NIVO+chemo群のTPS 1集団が0.54に対して、全体集団が0.74、NIVO+IPI群のTPS 1集団が0.64に対して、全体集団が0.78と、enrichした集団のほうがより効果的であるが、全体集団としても、統計学的に有意かつ、臨床的にも意味のある差が示されたと考えられる。
また、PFSをみると、免疫チェックポイント阻害剤の試験でありがちな、早期のPD(early drop)はchemoを併用することにより、防ぐことができており、PFSのK-M曲線はクロスしていない。一方で、NIVO+IPI群では、chemoを併用していない他の試験と同様に、クロスしており、一部の腫瘍では、治療効果が発揮されるまでに時間がかかることが示されている。NIVO+IPI群ではPFSはchemo群に対して優越性を示しておらず、PD後に行われた後治療において、最終的なOSが延長していることが示唆されている。後治療はすべての群において、約50%の患者に行われており、chemo群では16%に免疫チェックポイント阻害剤が用いられている。後治療も含めた全体の治療において、NIVO+chemoあるいはNIVO+IPIから開始すると、OSが延長したと解釈できる。
この課題には、大きく2つのディスカッションポイントがある。1つ目は「ポジティブとなった2つの治療群の使い分けはどうするのか?」ということ、2つ目は「TPSにより患者選択を行う必要があるのか?」ということである。1つ目については、NIVO+chemo群とNIVO+IPI群は、OS中央値、2年生存割合など同等であるが、唯一、治療効果持続期間(DOR)のみ、NIVO+IPI群で優れている。免疫チェックポイント阻害剤特有の、効果がある症例は長く続くということであり、chemoなしで、この有効性が得られる可能性があることがNIVO+IPI群の魅力である。一方で、NIVO+chemo群においては、PD割合は30%となっており、NIVO+IPIにより効果がない場合には速やかに次治療に移ることが重要である。そのようなことを加味すると、NIVO+IPIを行う患者像は、腫瘍が増大しても、PSが落ちずに次治療を実施することができる、比較的腫瘍量の少ない症例、無症候性の症例、リンパ節転移例、TPS陽性例など、比較的免疫チェックポイント阻害剤の効果が期待できる症例が考えられる。
TPSによる患者選択が必要かという疑問については、議論が必要である。サブグループ解析をみると、TPS 1以下の集団におけるOSのHRは、NIVO+chemo群で0.98、NIVO+IPI群で0.96といずれも不良である。逆転をしているわけではないので、最初から投与してもよいという考え方もあるが、むしろ、後治療としてしっかりと免疫チェックポイント阻害剤を入れたほうが、より効果的である可能性もある。このあたりについては、適応後に全体の戦略をみるような臨床試験において、評価されるべき臨床的疑問であると考える。
いずれにしても、食道癌化学療法において、さらなる進歩が得られ、これに伴い2次治療後の戦略も変わってくる。現在周術期化学療法においても、免疫チェックポイント阻害剤が検討されており、今後もダイナミックな変化が得られることを期待したい。
(国立がん研究センター中央病院 頭頸部・食道内科 科長 加藤 健)
食道扁平上皮癌の1次治療におけるNivolumabを含む新規治療の可能性
遠隔転移を有する食道癌は予後不良な疾患であり、世界中で年間50万人が食道癌により死亡しており、その中でも約85%を食道扁平上皮癌が占めている1,2)。緩和的化学療法(chemo)は切除不能進行・再発食道扁平上皮癌の予後を改善させてきたが、全生存期間(OS)中央値は1年未満である3-9)。そのような中、ATTRACTION-3試験において食道扁平上皮癌の2次治療としてタキサン系薬剤と比較しNivolumab(NIVO)の有効性が証明され10)、NIVOが標準治療として確立された。CheckMate 648試験は、切除不能進行・再発食道扁平上皮癌に対する1次治療としてのCisplatinと5-FU併用(CF)療法を対照として、NIVOとIpilimumab(IPI)(NIVO+IPI)療法、またはNIVOとCF(NIVO+chemo)療法の有効性と安全性を検証した3群の第III相試験であり、本試験結果はその初回報告である。
食道扁平上皮癌の1次治療におけるNIVOの上乗せ、免疫チェックポイント阻害剤2剤併用療法の有効性の検証
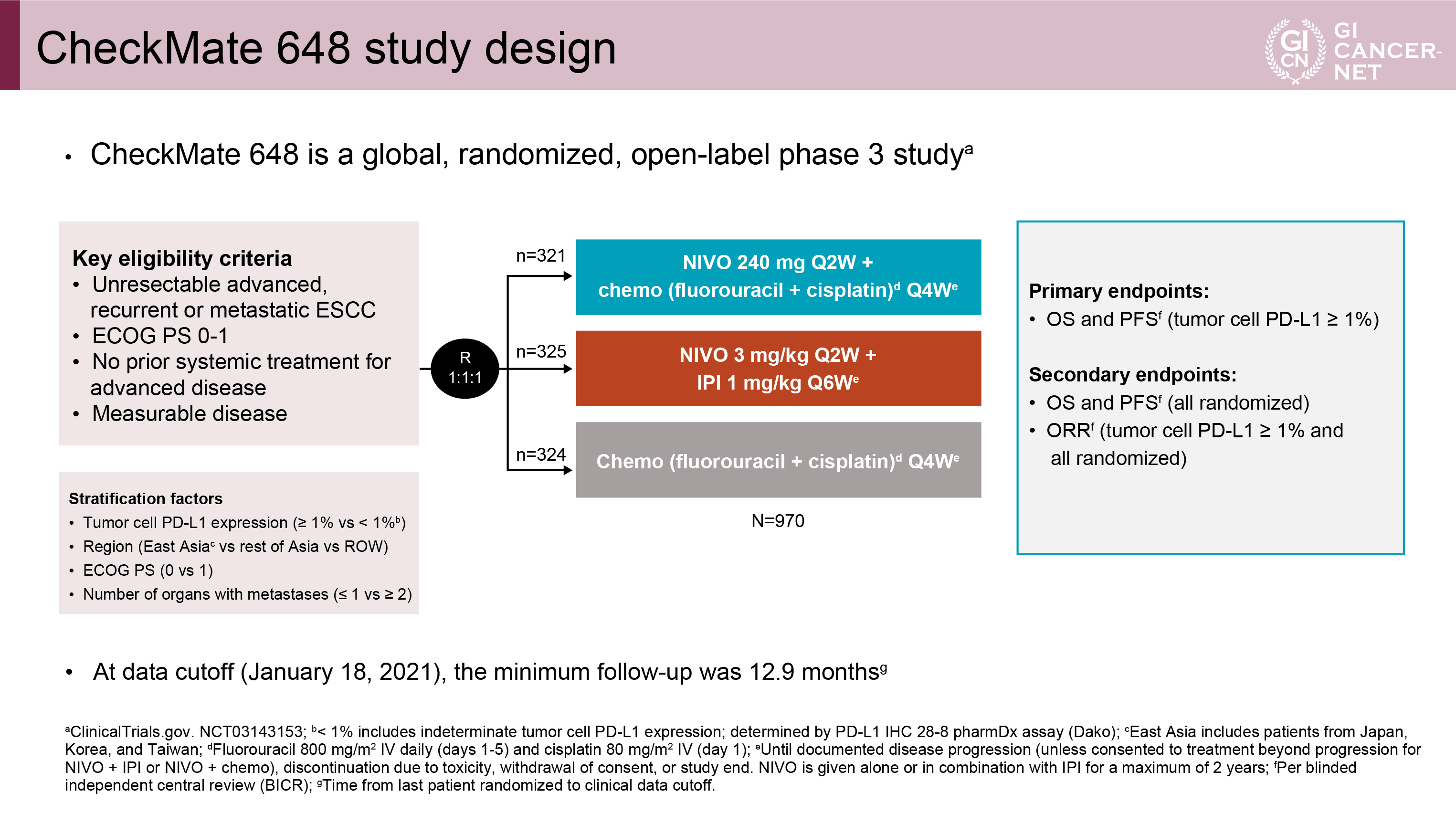
本試験の主な適格基準は、①未治療の切除不能進行・再発食道扁平上皮癌、②Eastern Cooperative Oncology Group Performance Status(ECOG PS)が0-1、③前治療歴なし、④測定可能病変があることであった(図1)。試験群の治療は、NIVO+chemo療法[Nivolumab: 240mg/bodyを2週間毎、Fluorouracil: 800mg/m2 IV daily(day 1-5)とCisplatin: 80mg/m2 IV(day 1)を4週間毎]とNIVO+IPI療法(Nivolumab: 3mg/kgを2週間毎、Ipilimumab: 1mg/kgを6週間毎)で、対照群の治療はchemo[Fluorouracil: 800mg/m2 IV daily(day 1-5)とCisplatin: 80mg/m2 IV(day 1)を4週間毎]であった。970例が各群へ1:1:1(321例、325例、324例)で無作為に割り付けられた。層別化因子は、腫瘍細胞におけるPD-L1発現率(≧1% vs. <1%)、地域(東アジアvs. その他のアジアvs. その他)、ECOG PS(0 vs. 1)、転移臓器数(≦1 vs. ≧2)であった。主要評価項目は、PD-L1≧1%の症例におけるOSと無増悪生存期間(PFS)、副次評価項目は、全体集団におけるOSとPFS、PD-L1≧1%の症例と全体集団における奏効割合(ORR)であった。本試験では、全体の有意水準を5%とし、各解析時点におけるα消費関数を利用するBonferroni-based graphical approachが採用されている。最初にNIVO+chemo群とchemo群の比較、およびNIVO+IPI群とchemo群の主要評価項目(OS、PFS)をそれぞれ実施した。副次評価項目の全体集団におけるOSとPFSについては、主要評価項目で有意差を認めた項目のみ比較を行った。ORRについては、副次評価項目である全体集団におけるPFSの有意差を認めた場合のみ評価を行った。
図1 CheckMate 648 study design(発表者の許可を得て掲載)
NIVO+chemo vs. chemo:OS(PD-L1陽性、全体集団)、PFS(PD-L1陽性)においてNIVOの生存期間における上乗せ効果が証明された
NIVO+IPI vs. chemo:OS(PD-L1陽性、全体集団)においてchemoに対するNIVO+IPIの生存期間における優越性が示された
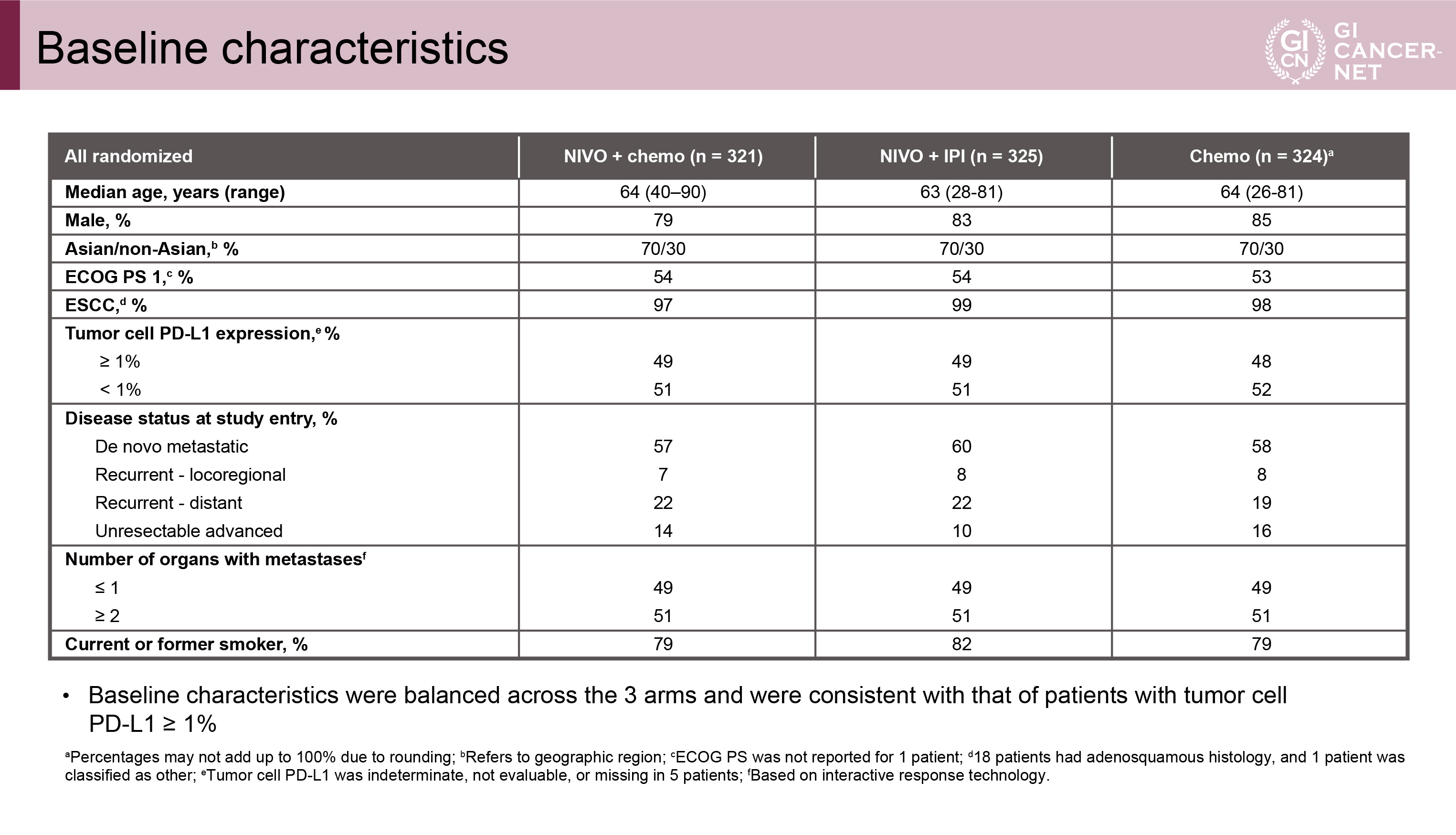
主な患者背景は3群間で差は認めず、アジア人が70%を占め、PD-L1≧1%が約半数を占めていた(表1)。なおPD-L1陽性例はNIVO+chemo群で158例、NIVO+IPI群で158例、chemo群で157例であった。
表1 Baseline characteristics(発表者の許可を得て掲載)
治療期間はNIVO+chemo群で最も長く、その中央値は5.7ヵ月であった。NIVO+IPI群の治療期間中央値は2.8ヵ月、chemo群の治療期間中央値は3.4ヵ月であった。全体の55%が後治療へ移行することができた。後治療として免疫療法を用いた症例は、NIVO+chemo群とNIVO+IPI群の5%、chemo群の16%であった。
主要評価項目であるPD-L1陽性例におけるOS中央値はNIVO+chemo群では15.4ヵ月、chemo群では9.1ヵ月で、NIVO+chemo群の優越性が証明された[ハザード比(HR)=0.54、99.5% CI: 0.37-0.80、p<0.0001](図2)。全体集団におけるOS中央値はNIVO+chemo群では13.2ヵ月、chemo群では10.7ヵ月であり、NIVO+chemo群の優越性が証明された(HR=0.74、99.1% CI: 0.58-0.96、p=0.0021)(図2)。
同時に主要評価項目であるPD-L1陽性例におけるPFS中央値はNIVO+chemo群では6.9ヵ月、chemo群では4.4ヵ月と、NIVO+chemo群の優越性が証明された(HR=0.65、98.5% CI: 0.46-0.92、p=0.0023)(図3)。しかし、全体集団におけるPFS中央値はNIVO+chemo群では5.8ヵ月、chemo群で5.6ヵ月と、有意差は認められなかった(HR=0.81、98.5% CI: 0.64-1.04、p=0.0355)(図3)。また、PD-L1陽性例におけるORRはそれぞれ53% vs. 20%で、全体集団におけるORRは47% vs. 27%であったが、全体集団におけるPFSで有意差を認めなかったことから、比較は行われなかった(図4)。
図2 Overall survival: NIVO+chemo vs. chemo(発表者の許可を得て掲載)
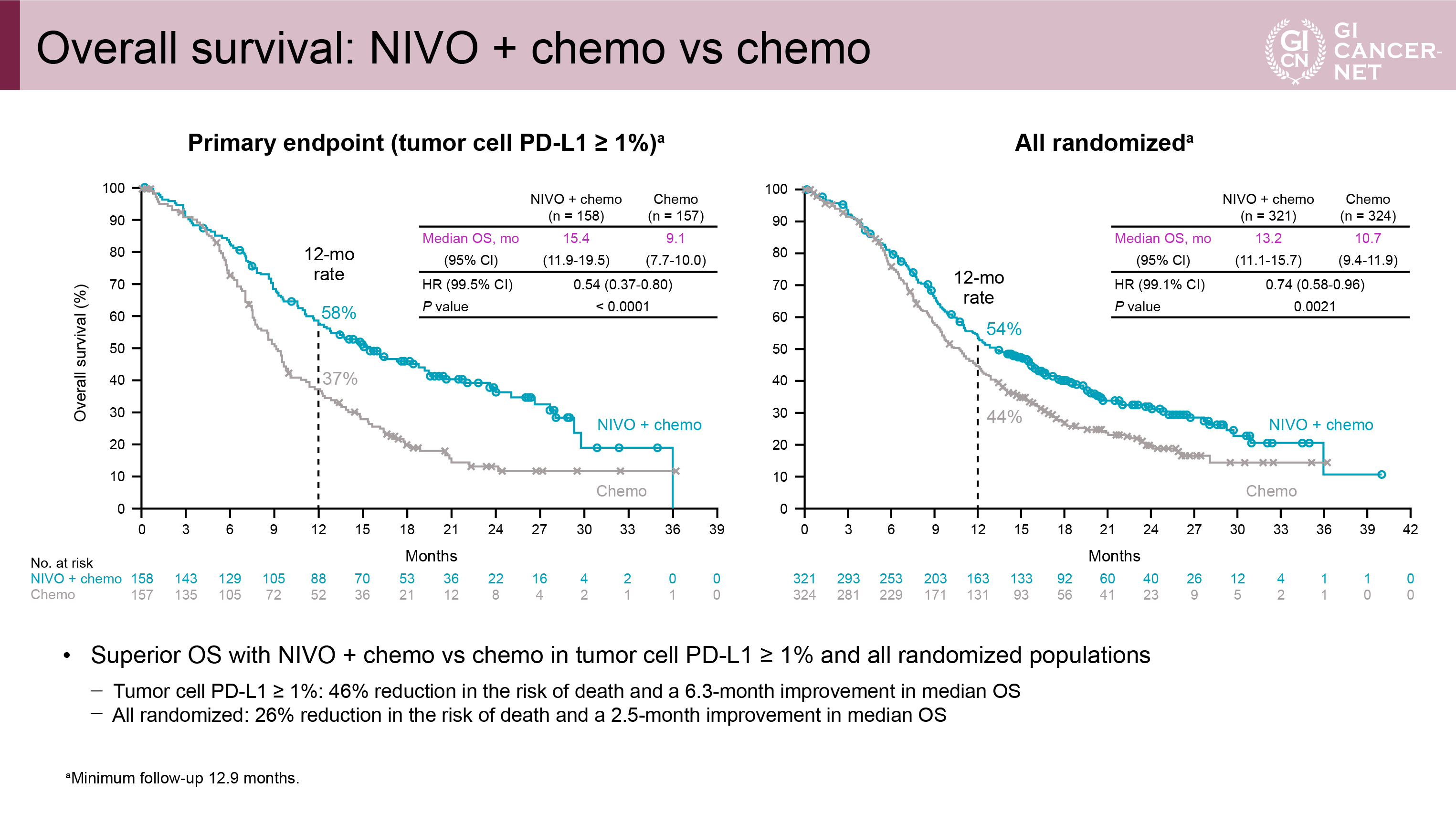
図3 Progression-free survival: NIVO+chemo vs. chemo(発表者の許可を得て掲載)

図4 Response and duration of response: NIVO+chemo vs. chemo(発表者の許可を得て掲載)

主要評価項目であるPD-L1陽性例におけるOS中央値はNIVO+IPI群では13.7ヵ月、chemo群では9.1ヵ月であり、NIVO+IPI群の優越性が証明された(HR=0.64、98.6% CI: 0.46-0.90、p=0.0010)(図5)。全体集団におけるOS中央値はNIVO+IPI群では12.8ヵ月、chemo群では10.7ヵ月であり、NIVO+IPI群の優越性が示された(HR=0.78、98.2% CI: 0.62-0.98、p=0.0110)(図5)。
同時に主要評価項目であるPD-L1陽性例におけるPFS中央値はNIVO+IPI群では4.0ヵ月、chemo群では4.4ヵ月であり、有意差は認められなかった(HR=1.02、98.5% CI: 0.73-1.43、p=0.8958)(図6)。全体集団におけるPFS中央値はNIVO+IPI群では2.9ヵ月、chemo群では5.6ヵ月であったが、PD-L1陽性例におけるPFSで有意差を認めなかったことから、その比較は行われなかった(図6)。また、PD-L1陽性例におけるORRはそれぞれ35% vs. 20%で、全体集団におけるORRはそれぞれ28% vs. 27%であったが、同様の理由でその比較は行われなかった(図7)。
図5 Overall survival: NIVO+IPI vs. chemo(発表者の許可を得て掲載)
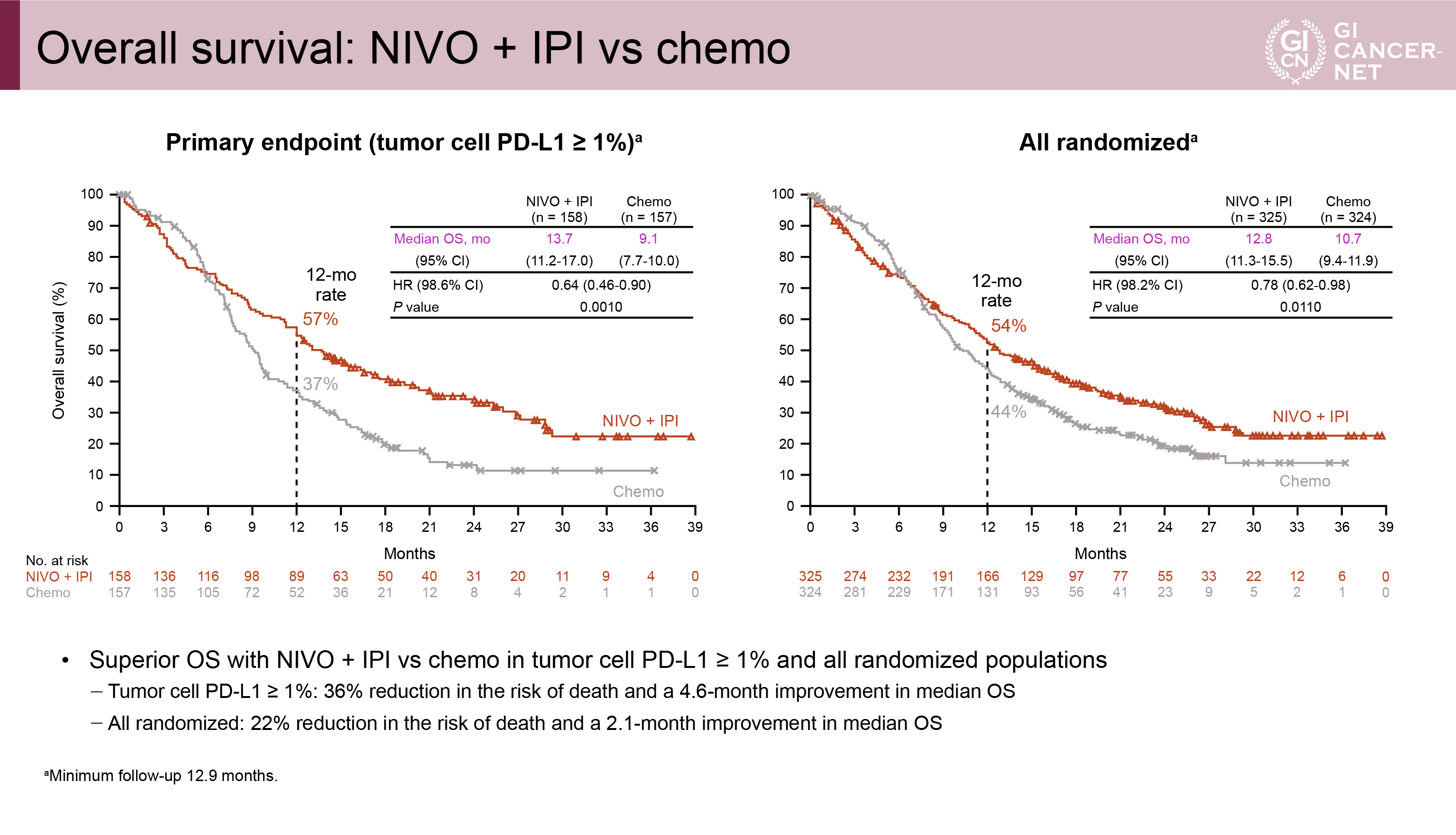
図6 Progression-free survival: NIVO+IPI vs. chemo(発表者の許可を得て掲載)
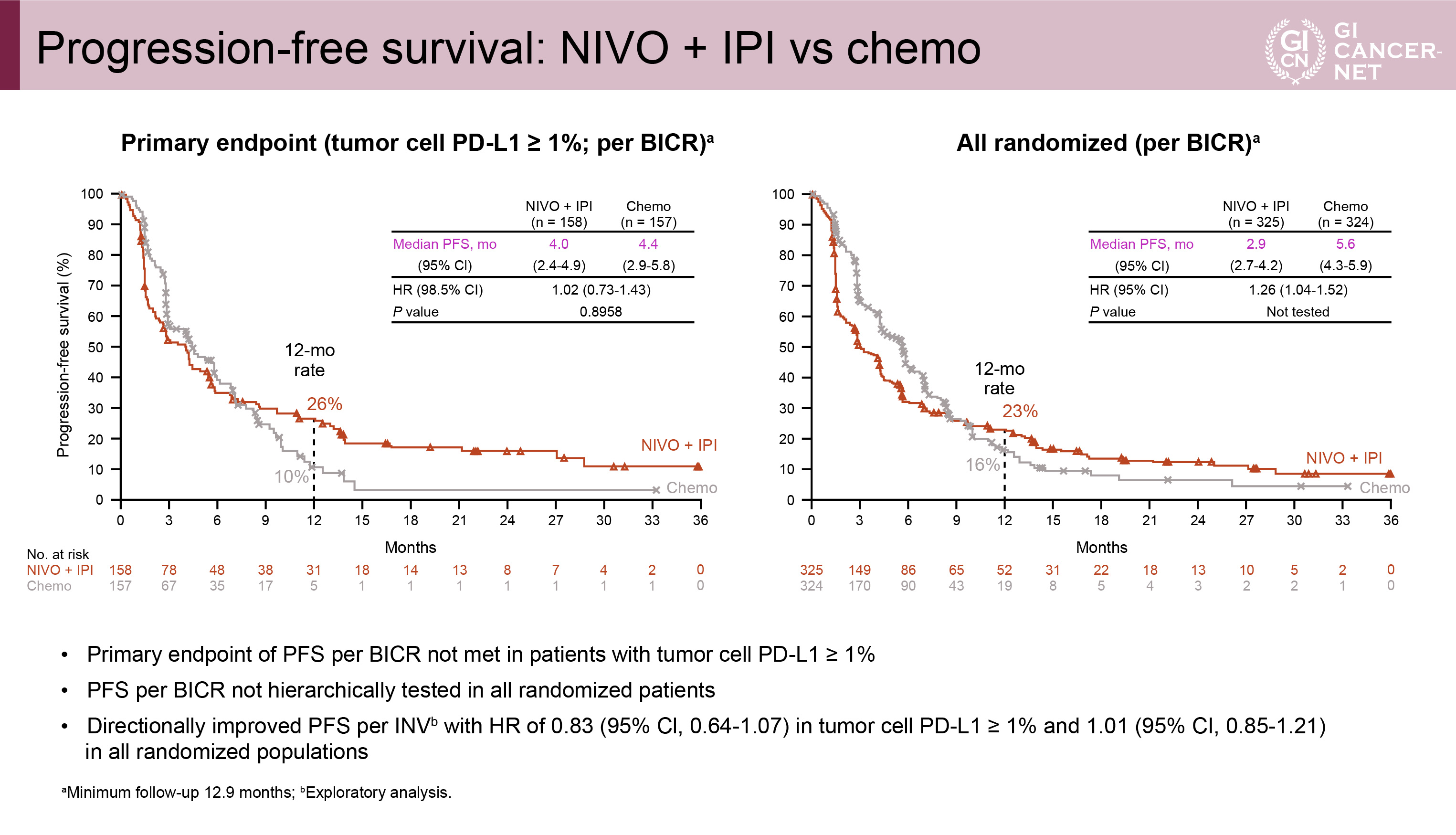
図7 Response and duration of response: NIVO+IPI vs. chemo(発表者の許可を得て掲載)

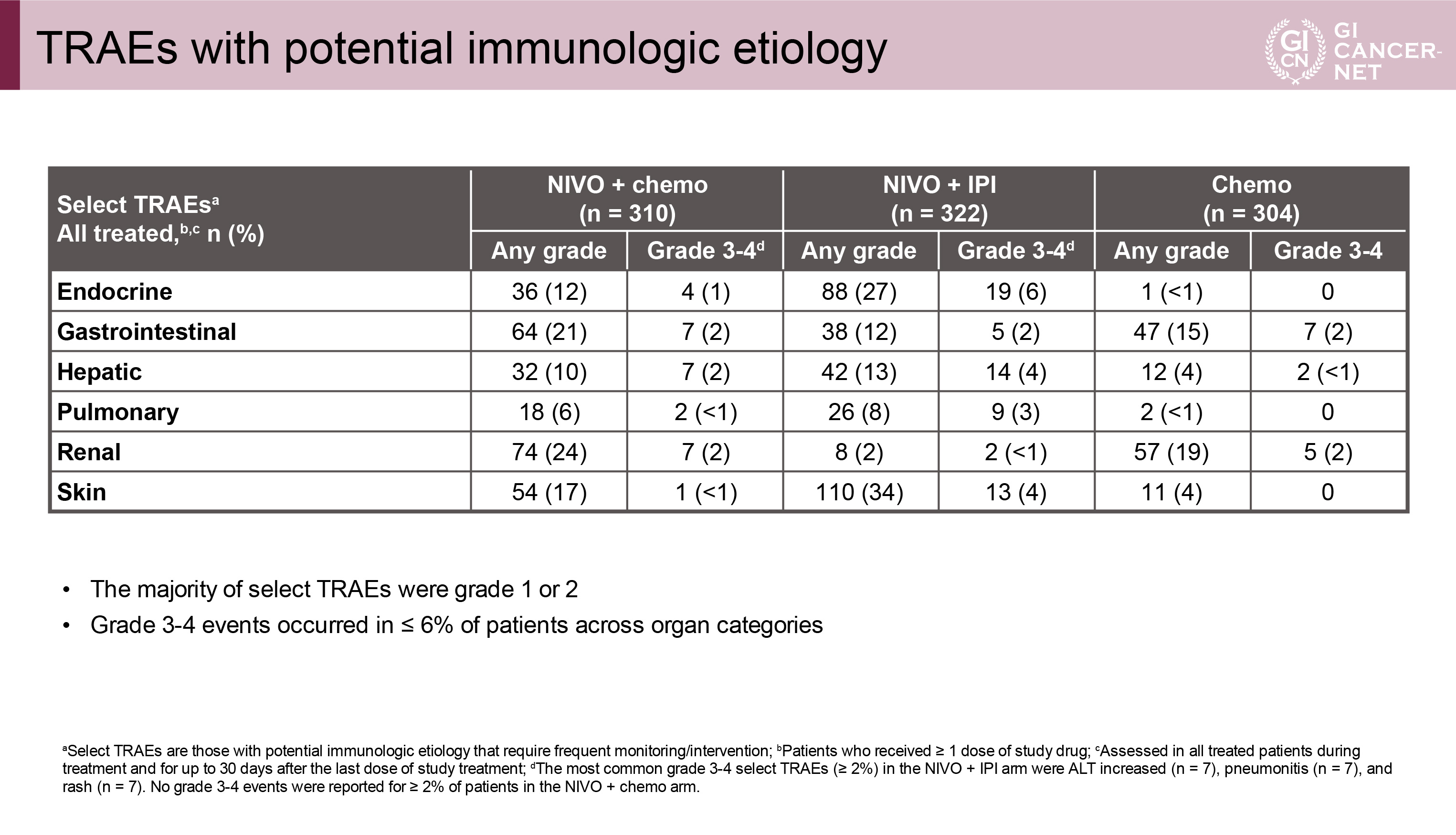
治療関連有害事象の発現は全gradeでNIVO+chemo群vs. NIVO+IPI群vs. chemo群において96% vs. 80% vs. 90%、grade 3以上で47% vs. 32% vs. 36%であった(表2)。治療関連死亡の発現は2%(5例)vs. 2%(5例)vs. 1%(4例)であった。免疫関連有害事象の発現は表3のとおりであった。
表2 Treatment-related adverse events(発表者の許可を得て掲載)
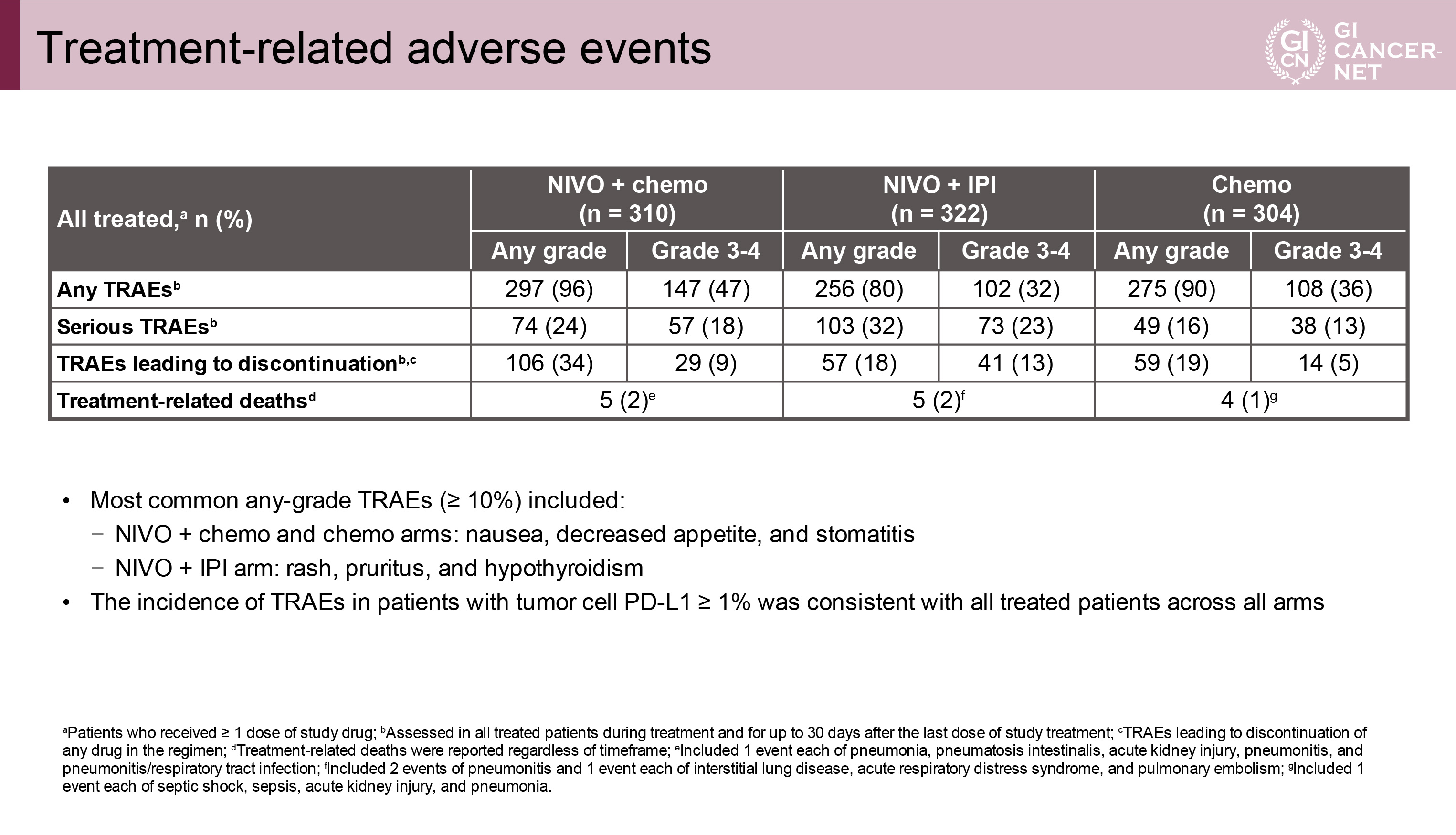
表3 TRAEs with potential immunologic etiology(発表者の許可を得て掲載)
まとめ
未治療の切除不能進行・再発食道扁平上皮癌に対してNivolumabの上乗せによってPD-L1発現にかかわらず、標準的なCF療法と比較してOS、PFSの延長効果が示された。またNivolumabとIpilimumab併用療法がPD-L1発現率にかかわらず、標準的なCF療法と比較してこちらもOSの延長効果が示された。
NivolumabとCF併用療法、NivolumabとIpilimumab併用療法は、切除不能進行・再発食道扁平上皮癌の1次治療における、新しい標準治療である。
(レポート:国立がん研究センター中央病院 消化管内科 原田 健太郎)
References
1) Sung H, et al.: CA Cancer J Clin. 71(3): 209-249, 2021[PubMed]
2) Arnold M, et al.: Gut. 69(9): 1564-1571, 2020[PubMed]
3) Bleiberg H, et al.: Eur J Cancer. 33(8): 1216-1220, 1997[PubMed]
4) Polee MB, et al.: Anticancer Drugs. 12(6): 513-517, 2001[PubMed]
5) Lee J, et al.: Cancer Chemother Pharmacol. 62(1): 77-84, 2008[PubMed]
6) Lorenzen S, et al.: Ann Oncol. 20(10): 1667-1673, 2009[PubMed]
7) Lee SJ, et al.: BMC Cancer. 15: 693, 2015[PubMed]
8) Hiramoto S, et al.: Int J Clin Oncol. 23(3): 466-472, 2018[PubMed]
9) Moehler M, et al.: Ann Oncol. 31(2): 228-235, 2020[PubMed]
10) Kato K, et al.: Lancet Oncol. 20(11): 1506-1517, 2019[PubMed]
関連サイト
・KEYNOTE-590試験[学会レポート][ClinicalTrials.gov]
・CheckMate 648試験[ClinicalTrials.gov]
・ATTRACTION-3試験[論文紹介][ClinicalTrials.gov]
加藤 健先生
国立がん研究センター中央病院 頭頸部・食道内科 科長