進行胆道癌に対するGemcitabine+Cisplatin+S-1投与(GCS療法)vs. Gemcitabine+Cisplatin投与(GC療法)の無作為化第III相試験
Randomized phase III study of gemcitabine, cisplatin plus S-1 (GCS) versus gemcitabine, cisplatin (GC) for advanced biliary tract cancer (KHBO1401-MITSUBA).
Daisuke Sakai, et al.
監修コメント
胆道癌の標準治療はGemcitabine(GEM)とCisplatin(CDDP)の併用療法(GC療法)であるが、2018年のASCO-GIでGEMとS-1の併用療法(GS療法)の非劣性が検証されている1)。現在、本邦で胆道癌に使用可能な薬剤は、GEM、CDDP、S-1の3薬剤に限られており、治療選択肢は少ない。また胆道癌の治療開発は、欧米での罹患頻度が低いことから進捗しておらず、世界的にも治療選択肢が限られている。
そのような状況で、GEM+CDDP+S-1療法(GCS療法)の優越性を検証する無作為化第III相試験の結果が報告された。試験結果として、全生存(OS)期間の比較において優越性が検証された。ハザード比(HR)は0.79、3薬剤の併用療法にすることでS-1特有の下痢、粘膜炎は増加しているが、極めて強い毒性の増強は認められなかった。特にGCS療法群では、conversion切除を行った症例が多く、非切除対象でそのような症例が出現したことは特筆すべき部分である。一方で、標準治療群であったGC療法群の治療成績がやや悪い部分は、非盲検試験であることからも気になる部分である。先に述べたGS療法の非劣性試験と比較すると、GC療法の奏効割合(RR)は約30%から15%に減少しており、腫瘍制御割合(病勢コントロール割合:DCR)も約80%であったものが、62%であった。さらに会場のディスカッサントの議論にもあったが、GC療法の二次治療として最終的にどの程度S-1が使用されていたのか、今後確認していく必要はある。サブグループ解析を参照すると、年齢が若く、また腫瘍量が少なく、conversion手術を積極的に検討したい対象においては、GCS療法が積極的に使用されていくと思われる。今回、標準治療の1つの選択肢として新たに位置づけられたGCS療法がGC療法と完全に置き換わるのかどうか、多くの研究者がGCS療法を使用した経験により、今後評価されていくことになるであろう。
(コメント・監修:神奈川県立がんセンター 消化器内科 医長 上野 誠)
胆道癌に対するS-1のactivityが示唆されている
進行胆道癌患者に対する標準治療は、Gemcitabine(GEM)とCisplatin(CDDP)の併用投与(GC療法)であるが、2018年のASCO-GIでGC療法に対するGEMとS-1の併用投与(GS療法)の非劣性が示された1)。KHBOグループでは,GC療法にS-1療法を併用投与する3薬剤併用レジメン(GCS療法)の第I、第II相試験を実施し,有効性が示唆される結果を得た2,3)。そこで、進行胆道癌患者に対して、GC療法とGCS療法の優越性を検証することを目的とした非盲検無作為化比較第III相試験が実施された。
進行胆道癌患者に対するGemcitabine+Cisplatin(GC療法)とGemcitabine+Cisplatin+S-1療法(GCS療法)の優越性を検証
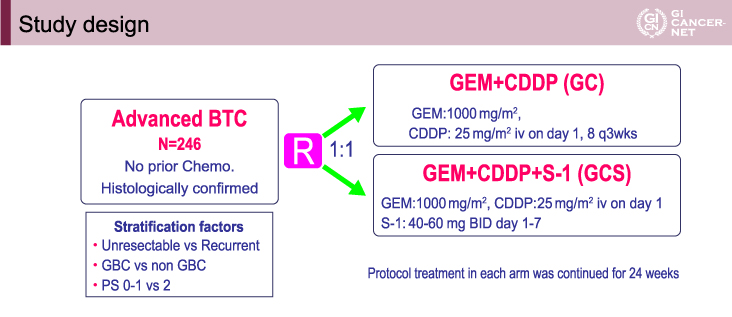
対象は、組織学的に腺癌または腺扁平上皮癌が確認された、切除不能または再発の胆道癌患者とされた。主な適格基準として、化学療法未治療、ECOG PS(performance status)0から2、20歳以上、主要臓器機能保持、などが設定された。患者は、切除不能vs. 再発、胆?原発vs. 胆?以外原発、ECOG PS 0,1 vs. 2を層別因子として、GC療法群とGCS療法群に1:1の割合で無作為に割り付けられた。GC群は3週間を1サイクルとして、GEM 1,000mg/m2とCDDP 25mg/m2を1、2週目のday 1、day 8に投与し、1週間休薬することとされた。GCS療法群は2週間を1サイクルとして、1週目のday 1にGEM 1,000mg/m2とCDDP 25mg/m2を、体表面積に応じてS-1 40~60mgを1日2回、day 1-7に投与し、1週間休薬することとされた。いずれも、治療開始後24週までがプロトコール治療とされた(図1)。
主要評価項目は、ITT解析に基づく全生存(OS)期間、副次評価項目として、無増悪生存(PFS)期間、奏効割合(RR)、安全性が設定された。GC療法群、GCS療法群の1年OS割合をそれぞれ43%、55%と想定し、αエラーを片側5%,検出力80%で各群必要症例数は120例とされた。
図1 Study design(発表者の許可を得て掲載)
GC療法群と比較してGCS療法群の全生存(OS)期間の統計学的に有意な優越性が検証された
2014年7月から2016年2月の間に246例が登録され、GC療法群、GCS療法群に各123例が割り付けられた。全例がOS期間、PFS期間の解析対象とされ、治療が行われなかったGC療法群1例、GCS療法群4例を除く、GC療法群123例とGCS療法群119例、計242例が安全性の解析対象とされた。患者背景では、性別、年齢、ECOG PS、標的病変の有無、切除不能/再発、原発臓器に有意差はなかった。
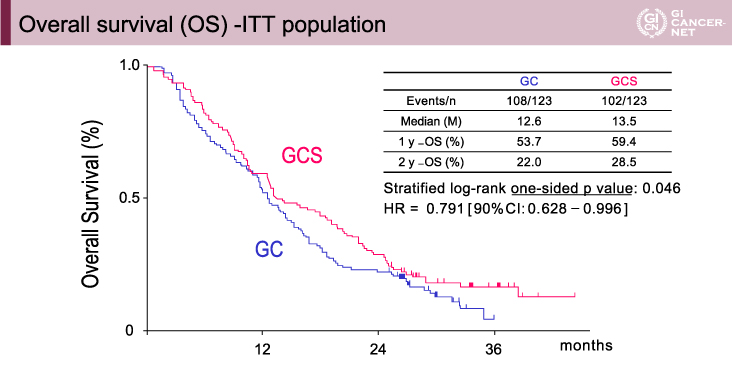
主要評価項目は210イベントが発生した時点で解析され、OS期間のハザード比(HR)=0.791[90%信頼区間(CI): 0.628-0.996]、片側p値=0.046(層別log-rank検定)、中央値はGC療法群12.6ヵ月、GCS療法群13.5ヵ月と、GCS療法群で統計学的有意に良好であった(図2)。また、部分集団におけるOS期間も概ねGCS療法群で良好であった。
副次評価項目であるPFS期間のHR=0.748(95% CI: 0.577-0.970)、片側p値=0.015(層別log-rank検定)、中央値はGC療法群5.5ヵ月、GCS療法群7.4ヵ月と、GCS療法群で統計学的有意に良好であった。標的病変を有したGC療法群100例およびGCS療法群94例のRECIST ver1.1に基づくRRは、GC療法群15.0%、GCS療法群41.5%、腫瘍制御割合(病勢コントロール割合:DCR)はGC療法群62.0%,GCS療法群79.8%と、いずれもGCS療法群で統計学的有意に良好であった。
有害事象として、GC療法群(112例)と比較してGCS療法群(119例)において、下痢(14% vs. 24%)、粘膜炎(13% vs. 28%)、皮疹(7% vs. 23%)が多くみられ、末梢神経障害(11% vs. 3%)が少なかったが、いずれもgrade 3以上の発現頻度に差はなかった。
図2 Overall survival(OS) - ITT population(発表者の許可を得て掲載)
まとめ
GCS療法のGC療法に対するOS期間の優越性が検証され、GCS療法は進行胆道癌に対する新たな標準治療の1つとなる可能性が示唆された。
(レポート:金沢大学 先進予防医学研究センター 特任准教授 寺島 健志)

上野 誠 先生
神奈川県立がんセンター 消化器内科 医長