標準治療不応または不耐の切除不能進行・再発大腸癌のCapecitabine(Cap)+Bevacizumab(Bmab)+プラセボ療法に対するCap+Bmab+Atezolizumab(Atezo)療法の有効性を検証する二重盲検無作為化多施設共同第II相試験(BACCI試験:ACCRU Network Study)
BACCI: A Phase II Randomized, Double-Blind, Multicenter, Placebo-Controlled Study of Capecitabine Bevacizumab plus Atezolizumab or Placebo in Refractory Metastatic Colorectal Cancer: An ACCRU Network Study
Niharika B. Mettu, et al.
監修コメント
免疫チェックポイント阻害剤はすでに固形腫瘍の化学療法になくてはならない存在になったといっても過言ではない。悪性黒色腫をはじめ、肺癌、胃癌、腎臓癌など、さまざまな癌種で、単剤療法あるいは併用療法において有効性が示されているが、その恩恵がまだ得られていない、数少ない癌種のうちのひとつが大腸癌である。高頻度マイクロサテライト不安定性(microsatellite instability-high: MSI-H)大腸癌についてはすでに有効性が示されているが、大多数を占めるマイクロサテライト安定性(microsatellite stable: MSS)大腸癌については繰り返し試験が行われているものの、いずれも芳しい結果は報告されていない。
近年、免疫チェックポイント阻害剤の効果を高めるための併用療法として、血管新生にかかわる血管内皮増殖因子(VEGF)を標的にした抗体が有望であることが、非小細胞肺癌(IMpower150試験)1)、腎細胞癌(IMmotion150試験)2)、胃癌(NivoRam試験)3)で報告された。VEGFは免疫を抑制的にする骨髄由来免疫抑制細胞(MDSC)や制御性T細胞(Treg)の活性化に関与しており、VEGF阻害剤の投与により免疫チェックポイント阻害剤の作用が増強するといわれている。今回は大腸癌で用いられているBevacizumab(Bmab)にPD-L1免疫チェックポイント阻害剤であるAtezolizumab(Atezo)を併用することで、通常はMSS大腸癌に効果がないAtezoの有効性が高まる可能性について検討した無作為化比較試験である。結果としては、臨床的な有効性は示されず、肺癌や腎細胞癌のような効果を認めなかった。
なぜ効果が得られないのかについては、抑制系細胞が思ったほど抑制されていないのか、抑制されているが免疫細胞が働いていないのか、など検討が必要で、それにより次の戦略を考える必要がある。ASCO 2019では、PD-1免疫チェックポイント阻害剤であるNivolumab(Nivo)と、血管新生作用ももつ経口マルチキナーゼ阻害剤であるRegorafenib(REG)との併用療法を検討したREGONIVO試験4)で、MSS大腸癌に対して奏効割合(RR)36%との結果が報告されている。すでに大腸癌において第III相試験が計画されているとされており、血管新生阻害抗体よりも、マルチキナーゼ阻害剤との併用で開発が進むと推測される。また、抗LAG3抗体など、免疫チェックポイント阻害剤同士の併用での検討も行われており、MSS大腸癌での免疫チェックポイント阻害剤の開発はまだ続いていくと思われる。
(コメント・監修:国立がん研究センター中央病院 消化管内科 医長 加藤 健)
大腸癌における免疫チェックポイント阻害剤の役割と血管内皮増殖因子(VEGF)阻害剤との併用効果を検証
高頻度マイクロサテライト不安定性(microsatellite instability-high: MSI-H)大腸癌やミスマッチ修復機構欠損(deficient mismatch repair: dMMR)大腸癌に対する免疫チェックポイント阻害剤は、CheckMate-142試験1)やKEYNOTE-164試験2)など複数の臨床試験において有効性が示された。一方、マイクロサテライト安定性(microsatellite stable: MSS)大腸癌においては、腫瘍遺伝子変異数(tumor mutation burden: TMB)が低いこと等3,4)から免疫チェックポイント阻害剤が奏効しにくいことが報告されている。免疫チェックポイント阻害剤の効果を高めるさまざまな試みのひとつとして、免疫チェックポイント阻害剤と血管新生阻害剤を併用することで、腫瘍内でのT細胞活性が増強されることが報告されている5,6)。しかしながらMODUL試験では、BRAF野生型を対象とするコホート2で、一次治療におけるフッ化ピリミジン系薬剤+Bevacizumab(Bmab)療法へのAtezolizumab(Atezo)(800mg/body)の上乗せ効果が検討されたものの、無増悪生存(PFS)期間および全生存(OS)期間の改善は示されなかった7)。
本試験は標準治療に不応または不耐となった切除不能進行・再発大腸癌患者を対象に、抗PD-1抗体および血管内皮増殖因子(VEGF)阻害剤の併用効果を検証する二重盲検無作為化多施設共同第II相試験である。
標準治療不応または不耐の切除不能進行・再発大腸癌において、Capecitabine(Cap)+BmabにAtezoの上乗せ効果をプラセボと比較
本試験の主な適格基準は、フッ化ピリミジン系薬剤、Oxaliplatin(OX)、Irinotecan(IRI)、Bmab、抗EGFR抗体薬に不応もしくは不耐(RAS野生型に限る)で、RECIST ver1.1における測定可能病変を有し、ECOG PS(Eastern Cooperative Oncology Group performance status)0?1、主要臓器機能が保たれていることであった。Atezoを含む他のPD-1/PD-L1抗体薬投与歴のある患者や、自己免疫疾患、免疫不全、免疫抑制状態、感染症の患者は除外された。
対象患者は、Cap 850または1,000mg/m2(1?14日目)+Bmab 7.5mg/kg(1日目)に、Atezo 1,200mg/bodyを1日目に投与する群(Cap+Bmab+Atezo群。以下、Atezo群)と、プラセボを1日目に投与する群(Cap+Bmab+プラセボ群。以下、プラセボ群)に、2:1に割り付けられた。
主要評価項目は、ITT解析におけるPFS期間、副次評価項目は全奏効割合(ORR)、OS期間、安全性、忍容性であった。プラセボ群に対するAtezo群のPFSにおけるハザード比(HR)=0.65、片側α=0.10、検出力80%の設定にて症例集積が行われた。
Atezo群において、主要評価項目であるPFSの有意な延長は示されなかった
本試験では、Atezo群87例、プラセボ群46例の計133例が登録された。主な患者背景に差はなかった。RAS変異型はAtezo群54.3%、プラセボ群59.8%、MSI-H/dMMRはそれぞれ13.3%、14.3%含まれていた。
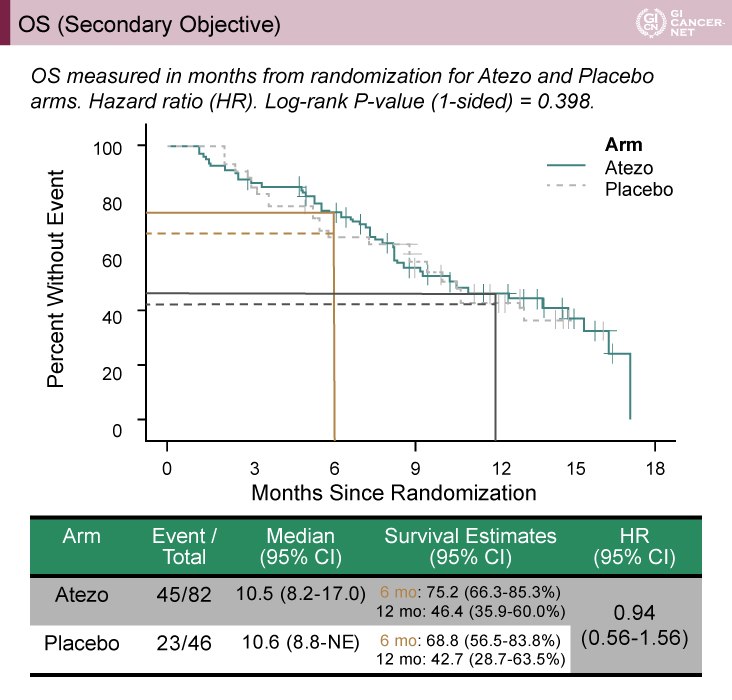
主要評価項目であるPFS期間中央値は、Atezo群4.4ヵ月vs. プラセボ群3.3ヵ月[HR=0.73(95% CI: 0.49?1.07)、p=0.051]で統計学的な有意差は示されなかった(図1)。副次評価項目であるOS期間についても、中央値は10.5ヵ月vs. 10.6ヵ月[HR=0.94(95% CI: 0.56?1.56)、p=0.398]と改善を認めなかった(図2)。
サブ解析では、MSI-H、MSS患者において、PFS期間のHRは各々0.77(95% CI: 0.23-2.50)、0.67(95% CI: 0.44-1.03)であった。各群のORRについては、8.54%(95% CI: 3.5?16.8)vs. プラセボ群で4.35%(95% CI: 0.53?14.8)であった(p=0.49)。
図1 PFS(Primary Objective)(発表者の許可を得て掲載)
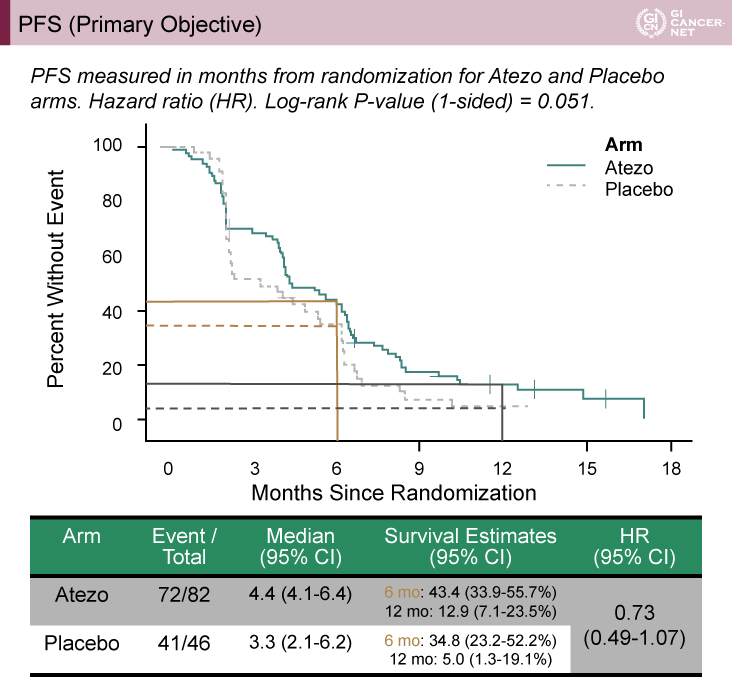
図2 OS(Secondary Objective)(発表者の許可を得て掲載)
主な有害事象
Atezo群においてCTCAE v4.0におけるGrade 3以上の治療関連有害事象として発現頻度の高いものは、高血圧8.1%、手足症候群7.0%、下痢7.0%、倦怠感3.5%、血栓塞栓症3.5%などであり、忍容性は良好であった。
まとめ
本試験では、標準治療不応または不耐の大腸癌に対するCap+Bmab療法へのAtezo上乗せによるPFS期間の改善は示されなかった。
患者背景における前治療レジメン数や、MSS/pMMR患者における奏効期間(DR)の詳細などが不明であり、強調されていたMSS/pMMR患者におけるCape+Bmab+Atezo併用の有効性をbiologicalに説明するに足りる情報が不足していたといわざるを得ず、VEGF阻害剤と抗PD-1抗体を単純に併用することでこれらのpopulationの治療効果を高めることは難しいことが示唆された。
しかしながらStage IV大腸癌の95%を占めるMSS/pMMR患者に対する免疫チェックポイント阻害剤の効果を高める試みは重要かつ興味深いテーマであり、本試験では組織や血漿検体を用いた探索的なバイオマーカー研究も行われていることから、その結果が待たれるところである。
(レポート:慶應義塾大学病院 消化器内科 下嵜 啓太郎)
References
- 1) Overman MJ, et al.: Lancet Oncol. 18(9): 1182-1191, 2017 [PubMed]
- 2) Le DT, et al.: J Clin Oncol. 36(15_suppl): 3514-3514, 2018 [Journal of Clinical Oncology]
- 3) Yarchoan M, et al.: N Engl J Med. 377(25): 2500-2501, 2017 [PubMed]
- 4) Grasso CS, et al.: Cancer Discov. 8(6): 730-749, 2018 [PubMed]
- 5) Yasuda S, et al.: Clin Exp Immunol. 172(3): 500-506, 2013 [PubMed]
- 6) Wallin JJ, et al.: Nat Commun. 7: 12624, 2016 [PubMed]
- 7) Grothey A, et al.: ESMO 2018 abstract #LBA19 [OncologyPRO]
関連サイト
- ・BACCI試験 [ClinicalTrials.gov][Journal of Clinical Oncology]
- ・IMpower150試験 [ClinicalTrials.gov]
- ・IMmotion150試験 [ClinicalTrials.gov]
- ・NivoRam試験 [ClinicalTrials.gov][学会レポート(ASCO 2018 #4047)]
- ・REGONIVO試験 [ClinicalTrials.gov][学会レポート(ASCO 2019 #2522)]
- ・CheckMate142試験 [ClinicalTrials.gov][学会レポート(ASCO 2017 #3531)][学会レポート(ESMO 2018 #LBA18)]
- ・KEYNOTE-164試験 [ClinicalTrials.gov]
- ・MODUL試験 [ClinicalTrials.gov][学会レポート(ESMO 2018 #LBA19)]

加藤 健 先生
国立がん研究センター中央病院 消化管内科 医長