食道癌
胃癌
HER2陽性転移性食道胃腺癌に対するPembrolizumab(P)、Trastuzumab(T)、Capecitabine(C)とOxaliplatin(O)による1次治療
First-line pembrolizumab, trastuzumab, capecitabine and oxaliplatin in HER2-positive metastatic esophagogastric adenocarcinoma
Yelena Y. Janjigian, et al.
Expert’s view
HER2陽性胃癌に対する初回治療はフッ化ピリミジン+プラチナ+Trastuzumabである。現在行われている免疫チェックポイント阻害剤を初回化学療法にオンオフする試験では、HER2陽性例は除外されており、またATTRACTION-2や、KEYNOTE-061といった単独使用の場合でも、HER2陽性胃癌での免疫チェックポイント阻害剤の効果や、Trastuzumabとの併用効果というのは分かっていなかった。今回初めて免疫チェックポイント阻害剤とTrastuzumabを含む化学療法との併用の結果が示された。化学療法と免疫チェックポイント阻害剤の併用では、SOX/XELOX+Nivolumabのデータが、奏効割合57.1%/76.5%と報告されているが1)、HER2陽性胃癌において今回の報告はそれを上回るものであり、PFS11.4ヵ月は驚異的な数字であった。今回は探索的に、PembrolizumabとTrastuzumabのみの投与が1回のみ化学療法併用前になされたが、52%(23名中12名)の患者さんが化学療法併用なしでも、腫瘍縮小が得られており、何かしらの機序による相乗的効果が得られているものと推測される。Trastuzumab投与による免疫系の変化などに関する知見は極めて限られており、今後の検討が期待される。臨床的には現在すでに開始されているKEYNOTE-911試験における、Pembrolizumabの優越性の結果を待つ必要がある。
(コメント・監修:国立がん研究センター中央病院 消化管内科 医長 加藤 健)
HER2陽性転移性食道胃腺癌の1次治療
TrastuzumabはHER2陽性転移性食道胃腺癌の1次治療として、PembrolizumabはPD-L1陽性例の3次治療として承認されている。Trastuzumabは抗体依存性の細胞貪食作用を誘発し2)、Oxaliplatinは腫瘍細胞の免疫原性細胞死を誘導する3)。またTrastuzumabにPembrolizumabを併用することで、T細胞の活性化、抗腫瘍免疫反応を増強することが考えられ4,5)、本試験が検討された。
PembrolizumabとTrastuzumab併用による1次治療の有用性の検討
本試験は第II相試験であり、主要評価項目は6ヵ月無増悪生存期間(PFS)であった。35例が登録され、評価可能な32例では100%の腫瘍縮小を認めた(図1)。DCRは100%であり、ORRは87%(95% CI: 71-91%、PR 25例、CR 3例)を認めた。観察期間中央値は6.6ヵ月(範囲0.03~23.5ヵ月)であり、PFS中央値は11.4ヵ月(95% CI: 6.0-16.4)で6ヵ月無増悪生存割合は67%(図2)、OS中央値は未達であるが1年OS割合は76%(95% CI: 51-89%)であった。

発表者の許可を得て掲載(approved by Yelena Y. Janjigian)
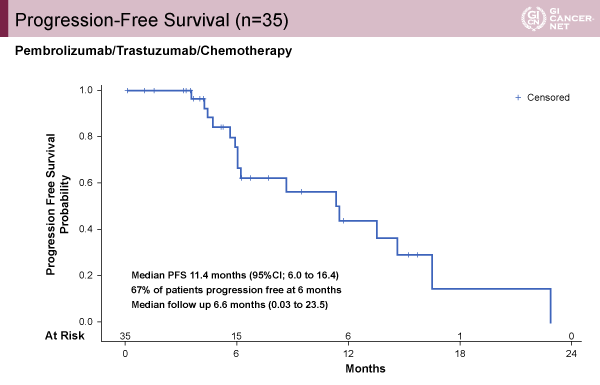
発表者の許可を得て掲載(approved by Yelena Y. Janjigian)
治療関連有害事象で多く認めたものは末梢神経障害(83%)、吐き気(74%)、下痢(69%)、AST/ALT上昇(57%)、血小板減少(54%)などであった。免疫関連有害事象はGrade 3腸炎(3%)、Grade 4間質性腎炎(3%)、Grade 3/4 AST/ALT上昇(11%/3%)を認めた。
バイオマーカーの解析(n=29)では、HER2をMSK(Memorial Sloan Kettering)Cancer Centerで確認を行ったところ、ほとんどがHER2陽性例であり陽性例では縮小率が良好であった(陽性例ではMSIは認めなかった)。一方でPD-L1 scoreと腫瘍縮小率は相関せず、むしろPD-L1陰性例と比較してPFSは成績不良であった(log-rank p=0.10)ことよりPD-L1は予測因子として有用ではないことが示された(図3)。次世代シークエンサーを用いた解析でERBB2 amplificationを61%で認め、TP53とKRASの変異はそれぞれ79%、14%で認めた。
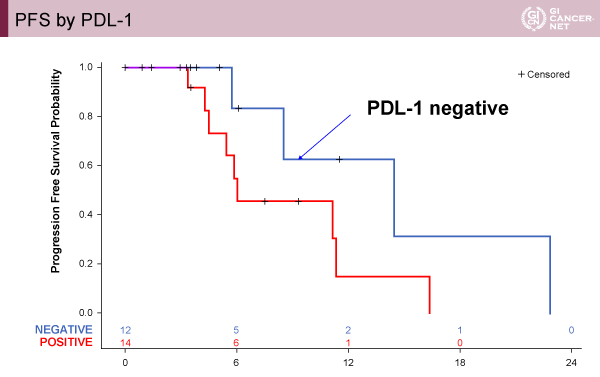
発表者の許可を得て掲載(approved by Yelena Y. Janjigian)
今回のデータをもとに現在胃癌/食道胃接合部癌のHER2陽性例に対して1次治療としてPembrolizumab/Trastuzumab/Chemotherapy対Placebo/Trastuzumab/Chemotherapyが施行予定である(第III相試験KEYNOTE-811)。
まとめ
Pembrolizumab/Trastuzumab/CapeOXは忍容性があり、ORRは87%と成績良好であった。PD-L1の発現は治療効果の予測因子とはならないことが示唆された。cfDNAに関しては現在解析中であり結果が期待される。
(レポート:国立がん研究センター中央病院 消化管内科 青木 雅彦)
References
- 1) Boku N, et al.: Ann Oncol. Dec 19, 2018 [Epub ahead of print]
- 2) Modified from Malas, et al.: Oncology Reports, 2014
- 3) Tesniere A, et al.: Oncogene. 29(4): 482-491, 2010 [PubMed]
- 4) Stagg J, et al.:Proc Natl Acad Sci. 108(17): 7142-7147, 2011 [PubMed]
- 5) Gall VA, et al.: Cancer Res. 77(19): 5374-5383, 2017 [PubMed]







加藤 健先生
国立がん研究センター中央病院 消化管内科 医長