切除不能進行・再発胃癌/食道胃接合部癌の一次治療におけるPembrolizumab単剤、Pembrolizumab+化学療法併用および化学療法の無作為化比較第III相試験(KEYNOTE-062試験)
Pembrolizumab with or without chemotherapy versus chemotherapy in advanced G/GEJ adenocarcinoma: The phase 3, KEYNOTE-062 study
Josep Tabernero, et al.
監修コメント

加藤 健先生
国立がん研究センター中央病院 消化管内科 医長
胃癌の治療を変えることが期待された第III相試験は微妙な結果となった。肺癌や頭頸部癌と同様に、初回化学療法に対する免疫チェックポイント阻害剤(ICI)の上乗せ効果が期待されたが、結果はネガティブなものであった。二次化学療法例に対するKEYNOTE-061試験では、PD-L1陽性割合(combined positive score: CPS)がより高い患者でPembrolizumabの有効性が高かったことから、CPS≧10の患者における優越性もエンドポイントとし狙いにいった感があるが、CPS≧1、CPS≧10いずれの患者集団でも、Pembrolizumab+化学療法群(P+C群)の生存曲線は、若干上をいくものの有意な差を示せなかった。エンドポイントを多数作ったためにαを消費し、“統計学的に”有意でないだけではなく、思ったほどtail-up effectがないこと、そしてハザード比(HR)0.85という数字は、研究者の期待とは異なる結果であった。
一方で、Pembrolizumab単剤群(P群)はICIの特徴である「効く症例には長く効く」ということを改めて示した。生存曲線は12ヵ月付近でクロスしているものの、全体のHRは0.91と良好であり、2年生存割合24%と、P群ではtail-up effectが認められた。この傾向はCPS≧10患者でより顕著となり、P+C群とは異なり、バイオマーカーの有用性が示唆された結果となった。あらかじめ設定された非劣性マージンをクリアしたため、試験的には“ポジティブ”であるが、P群の60%以上が3ヵ月以内に腫瘍増悪を認めていることを考えると、一部の患者のみが恩恵にあずかる治療という印象も受ける。もちろん、後治療を上手に行うことで、全体の生存期間が延びていることも事実であるが、日常診療では、あっという間に増悪し、PS(performance status)が低下してしまって次治療が実施できないような胃癌症例も少なくない割合で経験する。Pembrolizumab単剤が胃癌初回治療のラインナップに加わった場合には、慎重な患者選択がカギとなるであろう。
現在行われている胃癌初回治療におけるICIと化学療法併用の比較試験として、ATTRACTION-4試験は、SOX療法[S-1+Oxaliplatin(OX)]またはCapeOX[Capecitabine+Oxaliplatin(OX):XELOX]療法とNivolumab(Nivo)の併用を、CheckMate-649試験は、CapeOX(XELOX)療法またはFOLFOX[Fluorouracil(5-FU)+Leucovorin(LV)+OX]療法とNivoの併用を検討している。若干対象の異なるこれらの試験で同様の結果がでるのか、あるいは異なるのかも、今後の注目点である。
(コメント・監修:国立がん研究センター中央病院 消化管内科 医長 加藤 健)
抗PD-1抗体薬の化学療法への上乗せ効果はあるのか?
PembrolizumabはPD-1(programmed cell death-1)に対するヒト化モノクローナル抗体であり、活性化T細胞上のPD-1に結合することにより、癌細胞上のPD-L1およびPD-L2との結合を阻害することで癌細胞による活性化T細胞の抑制を阻害する、抗腫瘍活性を有する薬剤である。切除不能進行・再発胃癌/食道胃接合部癌においては、KEYNOTE-059試験1)の結果を受け、2レジメン以上の化学療法に不応または不耐となったPD-L1陽性[combined positive score(CPS)≧1]の切除不能進行・再発胃癌/食道胃接合部癌に対し、米国FDAで承認を受けている。
一方で、二次治療におけるPembrolizumabとPaclitaxel(PTX)とを比較するKEYNOTE-061試験2)では、CPS≧1、CPS≧10の症例ともに臨床的改善が認められたものの、全生存期間(OS)において事前に規定した統計学的に有意な差を示せなかった。
一次化学療法において、Pembrolizumab+化学療法群(P+C群)の化学療法群(C群)に対する優越性、Pembrolizumab単剤群(P群)のC群に対する非劣性を検証
本試験では、18歳以上のHER2陰性、PD-L1陽性(CPS≧1)患者763例(うち281例がCPS≧10)が登録された。Pembrolizumab単剤群(P群:Pembrolizumabを3週毎に200mg投与、最大2年)、Pembrolizumab+化学療法群[P+C群:Pembrolizumab+Cisplatin(CDDP)を3週毎に80mg/m2投与+Fluorouracil(5-FU)を3週毎に1日目から5日目まで800mg/m2投与、あるいは、各国のガイドラインに従いCapecitabineを3週毎に1日目から14日目まで1日2回1,000mg/m2投与)]、プラセボ+化学療法群[C群:プラセボを3週毎に投与+CF療法(CDDP+5-FU療法)]の3群に、無作為に1:1:1で割り付けられた。
主要評価項目は、CPS≧1とCPS≧10の患者におけるOS、CPS≧1の患者における無増悪生存期間(PFS)であり、C群に対するP+C群の優越性およびC群に対するP群の非劣性が検証された。副次評価項目は、CPS≧1の患者における奏効割合(ORR)、奏効期間(DOR)であった。
Pembrolizumab+化学療法群(P+C群)は、プラセボ+化学療法群(C群)に対して優越性を示せず、Pembrolizumab単剤群(P群)の非劣性のみが示された
2019年3月26日時点で観察期間中央値は11.3ヵ月[幅:0.2-41.2ヵ月]であった。CPS≧1の患者におけるP群とC群の比較では、OS中央値は、P群で10.6ヵ月、C群で11.1ヵ月であり、事前に規定した非劣性マージンHR=1.20を下回ったためP群のC群に対する非劣性が示された(HR=0.91、95% CI: 0.69-1.18)(図1)。CPS≧10の患者においてOS中央値は、P群17.4ヵ月、C群10.8ヵ月であり、CPS≧1と比較して差が大きくなる結果であった(HR=0.69、95% CI: 0.49-0.97)(図2)。
またCPS≧1の患者において、PFS中央値はP群2.0ヵ月vs. C群6.4ヵ月とP群で短く、ORRもP群14.8% vs. C群37.2%とP群で低い結果である一方、奏効例におけるDOR中央値は、P群13.7ヵ月vs. C群6.8ヵ月とP群では奏効が持続することが示された。
治療関連有害事象の発現割合は、全GradeではP群54%、C群92%、Grade 3/4ではP群16%、C群68%であり、P群で低率であった。
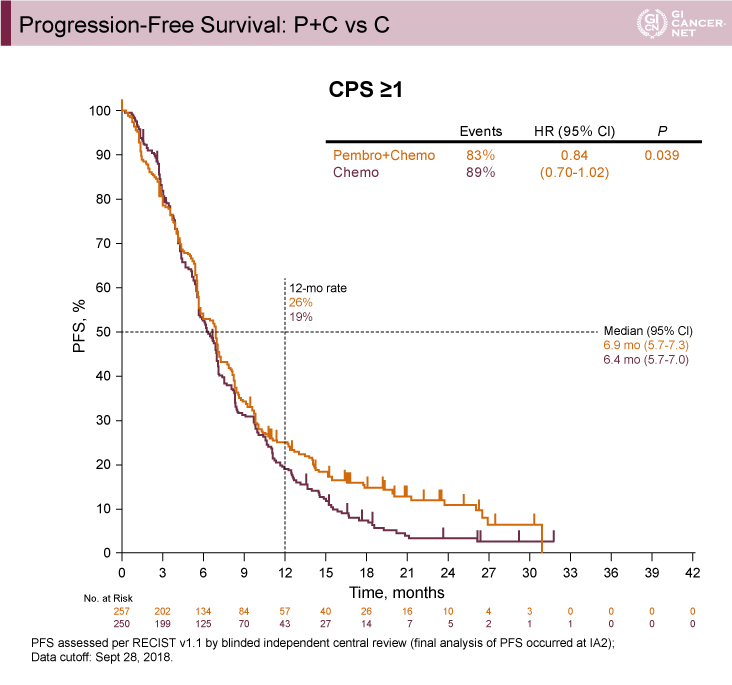
CPS≧1の患者におけるP+C群とC群との比較では、OS中央値は、P+C群で12.5ヵ月、C群で11.1ヵ月と臨床的改善が認められた(HR=0.85、95% CI: 0.70-1.03、p=0.046)(図3)。またPFS中央値も、P+C群で6.9ヵ月、C群で6.4ヵ月と臨床的改善が認められた(HR=0.84、95% CI: 0.70-1.02、p=0.039)(図4)。
しかし本試験では全体のα=0.025が、4つの検定(CPS≧1の症例におけるP群vs. C群のOSの非劣性から優越性へのスイッチ(α=0.004)、CPS≧10の症例におけるP+C群vs. C群のOSの優越性(α=0.0075)、CPS≧1の症例におけるP+C群vs. C群のOSの優越性(α=0.0125)、CPS≧1の症例におけるP+C群vs. C群のPFSの優越性(α=0.001)にそれぞれ割り付けられており、そのため事前に規定したOSおよびPFSの有意差の閾値には到達しなかった。
同様にCPS≧10の患者においてP+C群とC群の比較では、OS中央値は、P+C群12.3ヵ月、C群10.8ヵ月であり統計学的に有意差を示すことはできなかった(HR=0.85、95% CI: 0.62-1.17、p=0.158)。CPS≧1の患者におけるORRはP+C群で高率であったが、DORは同等であった(ORR:48.6% vs. 37.2%、DOR:6.8ヵ月vs. 6.8ヵ月)。
治療関連有害事象の発現割合は、全GradeではP+C群94%、C群92%、Grade 3/4ではP+C群71%、C群68%で、P+C群とC群の発現頻度は同等であった。
図1 Overall Survival: P vs C (CPS≧1)(発表者の許可を得て掲載)
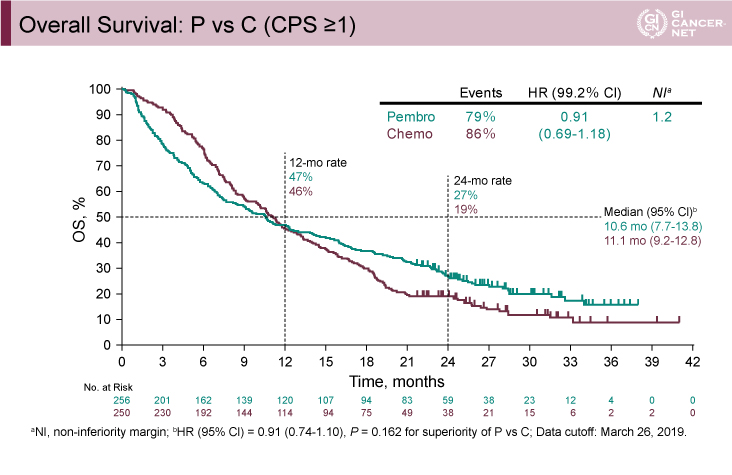
図2 Overall Survival: P vs C (CPS≧10)(発表者の許可を得て掲載)
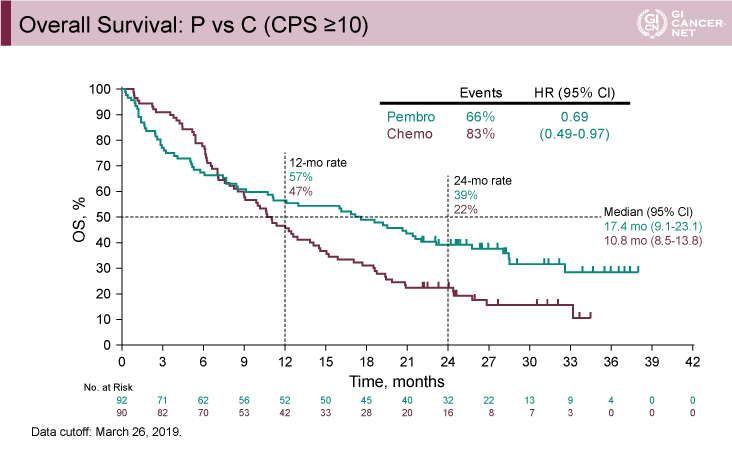
図3 Overall Survival: P+C vs C (CPS≧1)(発表者の許可を得て掲載)
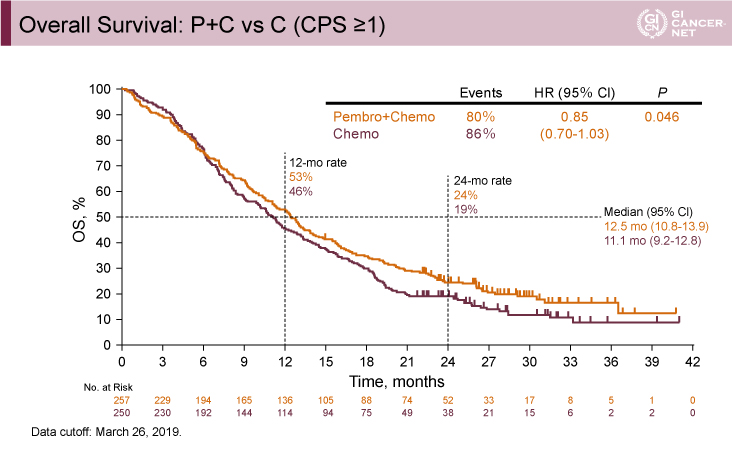
図4 Progression Free Survival: P+C vs C (CPS≧1)(発表者の許可を得て掲載)
まとめ
Pembrolizumab単剤療法は化学療法に対して、CPS≧1のPD-L1陽性患者において、OSでの非劣性が示された。一方、Pembrolizumabと化学療法の併用療法は化学療法に対して、CPS≧1、CPS≧10のPD-L1陽性患者双方においてOSでの優越性を示すことができなかった。
(レポート:がん研有明病院 消化器化学療法科 大隅 寛木)
References
1) Fuchs CS, et al.: JAMA Oncol. 4(5): e180013, 2018[PubMed]
2) Shitara K, et al.: Lancet. 392(10142): 123-133, 2018[PubMed]
関連サイト
・KEYNOTE-062試験(MK-3475-062)[ClinicalTrials.gov]
・KEYNOTE-061試験(MK-3475-061)[ClinicalTrials.gov][Journal of Clinical Oncology][論文紹介][学会レポート]
・ATTRACTION-4試験(ONO-4538-37試験)[ClinicalTrials.gov][PubMed][学会レポート]
・CheckMate-649試験[ClinicalTrials.gov][Journal of Clinical Oncology]
・KEYNOTE-059試験(MK-3475-059)[ClinicalTrials.gov][学会レポート][学会レポート]

監修
谷口 浩也先生
国立がん研究センター東病院
消化管内科 医長
加藤 健先生
国立がん研究センター中央病院
消化管内科 医長
山﨑 健太郎先生
静岡県立静岡がんセンター
消化器内科 医長
寺島 健志先生
金沢大学先進予防医学研究センター
特任准教授
レポーター (50音順)
井上 博登先生
静岡がんセンター
消化器内科
大隅 寛木先生
がん研有明病院
消化器化学療法科
緒方 貴次先生
神戸市立医療センター中央市民病院
腫瘍内科
尾阪 将人先生
がん研有明病院
肝・胆・膵内科
川本 泰之先生
北海道大学病院
消化器内科
林 秀幸先生
慶應義塾大学病院
腫瘍センター
深堀 理先生
久留米大学病院
がん集学治療センター
三島 沙織先生
国立がん研究センター東病院
消化管内科