HER2陽性転移性胃癌および食道胃接合部癌に対するPembrolizumabとTrastuzumabおよび化学療法の併用療法の有効性を検証する二重盲検グローバル第III相試験(KEYNOTE-811試験)の初回中間解析結果
Pembrolizumab plus trastuzumab and chemotherapy for HER2+ metastatic gastric or gastroesophageal junction cancer: Initial findings of the global phase 3 KEYNOTE-811 study
Janjigian YY, et al.
監修コメント
進行胃癌における、免疫チェックポイント阻害剤の有効性は、ESMO 2020で報告されたCheckMate 649試験、ATTRACTION-4試験の結果、化学療法との併用において、より効果を発揮することが示唆された。2021年5月にFDAより化学療法とNivolumabの併用療法が、食道胃接合部腺癌、胃癌の初回治療として承認された。これらの試験には、Trastuzumabの対象となる、HER2陽性(IHC3+、IHC2+/ISH+)の患者は標準治療が異なるため、対象とされておらず、今回報告されたKEYNOTE-811など、別の試験として免疫チェックポイント阻害剤の評価が行われている。今回の発表者のJanjigianらは、2019年のASCO-GIなどにおいて、HER2陽性食道胃接合部腺癌、胃癌に対する初回治療としてCapeOx+Trastuzumab+Pembrolizumabの第II相試験(MSKCC試験)を行い、ORR 91%、DCR 100%、1年OS 80%と有望な結果を発表している1)。
その結果をもとに、標準治療である5-FU+CDDPあるいはCapeOx+Trastuzumabに、Pembrolizumabとプラセボを無作為に併用した試験がKEYNOTE-811試験である。今回の報告は、あくまでもその中間報告であり、主要評価項目である生存期間の結果が出る前に、最初に登録された260例について、奏効割合が標準治療と比較して有意に改善がなされたかを解析している。これは、米国では、比較的稀ながん種である、胃癌の、HER2陽性フラクションにおいて、奏効割合にて優先承認を得ることを当初より狙っていたということと思われる。
果たして、奏効割合は、標準治療群の51.9%に対して試験治療群で74.4%と高く、有意差ありと判定されている。奏効持続時間もPembrolizumab併用群で上回っており、少なくとも短期的有用性については上乗せ効果が確認された。また、有害事象についても、想定の範囲内のものとなっており、新たに未知のものは見出されなかった。
日本においては、このような結果で即承認ということにはならず、最終的な全体の生存延長効果を見たのちに判断されると思われる。すでに全体の症例登録は終了しているため、イベント次第であるが、1年程度で生存についての結果が出てくると思われる。Nivolumabについては、日本よりNi-HIGH試験の安全性パートの報告(ASCO 2020)があり、12例中9例(75%)に奏効が得られている。近い将来に、HER2陽性胃癌の初回治療に免疫チェックポイント阻害剤が入ってくる可能性は高いと思われる。
またHER2陽性胃癌に対しては、すでに3次治療で承認されたTrastuzumab Deruxtecanの、より前のラインでの有用性を検討するDESTINY-Gastric03試験や、乳癌での開発が進むHER2特異的TKIであるTucatinibなど、いくつかの試験の開発が進んでおり、今後の結果に期待が集まる。
(国立がん研究センター中央病院 頭頸部・食道内科 科長 加藤 健)
HER2陽性胃癌に対する1次治療の開発
HER2陽性胃癌に対する初回治療はフッ化ピリミジン+プラチナ+Trastuzumabである。現在行われている免疫チェックポイント阻害剤を初回化学療法に用いる試験の多くは、HER2陽性例を除外しており、HER2陽性胃癌での免疫チェックポイント阻害剤の効果や、Trastuzumabとの併用効果は分かっていなかった。2019年のASCO-GIにて先行研究としてHER2陽性転移性食道胃腺癌に対するPembrolizumab、Trastuzumab、CapecitabineとOxaliplatinによる1次治療の第II相試験の結果が報告されており、有望な結果が示されていた1)。その結果を元に計画された第III相試験の中間解析の結果である。
中間解析における主要評価項目はORRの優越性
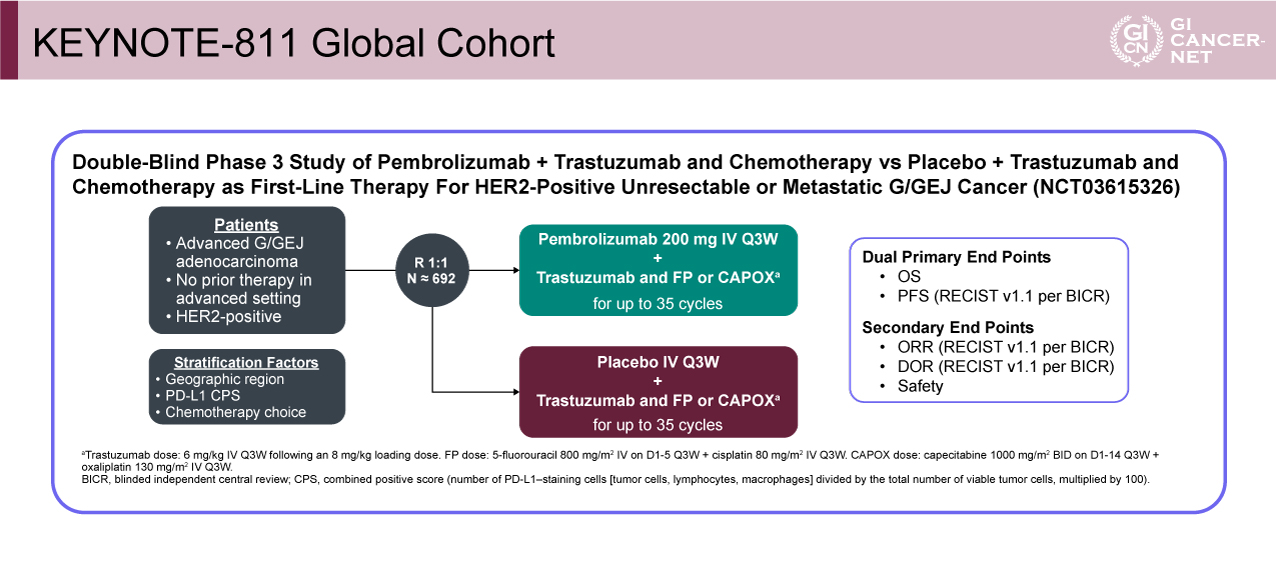
未治療かつHER2陽性の食道胃腺癌患者を対象にした本第III相試験の予定登録数は692例である。登録されたすべての患者はFluorouracil(5-FU)とCisplatin(FP療法)あるいはCapecitabineとOxaliplatin(CAPOX療法)のどちらかを研究者選択治療として受けた上でPembrolizumab(Pembro)を3週間毎に200mg投与する群(Pembro+SOC[standard of care])と投与しない群(プラセボ+SOC)に1:1で割り付けられた。治療期間は最長2年と規定された(図1)。
本試験の主要評価項目は盲検化独立中央判定(BICR)によるRECIST v1.1に基づくPFSとOSであった。副次評価項目は奏効割合(ORR)、奏効期間(DOR)、安全性であった。
今回の中間解析はプロトコールで規定され、最初に登録された260例の患者が8.5ヵ月以上の観察期間を経た時点で行われ、Pembro+SOC群が奏効率を有意に改善するかを検討することになっており、優越性の閾値はp=0.002であった。層別化因子は地域、PD-L1 status、化学療法の種類とされた。有効性の評価は最初の264例を対象としており、安全性の評価は2020年6月17日時点で1回以上の投薬を受けた434例を対象としていた。
図1 KEYNOTE-811 Global Cohort(発表者の許可を得て掲載)
Pembro+SOC群はプラセボ+SOC群に比べORRを有意に改善した
264例のうち、133例がPembro+SOC群に、131例がプラセボ+SOC群に割り付けられた。両群の患者背景は同様であった。年齢中央値はPembro+SOC群が62歳、プラセボ+SOC群が61歳、男性はPembro+SOC群が84%、プラセボ+SOC群が79%であった。アジア人はPembro+SOC群とプラセボ+SOC群がともに30%、PD-L1発現CPS 1以上はPembro+SOC群が88%、プラセボ+SOC群が85%であった。CAPOXが投与されたのは、Pembro+SOC群が86%、プラセボ+SOC群が88%、観察期間中央値は12.0ヵ月(範囲8.5-19.4ヵ月)であった。Pembro+SOC群の40.6%、プラセボ+SOC群の28.5%で投薬が継続されていた。
Pembro+SOC群でORR(95% CI)は74.4%(66.2-81.6)、CR割合は11.3%、プラセボ+SOC群でORR(95% CI)は51.9%(43.0-60.7)、CR割合は3.1%であった。奏効割合の差は22.7%(95% CI: 11.2-33.7)、p=0.00006で有意にPembro+SOC群で高かった。DCR(95% CI)はPembro+SOC群で96.2%(91.4-98.8)、プラセボ+SOC群で89.3%(82.7-94.0)であった。DORの中央値(範囲)は、Pembro+SOC群で10.6ヵ月(1.1+~16.5+)、プラセボ+SOC群で9.5ヵ月(1.4+~15.4+)であった(図2)。
DORが6ヵ月以上であったのはPembro+SOC群で70.3%、プラセボ+SOC群で61.4%、9ヵ月以上であったのはPembro+SOC群で58.4%、プラセボ+SOC群で51.1%であった。
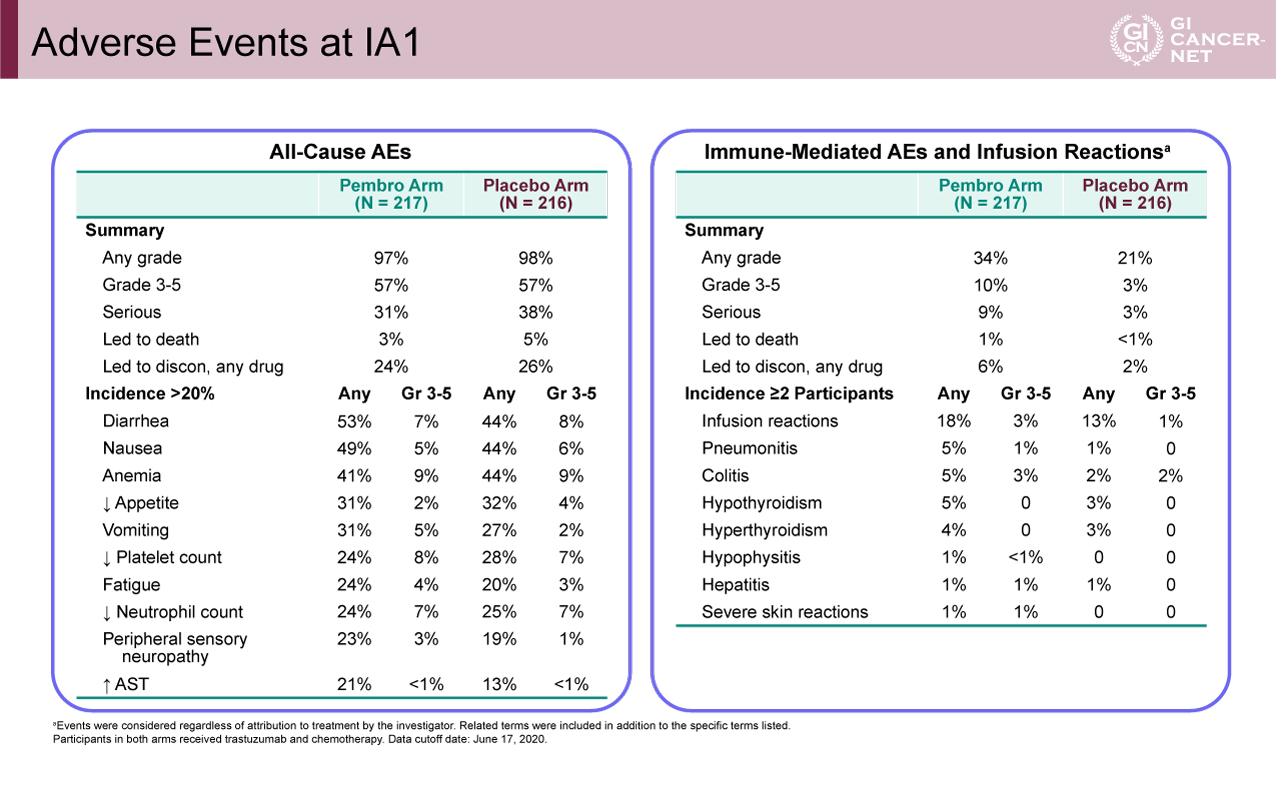
Grade 3-5の有害事象は、Pembro+SOC群では57.1%、プラセボ+SOC群では57.4%であった。死亡に至ったのは3.2% vs. 4.6%であり、いずれかの薬剤を中止したのは24.4% vs. 25.9%であった。安全性に関する新たな問題は認められなかった(図3)。
図2 Confirmed Response at IA1(発表者の許可を得て掲載)
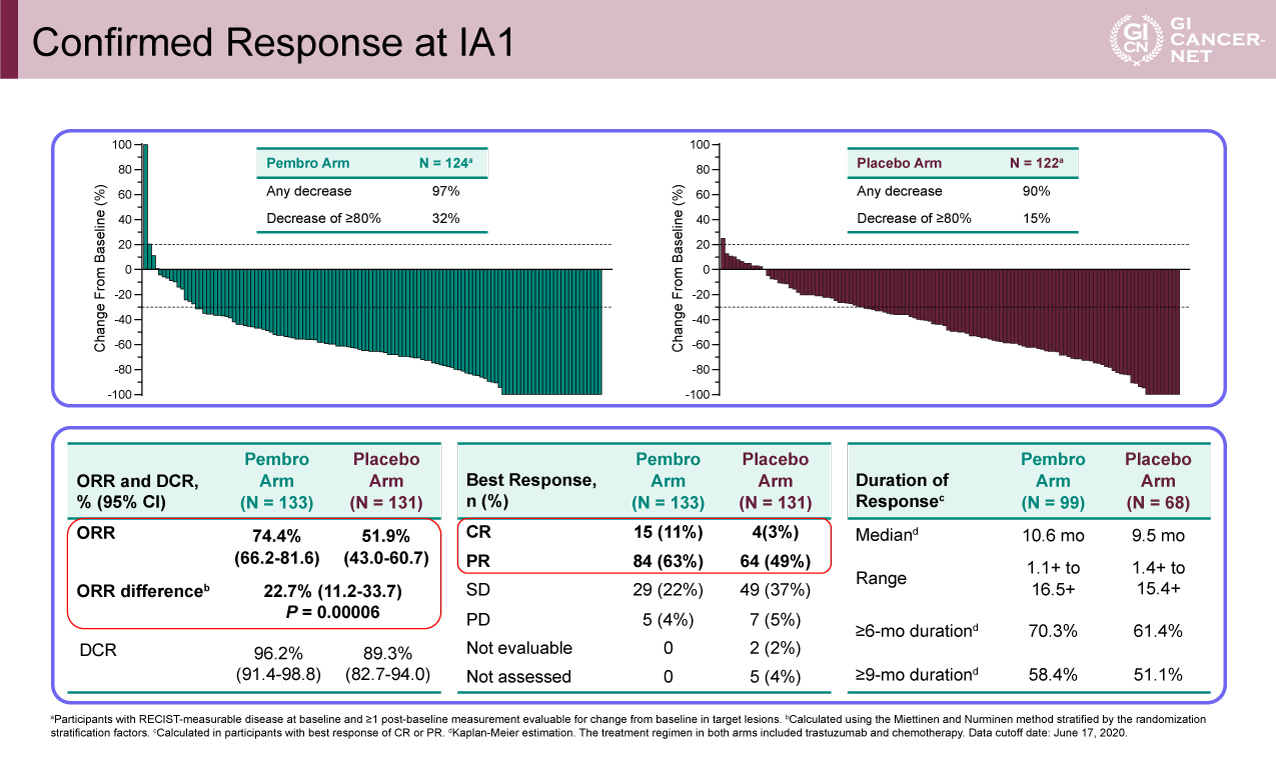
図3 Adverse Events at IA1(発表者の許可を得て掲載)
まとめ
Trastuzumabと化学療法にPembrolizumabを併用するとORRが有意に増加し忍容性も良好であった。
この結果を基に2021年5月5日、米国食品医薬品局(FDA)は、切除不能な局所進行性または転移性のHER2陽性胃腺癌および食道胃接合部腺癌患者に対する1次治療として、PembrolizumabとTrastuzumab、フッ化ピリミジン系薬剤およびプラチナ系薬剤を含む化学療法との併用を迅速承認した。
HER2陽性胃癌に対して免疫チェックポイント阻害剤の併用療法が標準治療として導入される可能性があり、今後の最終解析の公表が待たれる。
(レポート:埼玉医科大学国際医療センター 消化器腫瘍科 福元 剛)
Reference
1) Janjigian YY, et al.: Lancet Oncol. 21(6): 821-831, 2020[PubMed]
関連サイト
・KEYNOTE-811試験[ClinicalTrials.gov]
・CheckMate 649試験[学会レポート][ClinicalTrials.gov]
・ATTRACTION-4試験[学会レポート][ClinicalTrials.gov]
・MSKCC試験[学会レポート][ClinicalTrials.gov]
・Ni-HIGH試験[UMIN-CTR]
・DESTINY-Gastric03試験[ClinicalTrials.gov]
加藤 健先生
国立がん研究センター中央病院 頭頸部・食道内科 科長