獲得耐性遺伝子パターンと腫瘍増悪後の生存期間:第III相PARADIGM試験の探索的バイオマーカー解析の報告
Acquired gene alteration patterns and post-progression survival: PARADIGM study analysis
Hiroyuki Uetake, et al.
監修コメント
PARADIGM試験はJAMAで本体研究の結果が報告され1)、その後Nat Medでバイオマーカー解析の結果が報告されている2)。本邦の大腸癌治療ガイドラインで示されているnon-MSI、RAS/BRAF野生型、左側原発の症例に対してmFOLFOX6+Panitumumab(Pani)がmFOLFOX6+Bevacizumab(Bev)よりもOSが有意に良好であることが確認された結果であった。
今回は、腫瘍増大に獲得される耐性遺伝子異常と増悪後の予後の相関等が解析され報告された。抗EGFR抗体薬治療の耐性機構にはさまざまな獲得遺伝子異常が関与することが明らかとなっており、その獲得耐性遺伝子異常が予後にどのような影響を与えるのか、現在の日常臨床において参考となる解析結果である。
抗EGFR抗体薬のPani治療群では、RTK/RAS経路の異常が最も多いことが報告され、その異常と予後が短いことが確認されたが、これまでにも同様の報告がされている知見である。また、血管新生阻害薬であるBev治療群において、その後の予後を予測するバイオマーカーとしてCIMPが報告された。CIMPはゲノムワイドなプロモーター領域CpG islandのメチル化異常であり、大腸癌発生にかかわっている。さらに、BRAF変異と関連し、CIMPは予後不良因子となりうることも示されている。血管新生阻害薬治療の症例でCIMP陽性であると予後が不良であることが想像されるが、BEV耐性機構としてどれくらいかかわっているのか、メカニズムを含めた探索が必要であろう。
本研究結果から、多くの耐性遺伝子異常を獲得してしまうとその後の予後が良くない可能性が示されている。このような症例に対して予後を改善するための新規薬剤、レジメンの開発が重要であろう。さらに、大腸癌治療においてリキッドバイオプシー検査が有用であることは明らかであるが、どのタイミングで検査を実施し、結果に基づいてどのような介入を行うべきなのか、臨床的有用性を確立していくことが重要である。
(聖マリアンナ医科大学 臨床腫瘍学講座 主任教授 砂川 優)
PARADIGM試験のバイオマーカー解析:RAS野生型症例におけるPanitumumab vs. Bevacizumab
切除不能進行・再発大腸癌(mCRC)のRAS野生型かつ左側原発症例では、CALGB/SWOG 80405試験・FIRE-3試験を含む6つの無作為化比較試験の統合解析結果から、1次治療における抗EGFR抗体薬(Cetuximab)の有用性が示唆されている3-5)。本邦で実施されたPARADIGM試験は、未治療のRAS野生型mCRCに対して、化学療法と併用する抗EGFR抗体薬(Panitumumab:PAN)と抗VEGF抗体薬(Bevacizumab:BEV)の有効性を比較した無作為化第III相試験であり、mFOLFOX6にPANを追加することで、BEVと比較してOSの有意な改善を認めた。本試験の結果は2022年の米国臨床腫瘍学会(ASCO)のPlenary Sessionで報告され、その後JAMAで発表された1)。
本試験では探索的バイオマーカー研究として、治療耐性を評価する目的でcell-free DNA(cfDNA)の測定が行われた(ベースラインとPD判定された後の計2回)。ベースラインcfDNAの遺伝子異常に基づいて薬剤を選択することでOSが改善する可能性が示唆され、この結果は2024年にNature Medicineで報告された2)。今回のASCOでは、PD判定後のcfDNA変化がPD後の生存期間に及ぼす影響について報告された。
治療前・PD後の遺伝子プロファイル比較とPost-Progression Survivalの解析
本バイオマーカー研究では、PARADIGM試験に参加した解析対象のうち、バイオマーカー研究の同意を得られ、治療前・PD後ともに同種類のcfDNA検査を行い、かつ、解析可能な血漿検体がある患者を対象とした。PD判定された症例をPD集団とし、本解析に用いた。cfDNAの検出にはPlasmaSELECT™-R 91(PGDx社)を用いた。DNA標的はmCRCの90種類の遺伝子変異、26種類の遺伝子増幅、3種類の遺伝子再構成、マイクロサテライト不安定性であった。PAN群、BEV群それぞれのcfDNAプロファイルの解析を行った。
Post-Progression Survival(PPS)は、PDから死亡までの期間と定義された。OS、PPSを獲得耐性遺伝子パターン毎に比較した。
PAN群のRTK/RAS変化は短いOS、PPSと相関し、BEV群のCIMP変化は短いOS、PPSと相関する
PARADIGM試験に登録された802例のうち、390例がPDにより治療を中止し、そのうち276例が治療前・PD後のcfDNAが評価可能であった(PAN群126例、BEV群150例)。
PD集団では、PAN群とBEV群を比較したところOSに差を認めなかった(OS中央値26.3ヵ月 vs. 28.0ヵ月、HR=1.02、95%信頼区間[CI]0.80-1.31)。PPSにおいても有意差を認めなかった(PPS中央値15.8ヵ月 vs. 17.7ヵ月、HR=0.99、95% CI: 0.77-1.27、p=0.924)。
1つ以上の獲得耐性遺伝子異常を認めた症例はPAN群で69%、BEV群で78%であった。PAN群ではRTK/RAS経路の異常が最も多く(44%)、次いでDDR(26%)、CIMP(21%)であった。BEV群でも同様にRTK/RAS異常が多く(43%)、次いでCIMP(29%)、DDR(23%)であった。
獲得遺伝子異常が多いと、PPSはより短縮する傾向であった(PAN群:遺伝子異常数0/1/≧2でそれぞれ19.1/13.0/14.5ヵ月、BEV群:遺伝子異常数0/1/≧2でそれぞれ18.9/18.6/16.4ヵ月)(図1)。
PAN群でRTK/RASの遺伝子異常を2つ以上認めた症例は27%であり、BEV群の10%よりも多かった。PAN群においてRTK/RAS異常がある症例は、ない症例と比較してPPSが有意に短かった(PPS中央値:13.2ヵ月 vs. 18.9ヵ月、HR=1.88、95% CI: 1.28-2.76、p=0.001)(図2)。さらに、OSも同様の結果であった(OS中央値:25.5ヵ月 vs. 29.5ヵ月、HR=1.60、95% CI: 1.10-2.33、p=0.013)(図3)。
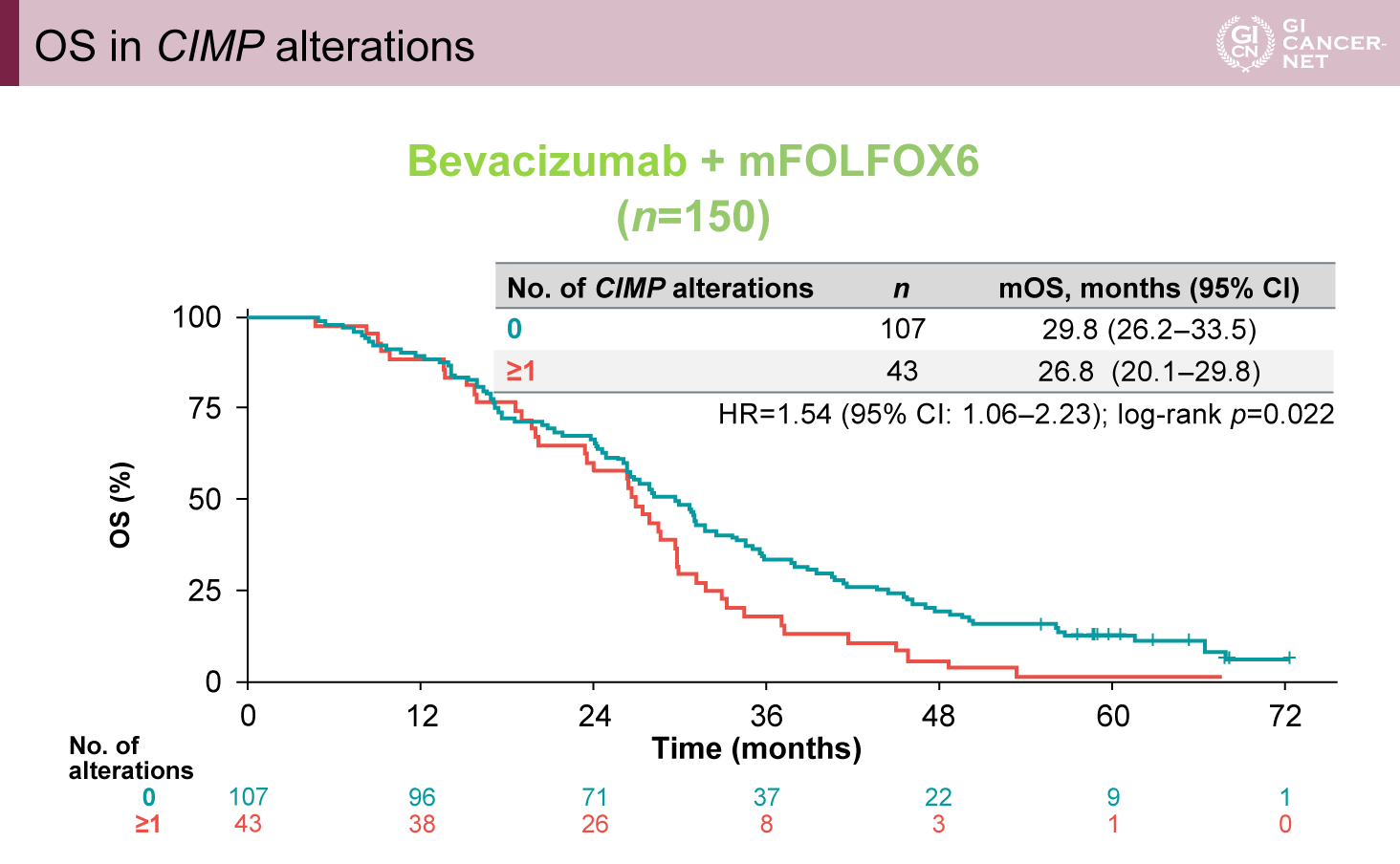
BEV群では28.7%の症例でCIMPの異常を認め、PAN群(20.6%)よりも多かった。BEV群においてCIMP異常がある症例は、ない症例と比較してPPSが有意に短かった(PPS中央値:14.9ヵ月 vs. 18.6ヵ月、HR=1.58、95% CI: 1.09-2.29、p=0.015)(図4)。さらに、OSも同様の結果であった(OS中央値:26.8ヵ月 vs. 29.8ヵ月、HR=1.54、95% CI: 1.06-2.33、p=0.022)(図5)。
図1 Co-occurrence of acquired alterations may predict shorter PPS(発表者の許可を得て掲載)
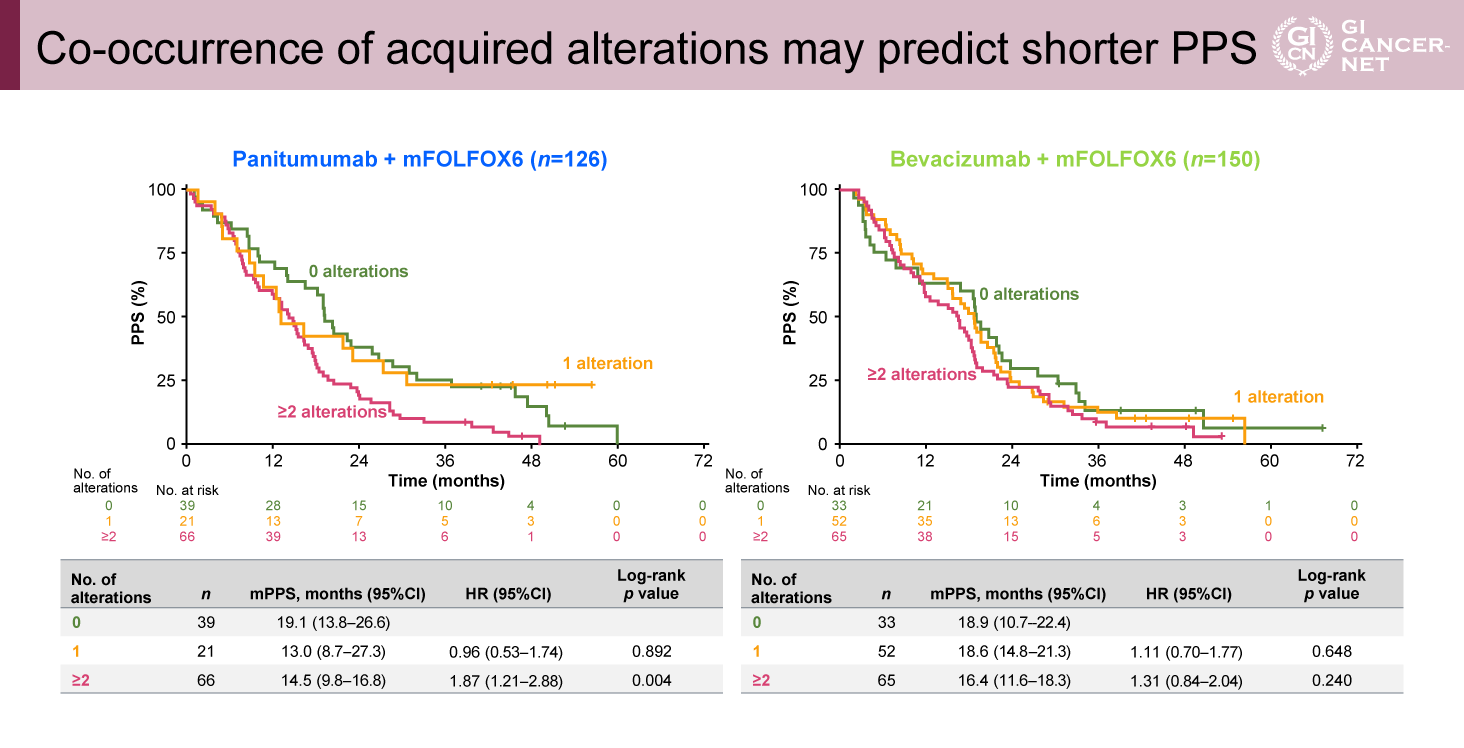
図2 Acquired RTK/RAS alterations and PPS(発表者の許可を得て掲載)
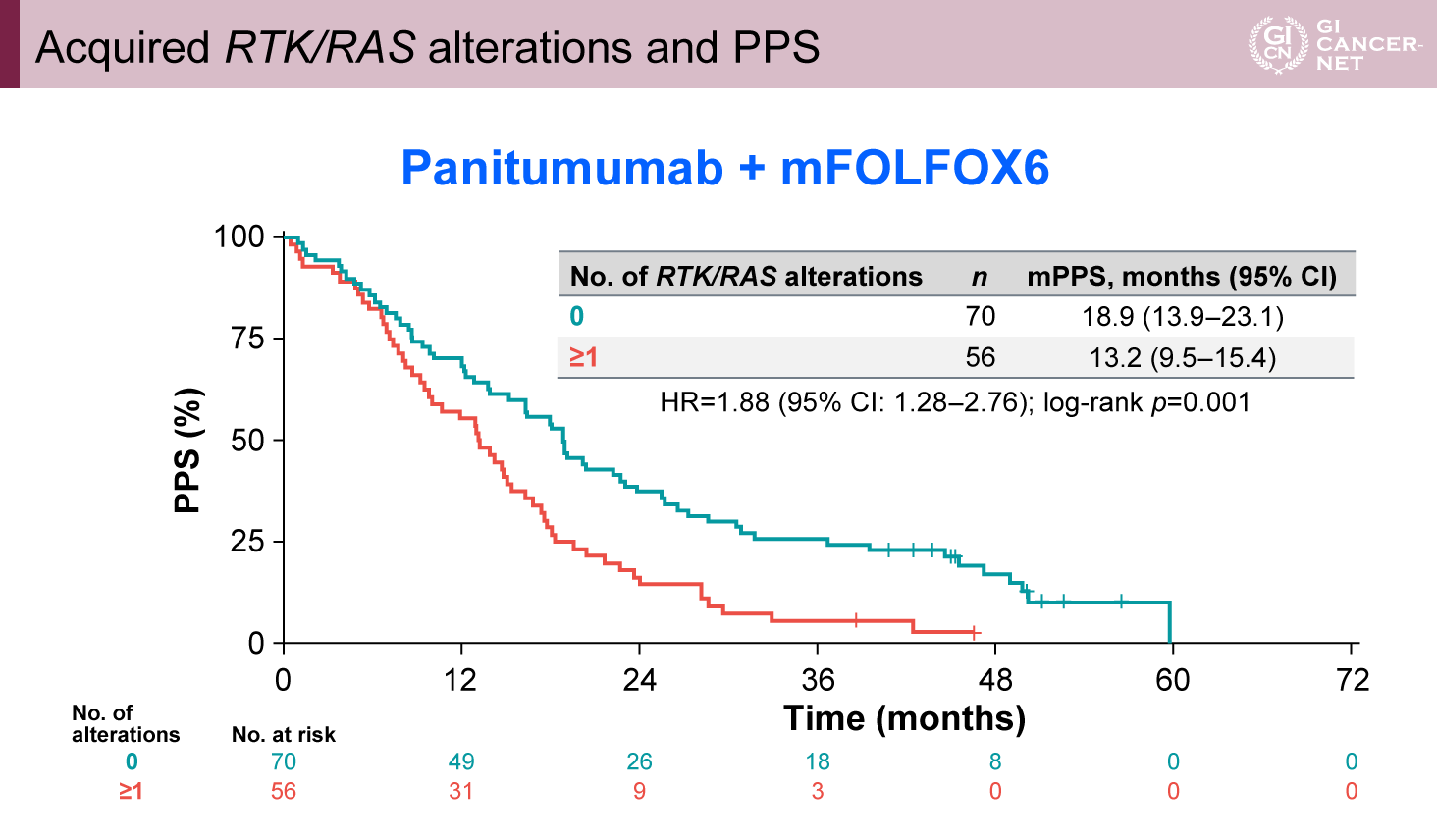
図3 OS in RTK/RAS alterations(発表者の許可を得て掲載)
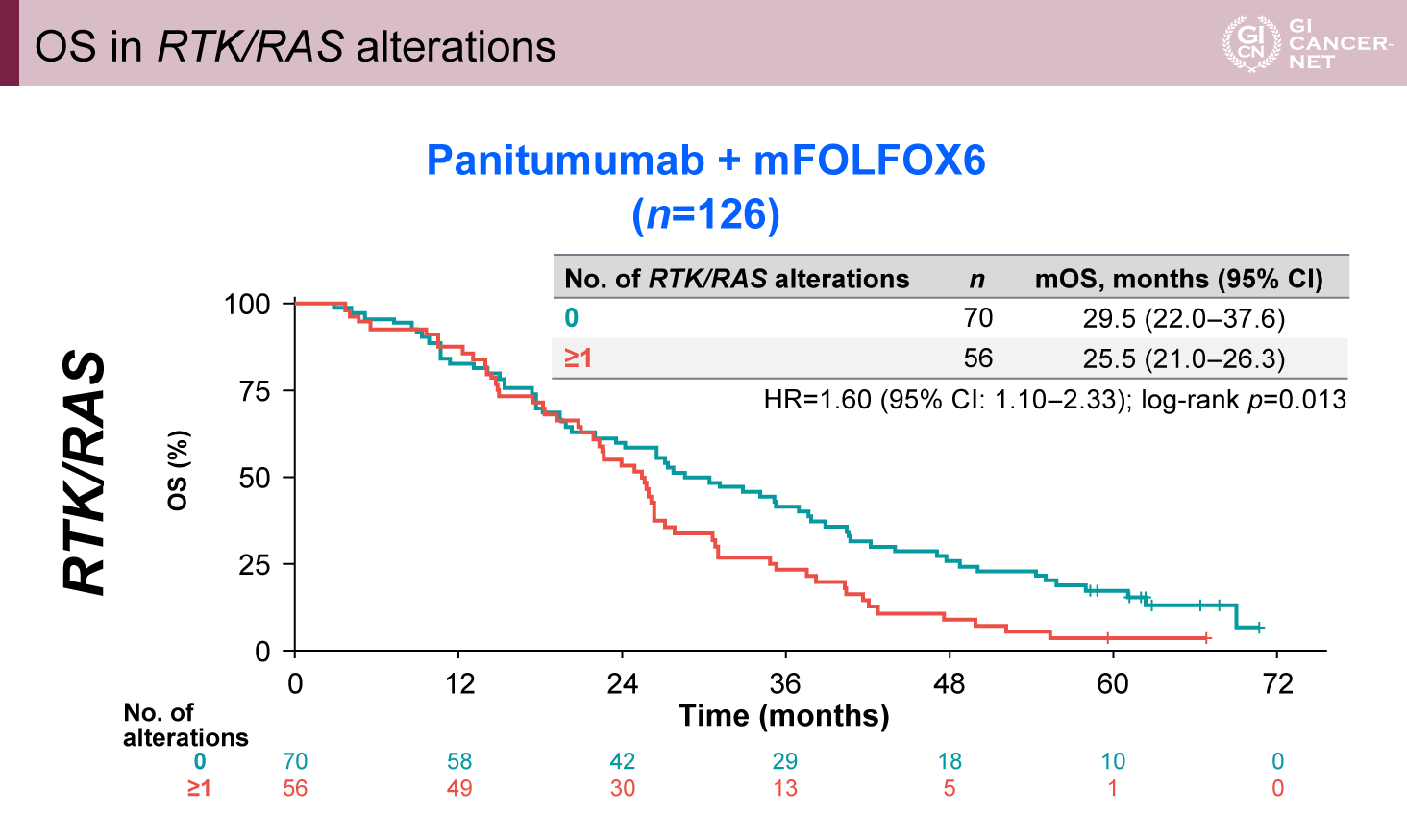
図4 Acquired CIMP alterations and PPS(発表者の許可を得て掲載)
図5 OS in CIMP alterations(発表者の許可を得て掲載)
まとめ
mFOLFOX6にPANもしくはBEVを併用して治療したmCRC症例において、いくつかの種類の細胞シグナル関連遺伝子の変化は、PD後の短い生存期間に関連していることが示唆された。特に、PAN群でRTK/RAS経路の遺伝子異常が、BEV群でCIMP経路の遺伝子異常が多く、それぞれが短い生存期間と相関していた。これらの知見はmCRCの後治療の戦略を考える際の一助となりうる。
(レポート:聖マリアンナ医科大学 臨床腫瘍学講座 小川 和起)
References
1) Watanabe J, et al.: JAMA. 329(15): 1271-1282, 2023 [PubMed]
2) Shitara K, et al.: Nat Med. 30(3): 730-739, 2024 [PubMed]
3) Venook AP, et al.: JAMA. 317(23): 2392-2401, 2017 [PubMed]
4) Stintzing S, et al.: Lancet Oncol. 17(10): 1426-1434, 2016 [PubMed]
5) Arnold D, et al.: Ann Oncol. 28(8): 1713-1729, 2017 [PubMed]
関連サイト
・PARADIGM試験[学会レポート(ASCO)][学会レポート(ASCO GI)][ClinicalTrials.gov][UMIN-CTR]
・CALGB/SWOG 80405試験[論文紹介][学会レポート][ClinicalTrials.gov]
・FIRE-3試験[座談会][学会レポート(ESMO)][学会レポート(ASCO)][論文紹介][ClinicalTrials.gov]
砂川 優先生
聖マリアンナ医科大学 臨床腫瘍学講座 主任教授