切除不能食道扁平上皮癌に対する根治的化学放射線療法後のAtezolizumab±Tiragolumab療法に関する無作為化第III相試験:SKYSCRAPER-07
SKYSCRAPER-07: A phase III, randomised study of atezolizumab with or without tiragolumab in patients with unresectable esophageal squamous cell carcinoma that has not progressed following definitive concurrent chemoradiotherapy
Ian Chau, et al.
監修コメント
すでに、さまざまな癌種で免疫チェックポイント阻害剤(ICI)を含む化学療法が標準治療となって久しい。食道癌においても、進行再発例に対する標準治療と位置づけられており、化学療法との併用やICI同士の併用療法などが一般的に用いられている。化学放射線療法は、局所進行食道癌に対する標準治療のひとつであり、切除可能症例に対しては食道温存を希望する患者への治療オプションとして、切除不能局所進行例に対しては根治が期待できる標準治療と位置づけられている。局所進行肺癌では、化学放射線療法後のメンテナンスとして、プラセボに比較してDurvalumabの投与が生存期間を延長したとするPacific試験の結果が報告され、化学放射線療法とICIの同時併用あるいは逐次併用療法が多くの癌種で検討されている。食道癌においては3つの第III相試験が行われており、切除不能局所進行食道癌(腺癌・扁平上皮癌含む)に対して、化学放射線療法にPembrolizumabを同時併用することをプラセボ併用と比較するKEYNOTE-975試験、局所進行食道扁平上皮癌に対して、化学放射線療法にDurvalumabを同時併用することをプラセボ併用と比較するKUNLUN試験、そして、局所進行食道扁平上皮癌(切除可能・切除不能含む)に対して、化学放射線療法を行った後に病勢進行を認めなかった症例に対するメンテナンス治療として、プラセボ+プラセボ群、PD-L1抗体であるAtezolizumab(atezo)とTIGIT抗体であるTiragolumab(tira)を併用する群、atezo+プラセボ群の3つの治療群を比較したSKYSCRAPER-07試験である。肺癌におけるPacific試験のように、ICIの逐次併用を評価するとともに、TIGIT抗体であるtiraの併用効果を検証するデザインとなっている。特徴的なのは、まず、プラセボ+プラセボ群に対するatezo+tira群の研究者判定PFSにおける優越性を検証し、検証されたときのみOSでの検証に進み、そこでも優越性が示された場合に、プラセボ+プラセボ群に対するatezo+プラセボ群のOSでの優越性を検証する、という統計デザインになっているところである。このようなデザインは、αを個々の検定に配分しないため、ポジティブにできる確率を高めるというメリットがある一方、最初の検定でネガティブだった場合、その後のエンドポイントは検定すらされない、というデメリットがある。
今回の結果は、まさにそのデメリットが顕著に出た結果であった。まず、化学放射線療法後にICIを行うということについては、atezo+プラセボ群をみると、食道癌においても有効性は明らかであると思われたが、TIGIT抗体を併用すると、むしろアウトカムが悪くなるという結果であった。進行再発例に対して行われたSKYSCRAPER-08試験では、化学療法群に対して化学療法+atezo+tira群が有意差をもって生存期間の延長効果を示したが、化学療法+atezo群が設定されておらず、tira上乗せの意義はわからなかった。rPIIであるMORPHEUS-EC試験では少数例で3群が比較されたが、tiraの上乗せは多少ではあるが、邪魔はしていないという印象であった。今回はtiraを加えることで、atezo+プラセボ群で示されたOSのHR=0.69が、atezo+tira群で0.91と悪化、PFSでも同様の結果であり、化学放射線療法後に限っていえば、むしろtiraがネガティブに働いているというのが今回の結果であった。切除不能局所進行食道扁平上皮癌に対して化学放射線療法を行った後、病勢進行しない症例に対してatezoを12カ月行ったTENERGY試験では、完全奏効割合42%、生存期間中央値31カ月と報告されている。Stage IVA症例が主なので評価が難しいが、atezo単剤の逐次使用については、良好なアウトカムにつながるという印象である。
Tira併用がネガティブについては異論ないが、問題は、atezo単剤の逐次使用が良好な結果を示したにもかかわらず、試験デザインのためにポジティブと結論できない点である。承認申請について現在企業は検討中とされているが、一般的には前もって設定された規準がクリアされていない場合には、承認される見込みは極めて少ない。KEYNOTE-181試験のように、前もって設定されたエンドポイントがことごとくネガティブであったにもかかわらず、後付けで扁平上皮癌かつCPS 10以上の集団でのみPembrolizumabが承認されたケースもあるが、今回のケースがどうなるか、今後の動向が注目される。
(コメント・監修:国立がん研究センター中央病院 消化管内科/頭頸部・食道内科 科長
加藤 健)
食道癌治療における背景
切除不能局所進行食道扁平上皮癌(ESCC)に対する標準治療の一つは根治的化学放射線療法(dCRT)である1,2)。しかしその再発率は40~60%で5年生存割合は10~30%にとどまる3-5)。また緩和的治療においては従来の化学療法に抗PD-1抗体薬を併用することで、有意な生存期間延長効果をもたらすことが報告されてきた6-8)。一方で、化学放射線療法により腫瘍微小環境が免疫活性化されることで後治療における免疫療法効果を高める可能性がある9)。
TIGIT(T-cell immunoreceptor with Ig and ITIM domains)は、活性化T細胞・NK細胞・制御性T細胞に発現する免疫抑制受容体であり、ESCCを含むさまざまな癌種で発現が報告され免疫抑制に関与すると言われている10-13)。Tiragolumab(tira)は抗TIGITヒト化モノクローナル抗体で、Atezolizumab(atezo)などのPD-L1阻害薬との併用により抗腫瘍免疫反応を強める可能性がある14-16)。Tiraとatezoの併用は複数腫瘍に対する抗腫瘍効果を示しており17)、進行・転移食道癌に関するSKYSCRAPER-08試験やMORPHEUS-EC試験18)においても報告がなされている。こうした背景から、ESCCに対するdCRT後の免疫療法の有効性を評価する本試験が計画された。
SKYSCRAPER-07の試験デザイン
本試験は国際共同第III相二重盲検無作為化プラセボ対照試験として2020年9月28日から2023年8月31日の間にアジア、欧州、北米、南米などの計28カ国166施設で登録・実施された。対象はステージII-IVAまたは鎖骨上リンパ節転移のみのIVBの局所進行切除不能ESCCと診断され、dCRT後に病勢進行を認めないECOG PS 0-1かつPD-L1評価が可能な患者が適格とされた。層別化因子には、地域(アジア/その他)、治療前ステージII/III/IV、PD-L1発現(TAP score<10%/≧10%)が設定され、tira+atezo群(tira 600mg、IV、Q3W + atezo 1,200mg、IV、Q3W):atezo+プラセボ(pbo)群(atezo 1,200mg、IV、Q3W + pbo、IV、Q3W):pbo+pbo群(pbo、IV、Q3W + pbo、IV、Q3W)の3群に1:1:1で割り付けられた。各群とも病勢進行、許容外の有害事象もしくは最大17サイクルまで治療継続された。主要評価項目としてtira+atezo群 vs. pbo+pbo群のINV-PFS/OSとatezo+pbo群 vs. pbo+pbo群のOSが設定された。副次評価項目としてtira+atezo群 vs. pbo+pbo群のIRF-PFS、atezo+pbo群 vs. pbo+pbo群のINV-PFS/IRF-PFS、tira+atezo群 vs. atezo+pbo群のINV-PFS/IRF-PFS/OS、そして安全性が設定された(図1)。
なお評価は階層的検定で実施され、主要評価項目であるtira+atezo群 vs. pbo+pbo群のINV-PFSの統計学的有意差が達成された場合にそのOSを評価し、統計学的有意差が達成された場合にatezo+pbo群 vs. pbo+pbo群のOSを評価し、さらにその統計学的有意差が達成された場合に副次評価項目であるtira+atezo群 vs. atezo+pbo群のOSが評価された。
図1 SKYSCRAPER-07: a global, phase III, randomized, double-blind, placebo-controlled study(発表者の許可を得て掲載)

Tiragolumabの上乗せ効果は認められなかったがAtezolizumab単剤の有効性が示唆された
計760例がtira+atezo群:atezo+pbo群:pbo+pbo群の3群に1:1:1に割り付けられた。年齢、性別、人種、ECOG PSは各群間でバランスがとれていた。PD-L1:TAP≧10%の割合は、tira+atezo群/atezo+pbo群/pbo+pbo群でそれぞれ36.6%/36.0%/36.0%であった(表1)。
Tira+atezo群 vs. pbo+pbo群の比較において、tira+atezo併用療法の有効性は示されなかった。INV-PFS中央値はそれぞれ20.8カ月(95% CI: 13.9-28.8カ月)vs. 16.6カ月(95% CI: 11.2-19.4カ月)であり、両群間に有意差を認めなかった(HR=0.82[95% CI: 0.65-1.03]、p=0.0947)。そのため、以降は探索的統計解析による評価が行われた。OS中央値は、それぞれ38.6カ月(95% CI: 28.8カ月-NE)vs. 36.4カ月(95% CI: 25.8カ月-NE)であり、両群間に有意差を認めなかった(HR=0.91[95% CI: 0.70-1.18]、p=0.4772)(図2)。
Atezo+pbo群 vs. pbo+pbo群の比較において、atezo単剤療法の有効性が示唆された。INV-PFS中央値はそれぞれ29.1カ月(95% CI: 19.0-36.3カ月)vs. 16.6カ月(95% CI: 11.2-19.4カ月)であり、両群間に有意差を認めた(HR=0.74[95% CI: 0.58-0.93]、p=0.0113)。OS中央値は、それぞれNE vs. 36.4カ月(95% CI: 25.8カ月-NE)であり、両群間に有意差を認めた(HR=0.69[95% CI: 0.52-0.91]、p=0.0085)(図3)。
Tira+atezo群 vs. atezo+pbo群の比較において、tiraの上乗せ効果は示されずOSはむしろ悪化を示唆した。INV-PFS中央値はそれぞれ20.8カ月(95% CI: 13.9-28.8カ月)vs. 29.1カ月(95% CI: 19.0-36.3カ月)であり、両群間に有意差を認めなかった(HR=1.13[95% CI: 0.89-1.44]、p=0.3223)。OS中央値は、それぞれ38.6カ月(95% CI: 28.8カ月-NE)vs. NEであり、両群間に有意差を認めた(HR=1.36[95% CI: 1.03-1.80]、p=0.0314)(図4)。
Tira+atezo併用療法とatezo単剤療法の忍容性は、併用療法においてやや毒性が増すものの概ね良好であった。Grade 3-4の治療関連有害事象の発現率はtira+atezo群/atezo+pbo群/pbo+pbo群でそれぞれ16.1%/9.6%/9.6%であった。有害事象による治療中止割合は、それぞれ9.1%/6.8%/4.0%であった。治療関連死割合は、それぞれ1.2%/0.8%/1.6%であった(表2)。
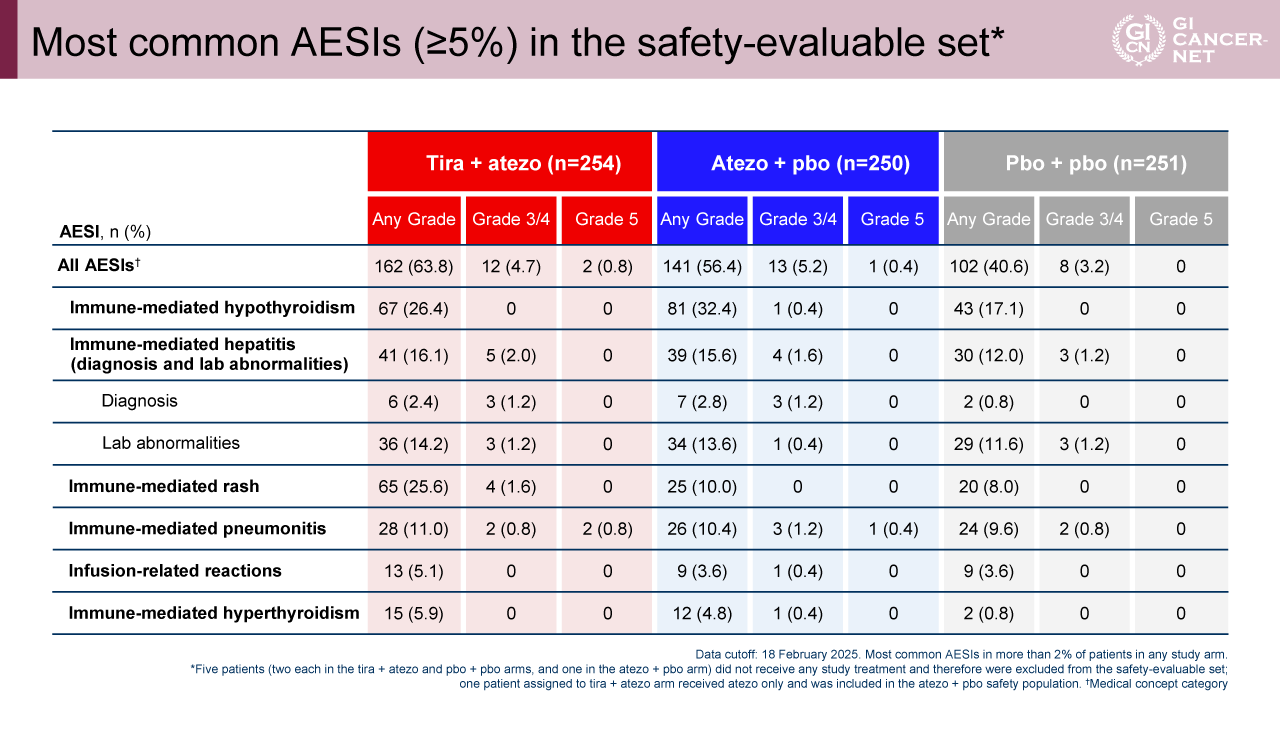
免疫関連有害事象については、grade 3以上の重篤な有害事象の発生割合は概ね5%未満であり、主なイベントは甲状腺機能低下症、肝炎、皮疹および肺炎などであった。Tira+atezo vs. atezo+pboにおいて、甲状腺機能低下症(26.4% vs. 32.4%)、肝炎(16.1% vs. 15.6%)、皮疹(25.6% vs. 10.0%)、肺臓炎(11.0% vs. 10.4%)が代表的であったが、いずれも管理可能であり、grade 3-4の発生率は両群でほぼ同等(4.7% vs. 5.2%)であった。これらの有害事象は既知の免疫チェックポイント阻害薬関連毒性の範囲内であり、tiraを追加することによる新たな安全性の懸念は認められなかった(表3)。
表1 Baseline characteristics(発表者の許可を得て掲載)
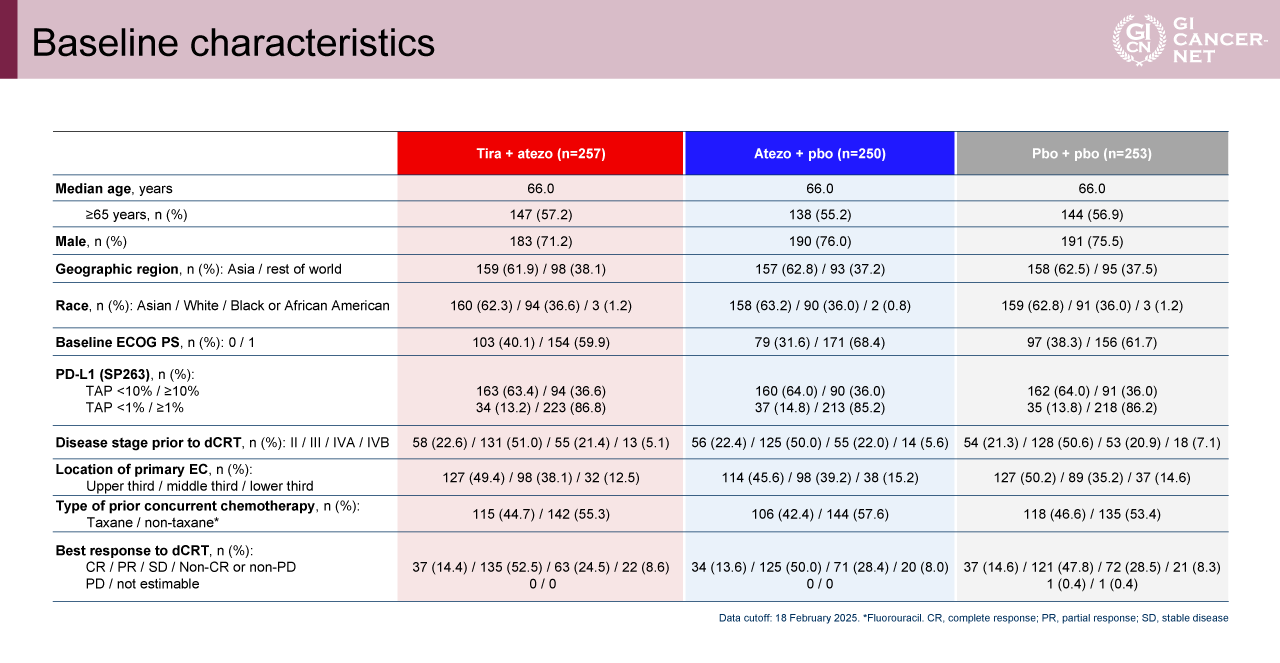
図2 INV-PFS and OS in the tira + atezo vs pbo + pbo arms(発表者の許可を得て掲載)
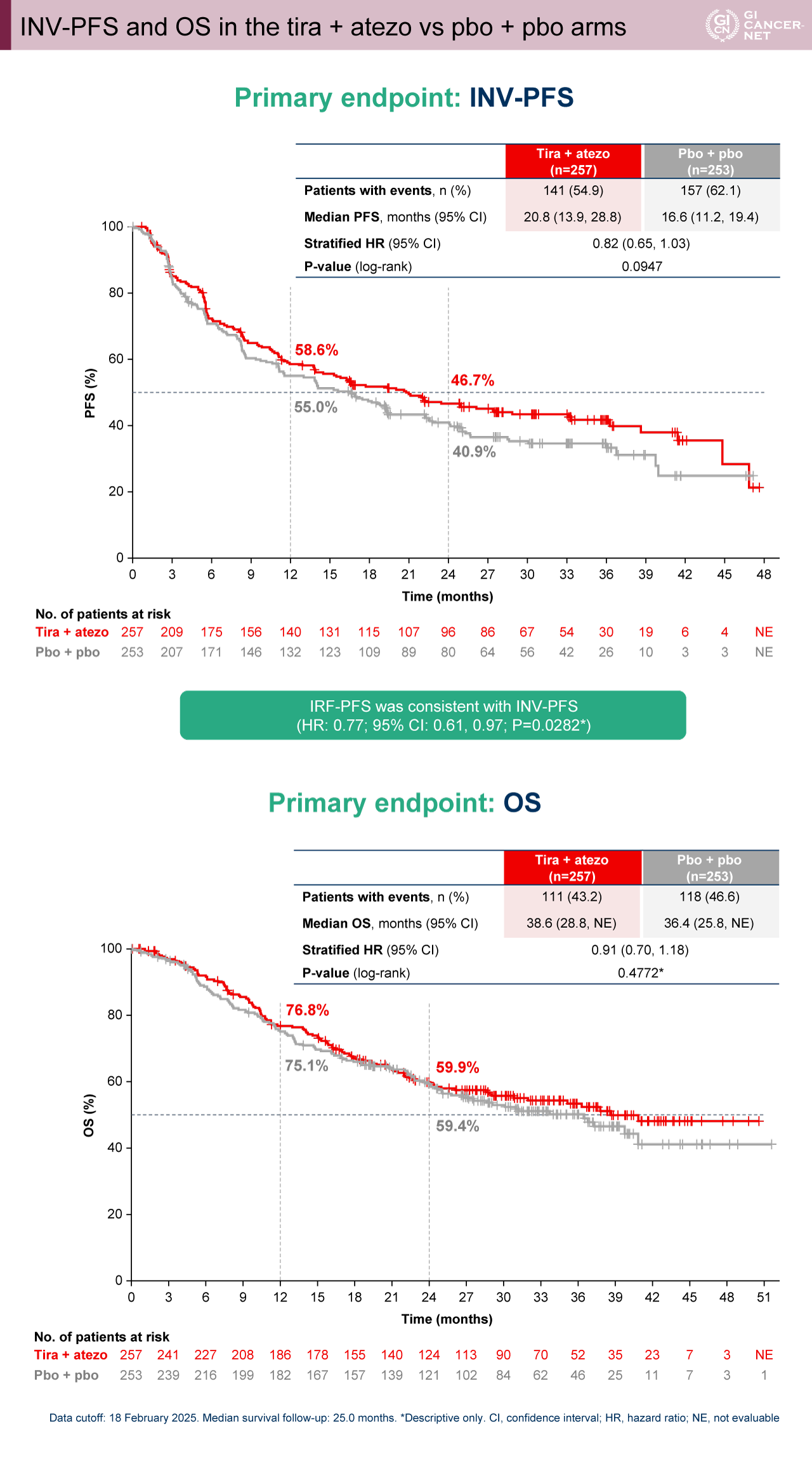
図3 INV-PFS and OS in the atezo + pbo vs pbo + pbo arms(発表者の許可を得て掲載)
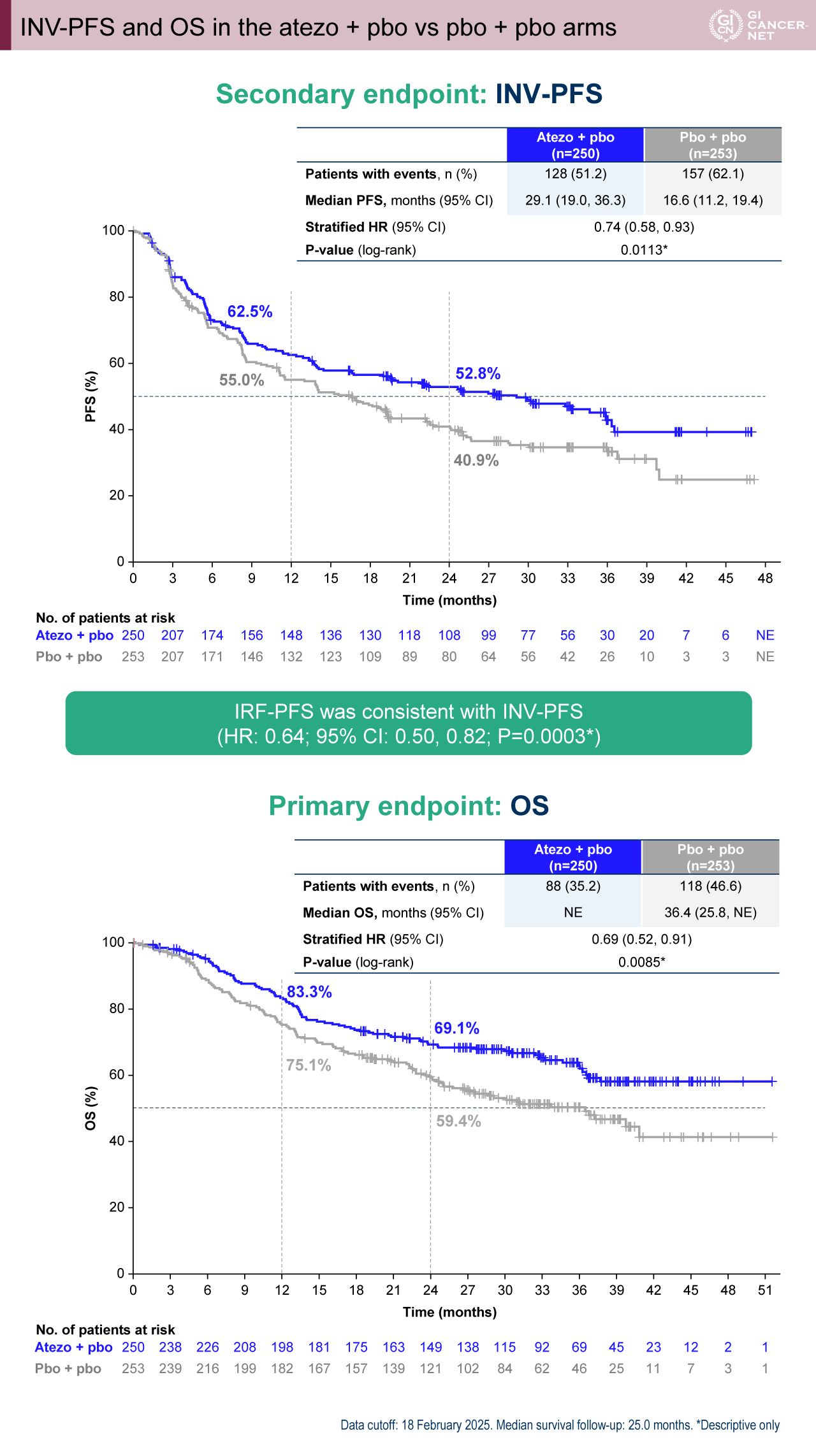
図4 INV-PFS and OS in the tira + atezo vs atezo + pbo arms(発表者の許可を得て掲載)
表2 Safety summary(発表者の許可を得て掲載)
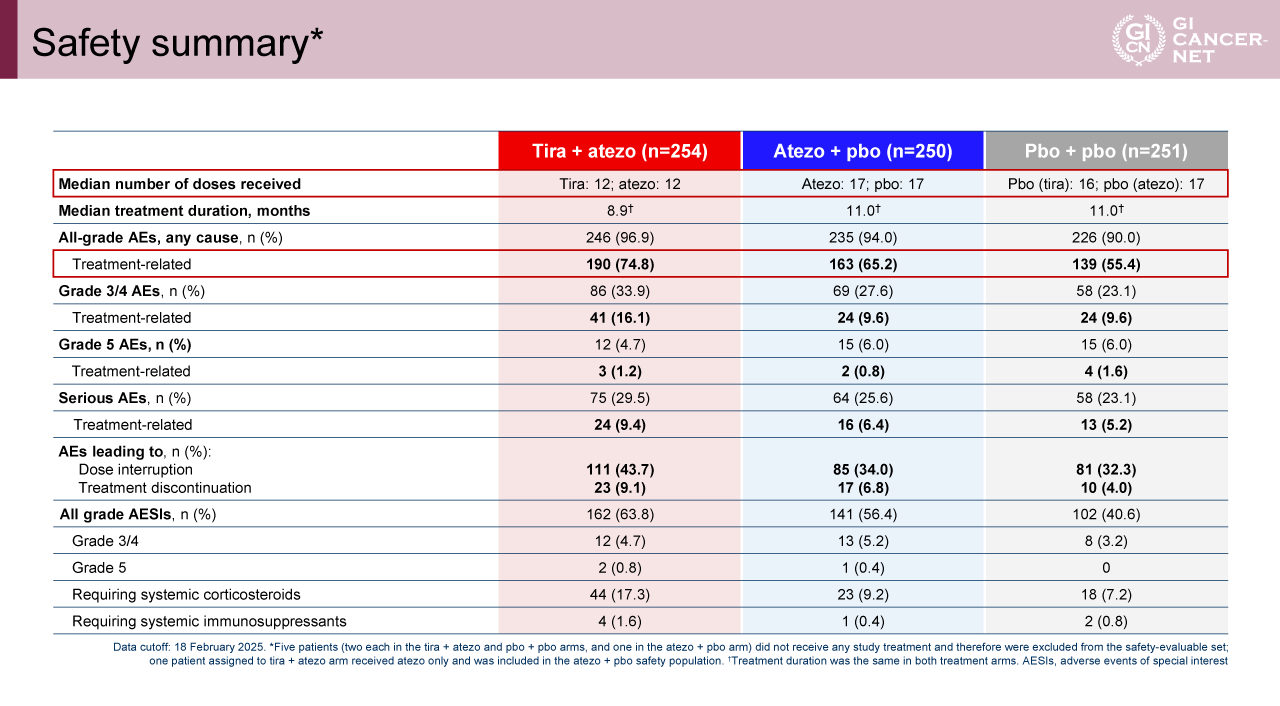
表3 Most common AESIs (≥5%) in the safety-evaluable set(発表者の許可を得て掲載)
結論
局所進行ESCCにおいて、dCRT後のtira+atezo療法はPFSおよびOSを改善しなかった。一方で、探索的統計解析ではあるがatezo単剤療法はdCRT後の治療として初めてPFSおよびOSを改善した。
(レポート:国立がん研究センター中央病院 消化管内科 亀石 眞)
References
- 1) Obermannová R, et al.: Ann Oncol. 33(10): 992-1004, 2022 [PubMed]
- 2) Chinese guidelines for diagnosis and treatment of esophageal carcinoma 2018 (English version): Chin J Cancer Res. 31(2): 223-258, 2019 [PubMed]
- 3) Pennathur A, et al.: Lancet. 381(9864): 400-412, 2013 [PubMed]
- 4) Gwynne S, et al.: Clin Oncol. 23(3): 182-188, 2011 [PubMed]
- 5) Xie R, et al.: Front Oncol. 14: 1303068, 2024 [PubMed]
- 6) Sun JM, et al.: Lancet. 398(10302): 759-771, 2021 [PubMed]
- 7) Doki Y, et al.: N Engl J Med. 386(5): 449-462, 2022 [PubMed]
- 8) Xu J, et al.: Lancet Oncol. 24(5): 483-495, 2023 [PubMed]
- 9) van den Ende T, et al.: Biochim Biophys Acta Rev Cancer. 1874(1): 188386, 2020 [PubMed]
- 10) Manieri NA, et al.: Trends Immunol. 38(1): 20-28, 2017 [PubMed]
- 11) Chiang EY, et al.: J Immunother Cancer. 10(4): e004711, 2022 [PubMed]
- 12) Johnston RJ, et al.: Cancer Cell. 26(6): 923-937, 2014 [PubMed]
- 13) Rousseau A, et al.: ESMO Open. 8(2): 101184, 2023 [PubMed]
- 14) Kim TW, et al.: JAMA Oncol. 9(11): 1574-1582, 2023 [PubMed]
- 15) Cho BC, et al.: Lancet Oncol. 23(6): 781-792, 2022 [PubMed]
- 16) Finn RS, et al.: Lancet Oncol. 26(2): 214-226, 2025 [PubMed]
- 17) Wainberg ZA, et al.: ESMO GI. 2021 [Ann Oncol]
- 18) Sun JM, et al.: Lancet Oncol. 2025 (in press) [ASCO GI]
関連サイト
- ・SKYSCRAPER-07試験 [ClinicalTrials.gov]
- ・KEYNOTE-975試験 [ClinicalTrials.gov]
- ・KUNLUN試験 [ClinicalTrials.gov]
- ・SKYSCRAPER-08試験 [ClinicalTrials.gov]
- ・MORPHEUS-EC試験 [ClinicalTrials.gov]
- ・TENERGY試験 [UMIN-CTR]
- ・KEYNOTE-181試験 [ClinicalTrials.gov]

加藤 健 先生
国立がん研究センター中央病院 消化管内科/頭頸部・食道内科 科長