未治療で転移を有する食道扁平上皮癌に対するLenvatinib+Pembrolizumab+化学療法とPembrolizumab+化学療法の無作為化比較第III相試験:LEAP-014試験
Lenvatinib plus Pembrolizumab and Chemotherapy vs Pembrolizumab and Chemotherapy in Untreated Metastatic Esophageal Squamous Cell Carcinoma: The Randomized Phase 3 LEAP-014 Study
Jong-Mu Sun, et al.
監修コメント
すでにさまざまな癌種で免疫チェックポイント阻害剤(ICI)を含む化学療法が標準治療となって久しいが、LEAPシリーズは、経口マルチキナーゼ阻害剤であるLenvatinibを併用してその有効性を高めることを目的に、さまざまな癌種で検討された。Lenvatinibを併用して、免疫を抑制するMDSC(Myeloid-Derived Suppressor Cell)や、レギュラトリーT細胞などを抑えることで、併用するICIの効果が高まることが示されていた。しかし、肝細胞癌(LEAP-012)、子宮頸癌既治療例、腎細胞癌など有効性が示される癌種がある一方で、胃癌(LEAP-015)、肺癌(LEAP-006、LEAP-008)、大腸癌(LEAP-017)、頭頸部癌(LEAP-010)、悪性黒色腫(LEAP-003)などでは、生存期間の延長効果は示されなかった。
LEAP-014の結果は、他癌と同様に、Lenvatinibの併用により、奏効割合は増加するものの、生存期間や、無増悪生存期間は有意な延長を認めなかった。発表では、両群でgrade 3以上の有害事象や、治療終了につながる有害事象の割合は変わらないということであったが、免疫関連有害事象はLenvatinib群で多く報告されている。さらに実際投与を行うと、Lenvatinib群では倦怠感などによる細かい休薬、減量が必要であり、VEGFの阻害を行うことでICIの効果が高まるものの、治療継続に難渋した印象であった。導入化学療法期はFPであれば4サイクル、FOLFOXであれば6サイクルと、Lenvatinib 8mgを併用し、その後メンテナンス期では、プラチナを休薬するものの、Lenvatinibの量が20mgと増量されるプロトコールとなっており、毒性に十分注意を払う必要があった。体の大きさにかかわらず投与量は一律であり、比較的体重の軽いアジア人などで毒性が強く出ていた可能性がある。RegorafenibとNivolumab併用療法のマルチコホート第II相試験も行われたが、毒性の割に有効性が期待できないとして、その後の開発に進んでいない。
化学療法+ICIに対する免疫調整薬としては、他癌種では抗VEGF抗体なども検討されているが、食道癌では、FGFR阻害剤であるFutibatinibが有望な効果を示している。最終的には毒性と効果のバランスが優れているものが生存の延長に寄与するものと推測される
(コメント・監修:国立がん研究センター中央病院 消化管内科/頭頸部・食道内科 科長
加藤 健)
食道癌におけるICI登場後の治療開発状況
切除不能局所進行、または遠隔転移を有する食道癌に対する標準一次治療は、免疫チェックポイント阻害薬(ICI)と化学療法の併用である。従来の化学療法に抗PD-1抗体薬を併用することが、有意な生存期間の延長をもたらすことは過去の試験で示されてきた1-3)。しかしながら全生存期間(OS:中央値12.6-17.0カ月)は依然として十分ではなく、さらなる改善が求められている。
食道癌に先駆けて、他癌種ではICI登場から先の治療開発が進んでいる。腎細胞癌4)や子宮体癌5)では抗PD-1抗体薬のPembrolizumabにVEGF阻害薬であるLenvatinibを併用する治療が、それぞれ一次治療と二次治療以降で承認を獲得しており、従来のICI含有レジメンにLenvatinibの一定の上乗せ効果を期待させる結果であった。さらにはPD-L1 CPS≧1の切除不能進行胃癌・食道胃接合部癌における一次治療として、Lenvatinib+Pembrolizumab+化学療法と、化学療法単独を比較したLEAP-015試験6)では、OSの改善はみられないものの、無増悪生存期間(PFS)と全奏効割合(ORR)の有意な改善を認めた。
このような背景で、切除不能局所進行、または遠隔転移を有する食道癌の標準治療であるICI+化学療法にLenvatinibを併用する意義を検証したのがLEAP-014試験である。
LEAP-014の試験デザイン
本試験は国際共同第III相非盲検無作為化試験として実施された。対象は、アジア、欧州、北米、南米の計25カ国から登録され、18歳以上で既治療がなく、局所進行切除不能、もしくは遠隔転移を有し、病理組織学的に食道扁平上皮癌と診断されたECOG PS 0-1の患者が適格とされた。層別化因子には、地域(東アジア/北米+西欧/その他)、併用化学療法[FP(5-FU+CDDP)/TP(Paclitaxel+CDDP)/mFOLFOX6]、PD-L1発現(CPS≧10/<10)を設定し、Lenvatinib(8mg、PO、QD)+Pembrolizumab(400mg、IV、Q6W)+化学療法(FP or TP、Q3W or mFOLFOX6、Q2W)群と、Pembrolizumab+化学療法群(FP or TP、Q3W or mFOLFOX6、Q2W)に1:1で無作為に割り付けられた(図1)。
図1 Phase 3, LEAP-014 Study Design (NCT04949256)(発表者の許可を得て掲載)
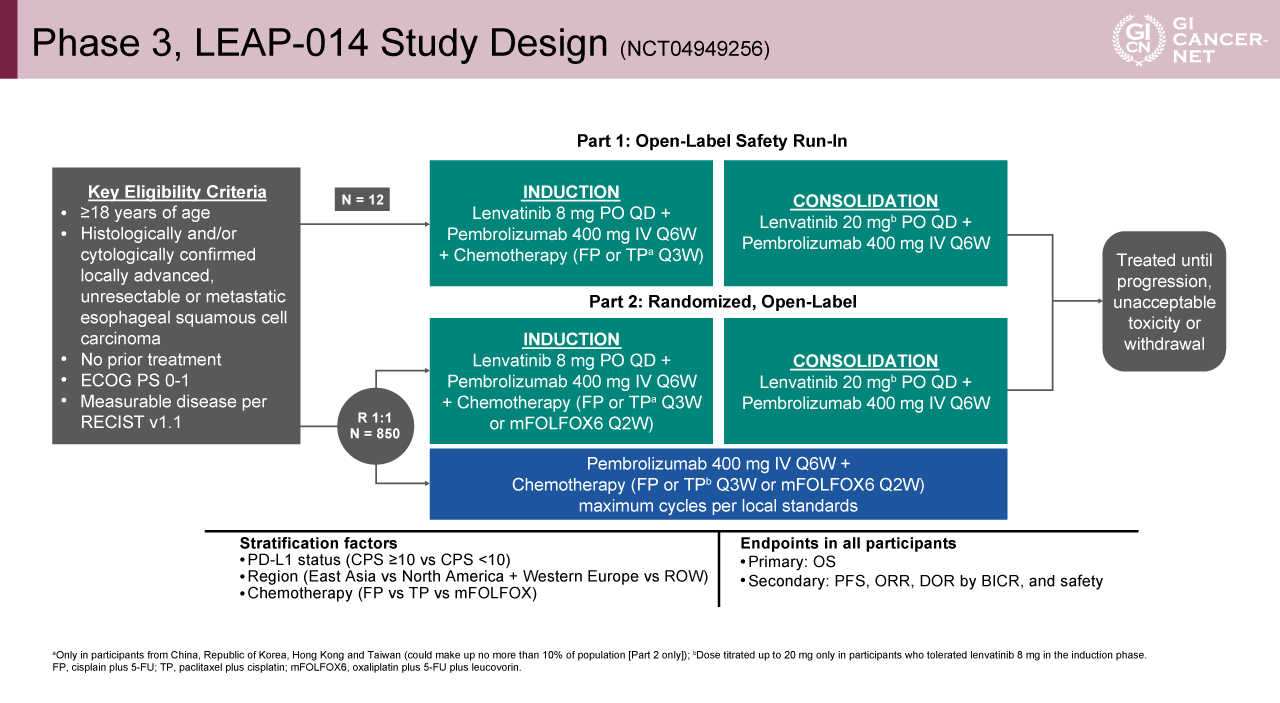
両群とも病勢進行、許容外の有害事象、もしくは患者の同意取り下げのいずれかがあるまで治療を継続した。主要評価項目はITT集団におけるOS、副次評価項目としてPFS、ORR、奏効持続期間(DOR)、そして安全性が設定された。主要解析は全無作為化集団(ITT集団)を対象とし、層別化ログランク検定によりLenvatinib+Pembrolizumab+化学療法併用群が対照群(Pembrolizumab+化学療法)に対して優越性を示すかが検証された。主要評価項目に対する有意水準は、事前に設定された片側α=2.5%(p<0.025)とされた。今回のESMO 2025では、予定された全OSイベント数の約88%(482イベント)に達した時点での第2回中間解析(IA2)の結果が報告された。
食道扁平上皮癌においては従来のPembrolizumab+化学療法へのLenvatinibの上乗せ効果は示されなかった
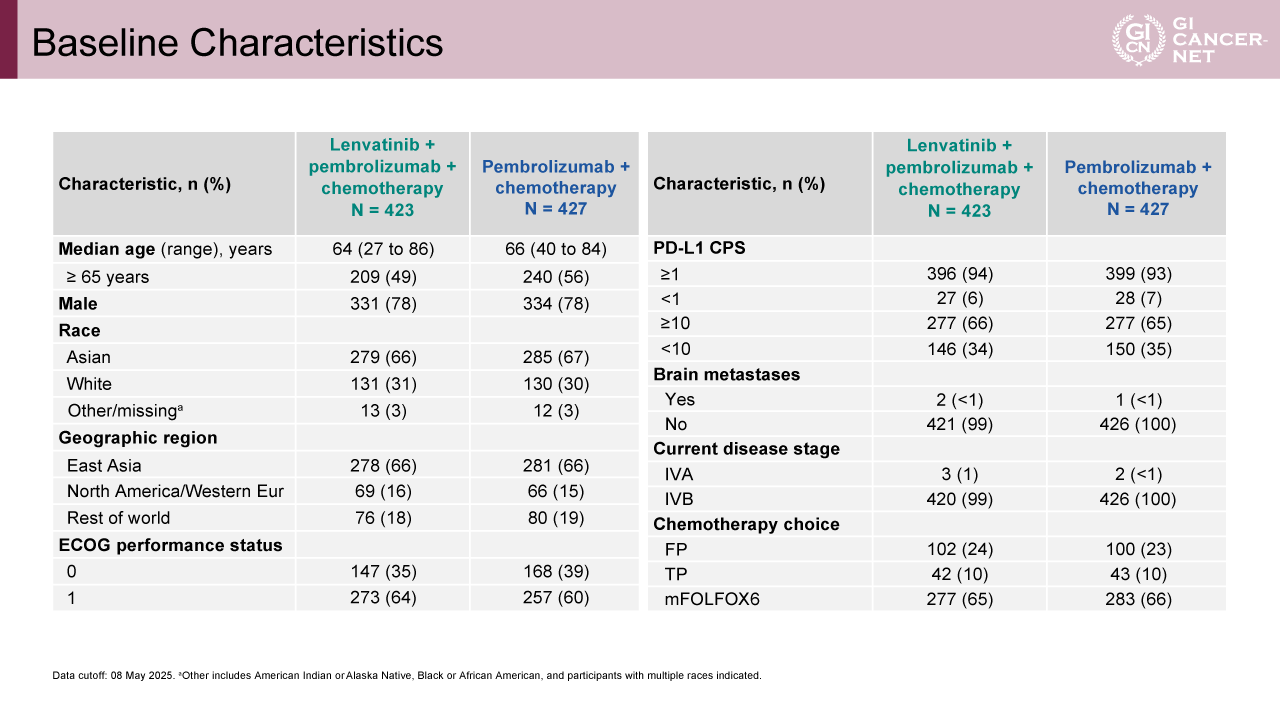
計850例の患者がLenvatinib+Pembrolizumab+化学療法群(423例)またはPembrolizumab+化学療法群(427例)に無作為に割り付けられ、層別化因子以外では年齢や人種、ECOG PS、脳転移の有無、臨床病期は両群間でほぼ同等であった(表1)。今回登録された患者のうち、両群とも66%が東アジアから参加していた。PD-L1 CPS≧10の症例数はLenvatinib併用群で66%、対照群で65%、併用された化学療法はmFOLFOX6が最も多く(65% vs. 66%)、次いでFP(24% vs. 23%)、TP(10% vs. 10%)であった。
表1 Baseline Characteristics(発表者の許可を得て掲載)
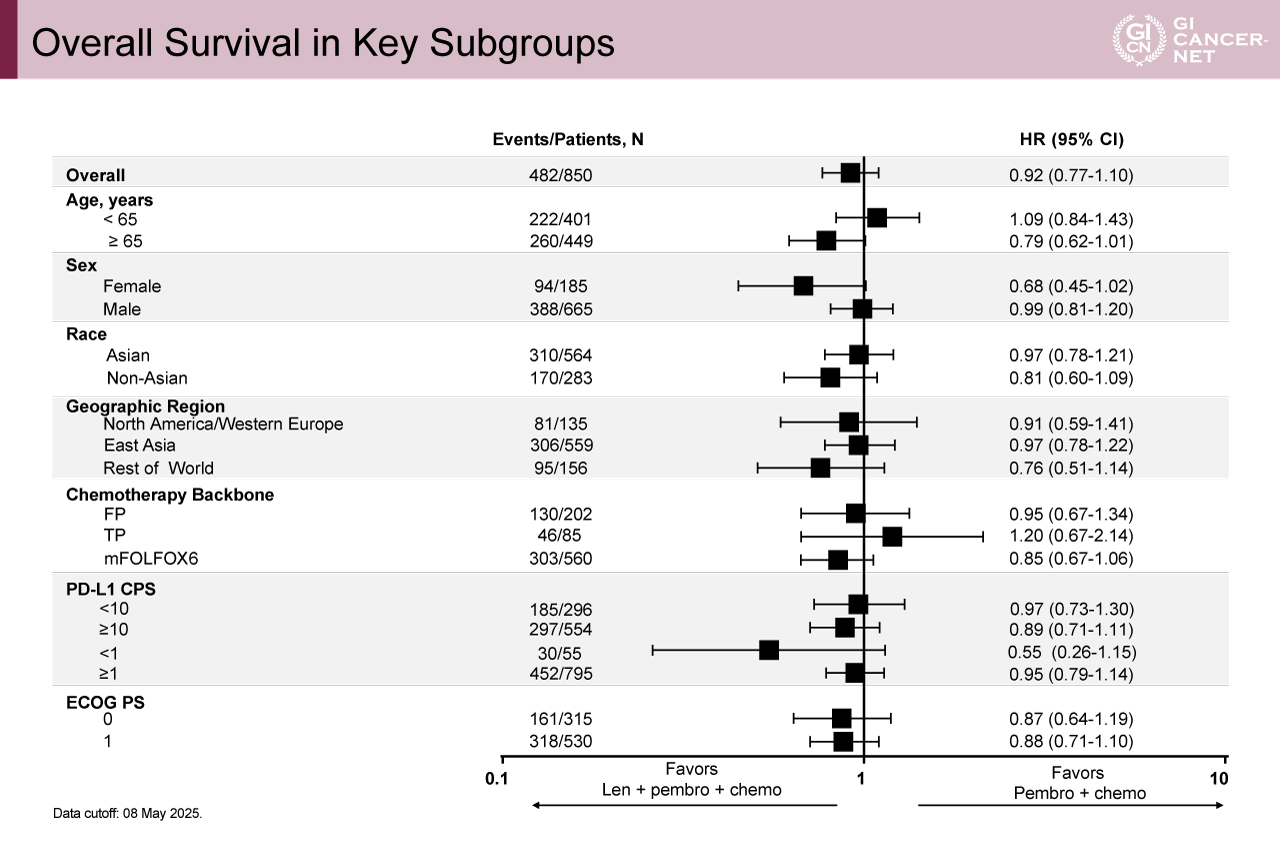
今回の中間解析におけるOS中央値は、Lenvatinib+Pembrolizumab+化学療法併用群で17.6カ月、Pembrolizumab+化学療法群で15.5カ月であり、Lenvatinibの上乗せによる生存期間の延長は、統計学的に有意差をもって示すことはできなかった[ハザード比(HR)0.92、95%信頼区間(CI)0.77-1.10、p=0.1852](図2)。1年生存割合はそれぞれ65%、61%であった。サブグループ解析でも統計学的有意差をもってOSを延長する因子はなかったものの、65歳以上(HR=0.79、95% CI: 0.62-1.01)、非アジア人(HR=0.81、95% CI: 0.60-1.09)、mFOLFOX6による併用化学療法(HR=0.85、95% CI: 0.67-1.06)は、比較的Lenvatinib併用が好ましい傾向にあった(図3)。
図2 Overall Survival (All Participants and PD-L1 CPS ≥10) (発表者の許可を得て掲載)
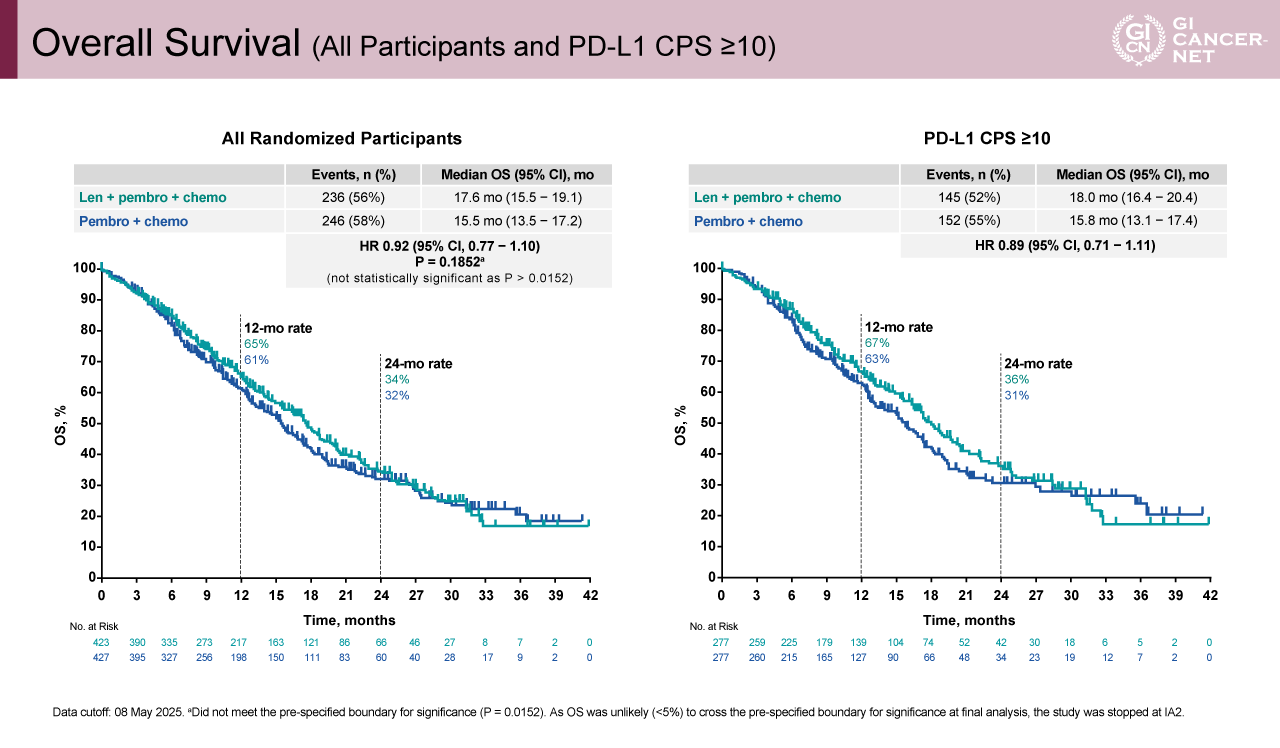
図3 Overall Survival in Key Subgroups(発表者の許可を得て掲載)
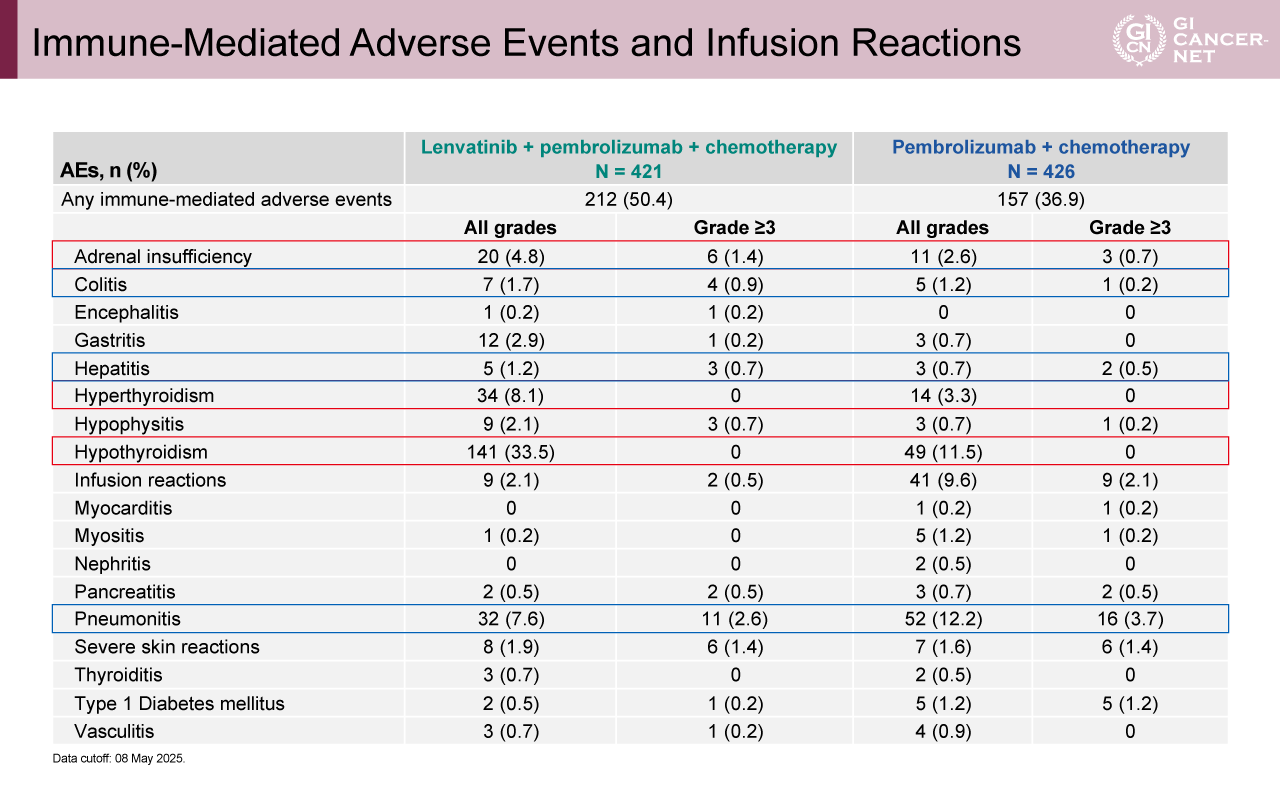
副次評価項目であるPFSは、Lenvatinib+Pembrolizumab+化学療法併用群で7.2カ月、Pembrolizumab+化学療法群で6.9カ月(HR=0.89、95% CI: 0.75-1.04)であった(図4)。ORRはそれぞれ62.2%、54.8%であり、DORは8.1カ月、6.8カ月であった(図5)。安全性については、何らかのgrade 3以上の重篤な有害事象は、Lenvatinib+Pembrolizumab+化学療法併用群、Pembrolizumab+化学療法群でそれぞれ81.2%と79.1%に観察され、何らかの休薬に至った症例は33.3%と39.0%であった(図6)。死亡に至る有害事象は、それぞれ9.7%と11.5%であった。免疫関連有害事象については、grade 3以上の重篤な有害事象の発生割合は概ね1%未満であるが、肺臓炎(2.6% vs. 3.7%)、副腎不全(1.4% vs. 0.7%)、インフュージョンリアクション(0.5% vs. 2.1%)、重篤な皮膚反応(1.4% vs. 1.4%)、1型糖尿病(0.2% vs. 1.2%)は1%を超える発生頻度であり、主な有害事象のプロファイルは両群でほぼ一致していた(表2)。Grade 3以上の治療関連有害事象の発生割合は両群間でほぼ同等であり、Lenvatinibを追加することによる新たな安全性の懸念は認められなかった。
図4 Progression-Free Survival (All Participants and PD-L1 CPS ≥10)(発表者の許可を得て掲載)
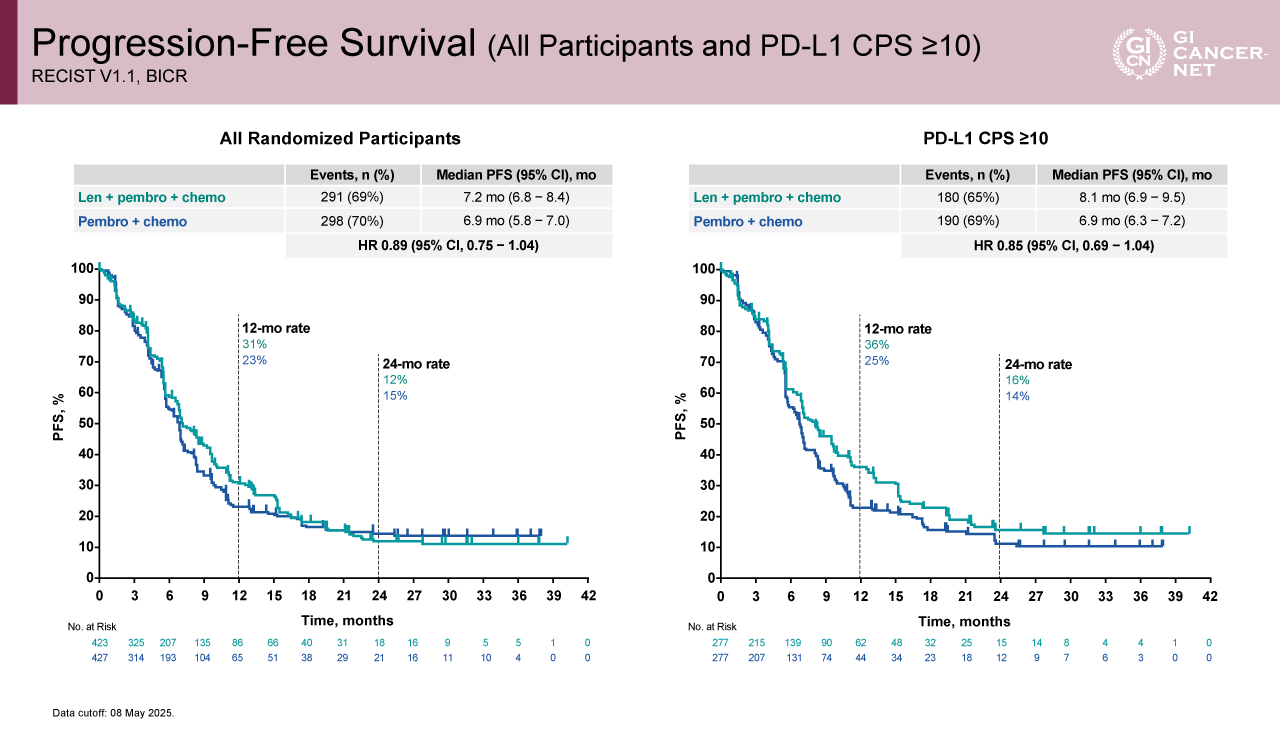
図5 Summary of Antitumor Response (All Participants)(発表者の許可を得て掲載)
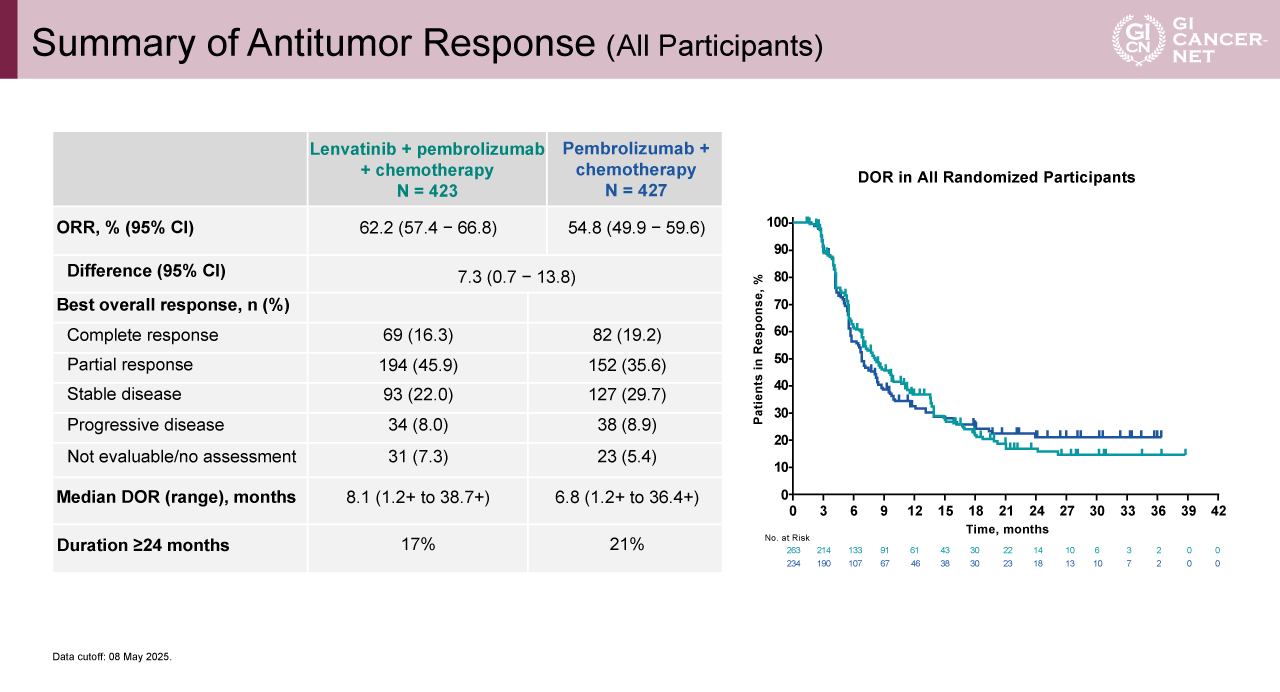
図6 Summary of Treatment-Emergent Adverse Events(発表者の許可を得て掲載)
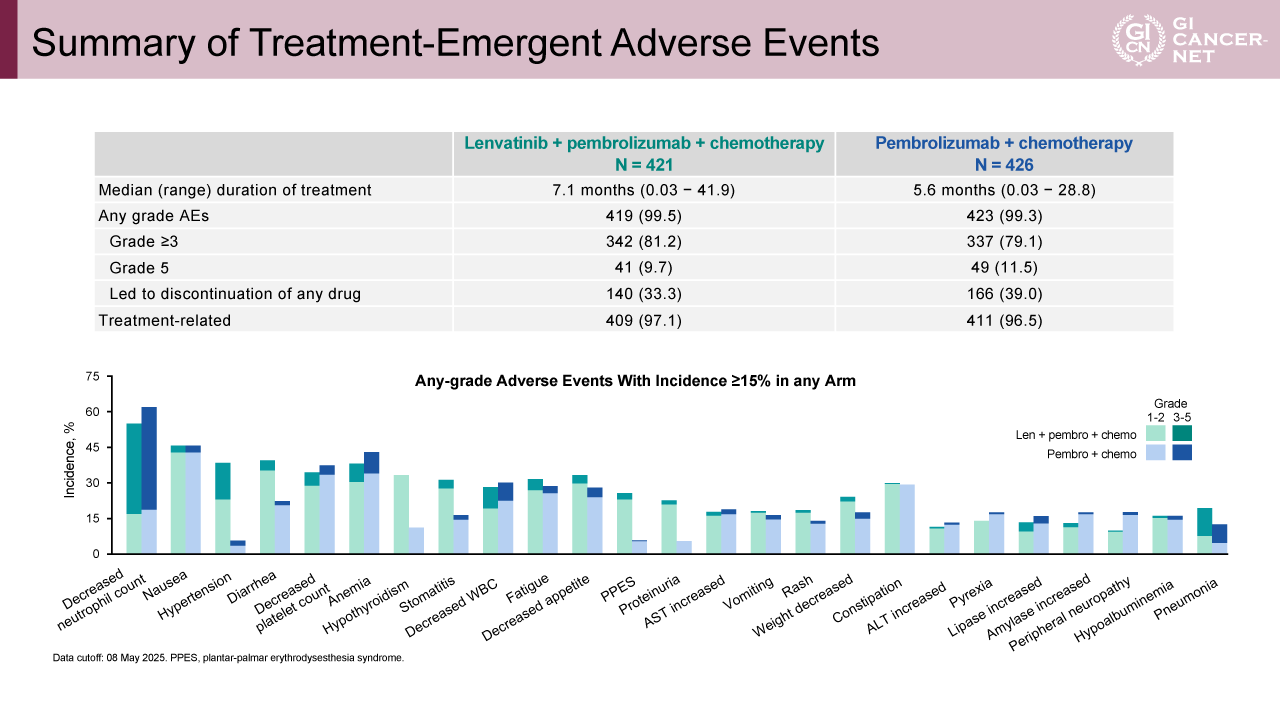
表2 Immune-Mediated Adverse Events and Infusion Reactions(発表者の許可を得て掲載)
結果
切除不能局所進行、または遠隔転移を有する食道扁平上皮癌に対する、Lenvatinib+Pembrolizumab+化学療法群は、従来のPembrolizumab+化学療法群と比較し、OSの有意な延長を認めなかった。
(レポート:国立がん研究センター中央病院 頭頸部・食道内科 森田 竜一)
References
- 1) Sun JM, et al.: Lancet. 398(10302): 759-771, 2021 [PubMed]
- 2) Doki Y, et al.: N Engl J Med. 386(5): 449-462, 2022 [PubMed]
- 3) Xu J, et al.: Lancet Oncol. 24(5): 483-495, 2023 [PubMed]
- 4) Motzer RJ, et al.: J Clin Oncol. 42(11): 1222-1228, 2024 [PubMed]
- 5) Makker V, et al.: N Engl J Med. 386(5): 437-448, 2022 [PubMed]
- 6) Shitara K, et al.: J Clin Oncol. 43(22): 2502-2514, 2025 [PubMed]
関連サイト
- ・LEAP-014試験 [ClinicalTrials.gov]
- ・LEAP-012試験 [ClinicalTrials.gov]
- ・LEAP-015試験 [論文紹介][ClinicalTrials.gov]
- ・LEAP-017試験 [ClinicalTrials.gov]

加藤 健 先生
国立がん研究センター中央病院 消化管内科/頭頸部・食道内科 科長