2018年1月18日~20日に米国サンフランシスコにて開催された2018年 消化器癌シンポジウム(2018 Gastrointestinal Cancers Symposium)より、大腸癌や胃癌、肝細胞癌などの注目演題のレポートをお届けします。演題レポートの冒頭には“Expert's view”として、臨床研究の第一線で活躍する監修ドクターのコメントを掲載しています。
肝細胞癌
Sorafenib治療後の進行肝細胞癌患者に対するCabozantinibとプラセボの無作為化比較第III相試験(CELESTIAL試験)
Cabozantinib versus placebo in patients with advanced hepatocellular carcinoma who have received prior sorafenib: results from the randomized phase 3 CELESTIAL trial
Ghassan K. Abou-Alfa, et al.
Expert’s view

上野 誠先生
神奈川県立がんセンター 消化器内科 医長
進行肝細胞癌二次治療において、Cabozantinibのプラセボに対する優越性が第III相試験により検証された。METは、肝細胞癌の増殖、浸潤、転移を促進する肝細胞増殖因子受容体として以前より注目されていた標的である。昨年度のASCO、ESMOでは、MET阻害剤であるTivantinibの海外、本邦の第III相試験の結果が報告され、両者とも、生存期間を延ばすことはできなかった。一方で、VEGFR、MET、AXLなどを阻害する多標的チロシンキナーゼ阻害薬のCabozantinibは、今回、優越性を示すことが可能であった。両者の違いは、METのみを阻害するか、併せて血管新生を阻害するかどうかである。今回、後者であるCabozantinibが優越性を示したことにより、Sorafenib不応後の二次治療Regorafenibと同様に、進行肝細胞癌Sorafenib不応後において、血管新生阻害作用継続の重要性が示唆された。進行肝細胞癌では、昨年度、一次治療でLenvatinibの非劣性が証明され、本邦で薬事承認申請中である。二次治療ではNivolumabがFDAにより承認されたが、本邦での承認は得られていない。Cabozantinibに対する本邦での臨床試験データはまだないが、肝細胞癌に対する新規治療開発は著しく進歩しており、これらの治療がどのように開発され、また位置付けられていくのか注目していく必要がある。
(コメント・監修:神奈川県立がんセンター 消化器内科 医長 上野 誠)
Cabozantinibとは?
CabozantinibはVEGFR、MET、AXLなどを阻害するチロシンキナーゼ阻害薬であり1)、進行肝細胞癌に対する第II相試験で良好な治療効果を示した2)。進行肝細胞癌に対するSorafenib後の二次治療の標準治療はRegorafenibである。しかし本試験はRegorafenibの承認前に計画・開始され、Sorafenib治療後の肝細胞癌患者に対するCabozantinibの生存期間延長効果を検証した第III相試験である。
Sorafenib治療後の進行肝細胞癌に対するCabozantinib vs. プラセボ
根治的治療の適応とならない進行肝細胞癌を有しSorafenibの治療歴がある患者を登録した。主な選択基準は一つ以上の前治療後に腫瘍増悪していること、全身治療の前治療は2つまでであること、Child-Pugh A等である。患者は無作為に2:1の割合でCabozantinib群(60mg 1日1回)とプラセボ群に割り付けられた。主要評価項目は全生存期間(OS)であり、有意水準は両側5%、検出力は90%であった。2回の中間解析が予定され、αエラーはLan-DeMets O'Brien-Flemingα消費関数にて調整し、クロスオーバーは許容しなかった。
Sorafenib後の肝細胞癌におけるCabozantinibのOS延長効果が示された
2013年9月から2017年9月までの間に773人の患者が登録された。2017年6月をデータカットオフとする2回目の中間解析において、OSに関するp値が事前に定められた0.021を下回ったために試験は途中で有効中止となった。この時点でのイベント数は484であり最終解析の必要数の78%であった。
2回目の中間解析の段階で707人がCabozantinib群に470人、プラセボ群に237人が割り付けられ、無作為化された全患者が有効性の解析対象となった(ITT解析)。
患者背景はCabozantinib群/プラセボ群でそれぞれ、年齢中央値:64歳/64歳、PS 0:52%/55%、AFP 400ng/mL以上:41%/43%、HBV:38%/38%、HCV:22%/22%、肝外転移あり:79%/77%、主要血管侵襲あり:27%/34%、全身療法の前治療歴2種類:28%/26%、放射線以外の局所療法歴:44%/48%であった。
主要評価項目であるOSの中央値はCabozantinib群で10.2ヵ月、プラセボ群で8.0ヵ月、ハザード比(HR)は0.76で95%信頼区間(CI)0.63-0.92、p=0.0049であり、2回目の中間解析に対して事前に定められた基準である0.021を下回った(図1)。
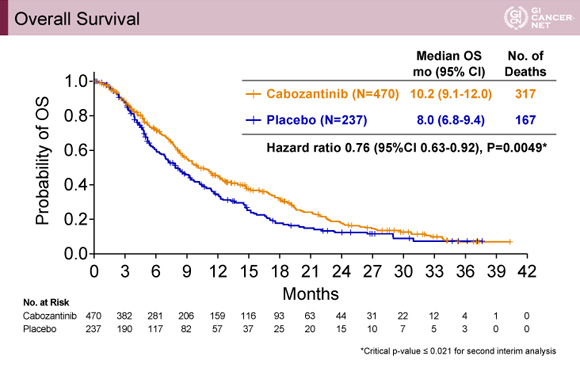
発表者の許可を得て掲載(approved by Ghassan K. Abou-Alfa)
無増悪生存期間(PFS)はCabozantinib群で5.2ヵ月、プラセボ群で1.9ヵ月、HRは0.44(95% CI: 0.36-0.52)、p<0.0001であった(図2)。
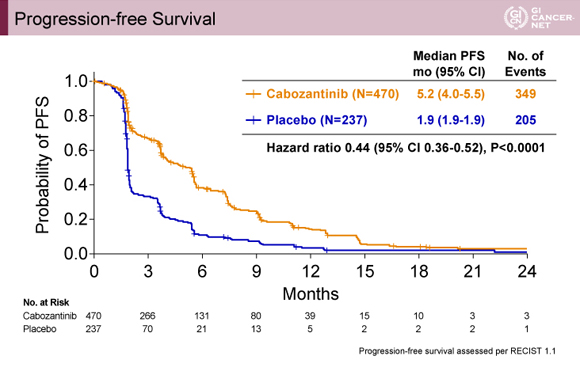
発表者の許可を得て掲載(approved by Ghassan K. Abou-Alfa)
奏効割合はCabozantinib群で4%、プラセボ群で0.4%、腫瘍安定(SD)はCabozantinib群で60%、プラセボ群で33%であった(RECIST ver1.1)。
サブグループ解析ではOSに関してアジア地域で登録された患者や、遠隔転移/主要脈管侵襲のない患者においてハザード比が1に近い結果であったが、PFSに関してはどちらもCabozantinib群で良好であった。HBVを有する患者においてはOS、PFSともにCabozantinib群で特に良好であった。
Cabozantinib群の治療期間の中央値は3.8ヵ月であり、PFSの中央値5.2ヵ月に比べて短い傾向があった。Cabozantinib投与量の中央値は35.8mg/日であり、減量を要したのは62%、有害事象中止となったのは16%であった。
Grade 3/4の有害事象を全体でみるとCabozantinib群で68%、プラセボ群で36%であった。Cabozantinib群のgrade 3/4の有害事象は、手足症候群が17%、高血圧が16%、AST上昇が12%、倦怠感が10%、下痢が10%などであった。治療関連死はCabozantinib群で6例(1.3%)、プラセボ群で1例(0.4%)であった。
まとめ
Sorafenib治療後に増悪した肝細胞癌に対してCabozantinibはOSを有意に延長した。CabozantinibはSorafenib不応後の進行肝細胞癌に対する新しい治療オプションである。
(レポート:国立がん研究センター東病院 肝胆膵内科 医員 高橋 秀明)

監修・レポーター
監修
谷口 浩也先生
愛知県がんセンター中央病院 薬物療法部 医長
レポーター
賀川 義規先生
関西ろうさい病院 下部消化器外科 副部長
#745
監修
山﨑 健太郎先生
静岡県立静岡がんセンター 消化器内科 医長
レポーター
山本 祥之先生
筑波大学附属病院 消化器内科 病院講師
#557
監修
上野 誠先生
神奈川県立がんセンター 消化器内科 医長
レポーター
高橋 秀明先生
国立がん研究センター東病院 肝胆膵内科 医員
#207