2018年1月18日~20日に米国サンフランシスコにて開催された2018年 消化器癌シンポジウム(2018 Gastrointestinal Cancers Symposium)より、大腸癌や胃癌、肝細胞癌などの注目演題のレポートをお届けします。演題レポートの冒頭には“Expert's view”として、臨床研究の第一線で活躍する監修ドクターのコメントを掲載しています。
大腸癌
Fluoropyrimidine、Oxaliplatin、Irinotecanを含む化学療法に不応または不耐のRAS野生型進行・再発結腸・直腸癌に対するRegorafenibとCetuximabの逐次投与とCetuximabとRegorafenibの逐次投与の無作為化第II相試験(REVERCE)
REVERCE: Randomized phase II study of regorafenib followed by cetuximab versus the reverse sequence for metastatic colorectal cancer patients previously treated with fluoropyrimidine, oxaliplatin, and irinotecan.
Kohei Shitara, et al.
Expert’s view

山﨑 健太郎先生
静岡県立静岡がんセンター 消化器内科 医長
マルチキナーゼ阻害剤であるRegorafenibはFluoropyrimidine、Oxaliplatin、Irinotecan、血管新生阻害薬、抗EGFR抗体に不応不耐となった切除不能大腸癌に対する標準治療である。そのためRAS遺伝子野生型の症例に対して後方治療として抗EGFR抗体を用いた場合、通常は抗EGFR抗体→Regorafenibの順で逐次投与される。本試験ではこの順序を逆にしたRegorafenib→抗EGFR抗体逐次投与の有効性、安全性を検討する目的で計画された。統計学的事項を見る限り、計画時は全生存期間における試験治療の非劣性を検討するのが目的であったと思われるが、予想に反して結果は試験治療で有意に全生存期間が良好であった(HR=0.61、p=0.029)。直接比較することはできないものの、各々の薬剤における無増悪生存期間はいずれも試験治療群で良好であり、これらが試験治療群における生存期間延長に繋がったものと考える(試験治療 vs. 標準治療;Regorafenib 2.4ヵ月 vs. 1.8ヵ月、抗EGFR抗体5.2ヵ月 vs. 4.2ヵ月)。発表者もこのような結果が得られた明確な理由は不明と前置きしつつも、前治療歴の少ない症例ではRegorafenibの有効性が高くなる可能性やRegorafenib投与後の治療の有効性が報告されていることを紹介していた。このメカニズムの解明には、さらなるバイオマーカー解析や基礎的な検討が必要になると思われるが、もし標準治療の投与順序を変えるだけでこのような生存期間への寄与が得られるのであれば実地診療において非常に有用と考える。今後、本研究結果をどのように検証していくのか興味が尽きない。
(コメント・監修:静岡県立静岡がんセンター 消化器内科 医長 山﨑 健太郎)
切除不能大腸癌に対するRegorafenib→Cetuximab逐次療法を評価
抗EGFR(上皮成長因子受容体)抗体であるCetuximabおよび血管新生阻害作用をもつ小分子化合物であるRegorafenibは、切除不能大腸癌に対して有効性を示した分子標的治療薬であり、RAS遺伝子野生型の大腸癌の場合、Regorafenibは抗EGFR抗体に無効となった後の標準治療の一つとして認識されている1,2)。しかしながら最近、Regorafenibの早期ラインでの有効性3)や、Regorafenib投与後の逐次的化学療法の効果4,5)が報告されている。本試験は新たな治療戦略として、切除不能大腸癌に対するRegorafenib→Cetuximab(R-C)の逐次投与の有効性と安全性を、標準治療であるCetuximab→Regorafenib(C-R)の逐次投与と比較検討した無作為化比較第II相試験である。
主要評価項目は全生存期間
対象は、Fluoropyrimidine、Oxaliplatin、Irinotecanを含む化学療法に不応または不耐となったECOG PS 0-1のKRAS野生型進行・再発大腸癌患者であった。2015年3月にRAS遺伝子検査が保険償還されて以降は、minor RASも含めたall RAS野生型が対象となった。症例割付調整因子は施設、Bevacizumab投与歴、CetuximabとIrinotecan併用企図の有無であった。
治療方法は、介入群(R-C群)は治療1としてRegorafenib(160mgを1日1回内服、3週投与1週休薬、1サイクル4週間)を1st PD(病勢進行)もしくは許容できない有害事象の出現まで継続し、治療2としてCetuximab(初回400mg/m2、2回目以降250mg/m2、毎週投与)±Irinotecan[Irinotecanの併用は医師判断、150mg/m2(120mg/m2への減量も許容)、2週毎]を2nd PDもしくは許容できない有害事象の出現まで継続する逐次投与をプロトコール治療とした。対照群(C-R群)は治療1をCetuximab±Irinotecan、治療2をRegorafenibとした逐次投与を行った(図1)。
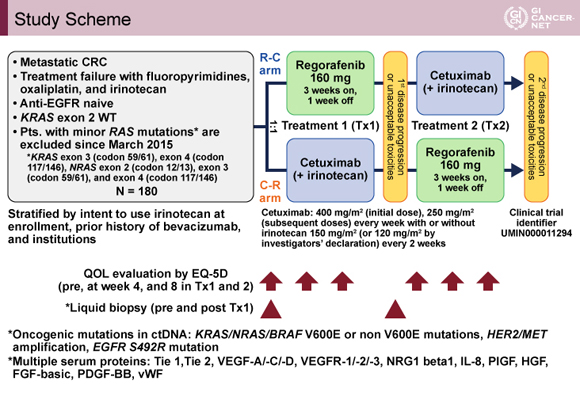
発表者の許可を得て掲載(approved by Kohei Shitara)
主要評価項目は全生存期間(OS)であり、副次評価項目は無増悪生存期間(PFS)、治療成功期間(TTF)、奏効率および病勢コントロール率、安全性、QOLであり、探索的研究としてliquid biopsyを用いたバイオマーカー研究も計画された。試験は、OSのハザード比(HR)の点推定値が0.8?1.25を満たした場合に非劣性であると結論することとし、真のHRが1.0の場合これを80%の確率で示すためには両群計で必要イベント数は132であった。両群のOS中央値を12ヵ月程度と仮定し、目標症例数は180例として実施された。本試験は症例登録の遅れから、最終的に101例が登録された時点で終了となった。
HR=0.61という驚異的なOSの延長が示された
2013年11月?2016年9月の期間に国内29施設より101例が登録され、R-C群に51例、C-R群に50例が1:1に無作為化された。患者背景に大きな偏りはなく、年齢中央値はR-C群68歳、C-R群65歳、ECOG PS 1はそれぞれ33%、22%で、原発部位(左側結腸/右側結腸)はそれぞれ75%/25%、86%/14%であり、Bevacizumab投与歴はそれぞれ96%、98%、CetuximabとIrinotecanの併用割合はそれぞれ59%、64%、ct(circulating tumor)DNA解析によるRAS野生型はそれぞれ90%、88%、ctDNA解析によるBRAF V600E変異型はそれぞれ2%、6%であった。両群併せた治療1、治療2の逐次治療の成功割合は86%であった。
主要評価項目のOSの中央値は、R-C 群17.4ヵ月、C-R群11.6ヵ月、HRは0.61(95% CI: 0.39-0.96)であり、統計学的に非劣性だけでなく優越性が示された(p=0.029)(図2)。
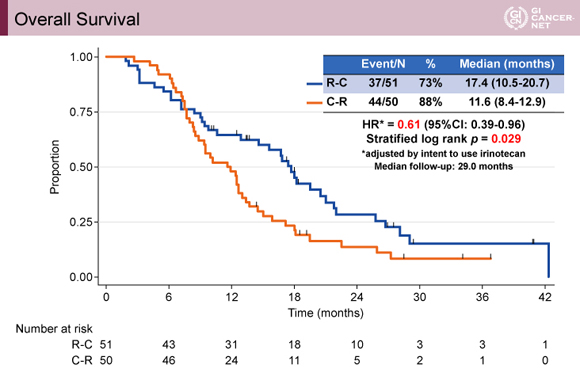
発表者の許可を得て掲載(approved by Kohei Shitara)
PFS1(治療1)の中央値は、R-C群(Regorafenibパート)2.4ヵ月、C-R群(Cetuximabパート)4.2ヵ月、HRは0.97(95% CI: 0.62-1.54)であり、統計学的に有意差は認められなかった(p=0.91)(図3)。
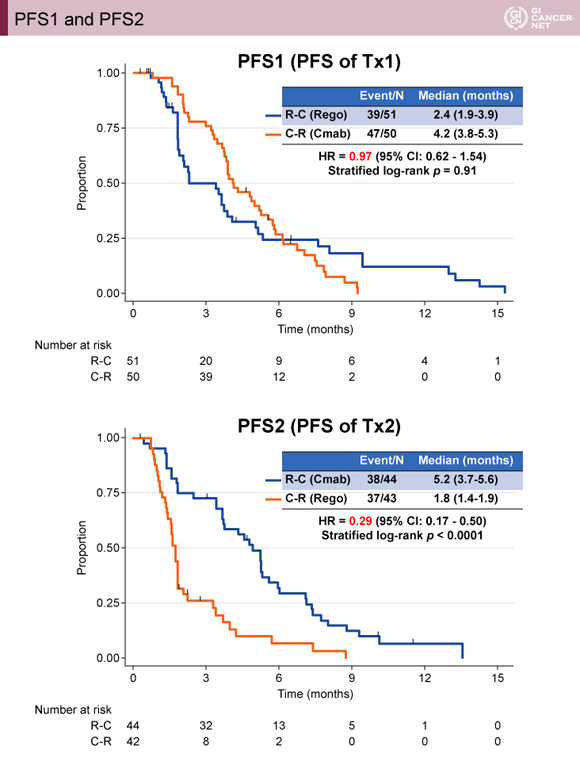
発表者の許可を得て掲載(approved by Kohei Shitara)
一方、PFS2(治療2)の中央値は、R-C群(Cetuximabパート)5.2ヵ月、C-R群(Regorafenibパート)1.8ヵ月、HRは0.29(95% CI: 0.17-0.50)であり、類をみない有意差をもってR-C群が優れており(p<0.0001)、OSの延長にPFS2が寄与したことが示唆される結果であった(図3)。
治療1、2を併せたTTFの中央値もR-C 群7.4ヵ月、C-R群6.1ヵ月、HRは0.60(95% CI: 0.39-0.92)であり、統計学的に優越性が示された(p=0.017)。
奏効率/病勢コントロール率については、治療1は、R-C群(Regorafenibパート)4.0%/46.0%、C-R群(Cetuximabパート)20.4%/77.6%であり、治療2はR-C群(Cetuximabパート)27.9%/76.7%、C-R群(Regorafenibパート)0.0%/31.0%であった。
安全性に関しては、両群ともに、CetuximabやRegorafenibについてこれまでに報告されてきた有害事象同様のプロファイルであり、いずれも忍容可能であった。QOLの評価(EQ5D)は、両群ともにCetuximabパートよりもRegorafenibパートで低い傾向がみられたが、全治療期間におけるQOLスコア平均値は両群間で有意差を認めなかった(p=0.65)。
後治療は、R-C群で69%、C-R群で64%の症例に実施されており、それぞれTAS-102が69%、62%で使用されていた。その他の使用薬剤についても両群間で大きな差はみられなかった。
OSにおけるサブグループ解析では、各臨床背景因子(年齢、性別、ECOG PS、CetuximabとIrinotecanの併用の有無)において大きな差はなく、いずれにおいてもR-C群が良好な結果であった。原発部位においては、左側結腸ではHR=0.51(95% CI: 0.30-0.86)、右側結腸ではHR=0.88(95% CI: 0.32-2.40)であった。
Liquid biopsyを用いた探索的研究の結果については、ctDNAにおけるRAS、BRAF statusに関してのみ報告された。RAS、BRAFの解析可能であった98症例でのOSにおけるサブグループ解析で、ctDNA RAS野生型集団(n=90)ではHR=0.59(95% CI: 0.39-0.94)であり、ctDNA RASかつBRAF野生型集団(n=86)ではHR=0.60(95% CI: 0.37-0.98)であった。また、対照群(C-R群)の治療1(Cetuximab±Irinotecan)前後のliquid biopsyでのctDNA RAS statusの検査で、Cetuximab治療後に26%の症例で新たな耐性変異が検出された。
まとめ
切除不能大腸癌に対するRegorafenib→Cetuximab逐次療法は、従来のCetuximab→Regorafenib逐次療法と比較し有意にOSの延長を示し、特にfollowed by Cetuximabの効果が大きく寄与していることが示唆された。そのメカニズムについてはバイオマーカー研究も含めてさらなる検討が必要である。
(レポート:筑波大学附属病院 消化器内科 病院講師 山本 祥之)
References
- 1) NCCN Guideline. Colon Cancer. 2017 ver. 2
- 2) Yoshino T, et al.: Ann Oncol. 2017 (in press)
- 3) Carrato A, et al.: ASCO 2016 #3527
- 4) Kidd MT, et al.: ASCO 2015 #678
- 5) Marks EI, et al.: Cancer Biol Ther. 16(12): 1710-1719, 2015[PubMed]

監修・レポーター
監修
谷口 浩也先生
愛知県がんセンター中央病院 薬物療法部 医長
レポーター
賀川 義規先生
関西ろうさい病院 下部消化器外科 副部長
#745
監修
山﨑 健太郎先生
静岡県立静岡がんセンター 消化器内科 医長
レポーター
山本 祥之先生
筑波大学附属病院 消化器内科 病院講師
#557
監修
上野 誠先生
神奈川県立がんセンター 消化器内科 医長
レポーター
高橋 秀明先生
国立がん研究センター東病院 肝胆膵内科 医員
#207