大腸癌
切除可能結腸直腸癌におけるctDNAの変化と術後補助化学療法の有効性の関連:CIRCULATE-Japanの前向き観察研究(GALAXY試験)
Association of circulating tumor DNA dynamics with clinical outcomes in the adjuvant setting for patients with colorectal cancer from an observational GALAXY study in CIRCULATE-Japan
Masahito Kotaka, et al.
Expert’s view
CIRCULATE-Japanから産まれるもの、遺るもの
世界最大の大腸癌術後MRDプロジェクトCIRCULATE-Japanより、GALAXY試験1,564例のアップデート報告である。ctDNAの経時的な変化とDFSの関連、術後補助化学療法の有無によるctDNAの陰転化割合、ctDNA陽性群、陰性群での術後補助化学療法の有無とDFSの関連と新規の知見が目白押しとなった。注目ポイントは、1点目に、4週時点のctDNAステータスは、前回(ESMO WCGC 2021)同様、非常に大きな再発リスク因子となる点である。症例数が増え、観察期間が延長しても一貫した結果を示した。2点目に、術後4週から12週の変化に注目すると、4週時点のctDNAが陽性でも12週時点で陰転化すれば、4週および12週陰性群とほぼDFSは同程度に良好である点である。これは今後、4週から12週のctDNAステータスの変化がDFSのsurrogate endpointになる可能性を示唆している。3点目として、4週時点ctDNA陽性例においてはpStageを問わず一貫して術後補助化学療法実施群で有意に陰転化割合が高く、DFSが良好な点である。一方で4週時点でのctDNA陰性群は術後補助化学療法の有無にかかわらず、DFSに有意差は認めなかった。つまり、ctDNA陽性群においては強力な術後補助化学療法が必要であり、ctDNA陰性群にはpStageによらず術後補助化学療法の省略が可能となる未来が示唆される結果である。しかしながら本研究はあくまで前向き観察研究であり、検証試験としての第3相試験であるVEGA試験、ALTAIR試験の結果を待つ必要がある。
CIRCULATE-Japanは2020年5月から開始したプロジェクトであり、COVID-19パンデミックの中、全国約150施設から3,000例を超える症例が登録されている。研究者、協力いただいている患者さん一人一人の熱い想いから今回の貴重な発表が産み出された。一方で、術後ctDNA陰性から陽転せず再発する例があること、術後4週時点でctDNA陽性であっても自然消退する例があること、術後1~2サイクルの抗癌剤実施でctDNA陰転化するのは本当に抗癌剤の治療効果を反映しているのか、など未解決の新しい課題も生まれてきた。すさまじい勢いで拡張したくさんのデータが産まれるCIRUCLATE-Japanであるが、患者さんに遺されるものは何か、今後も注目いただきたい。
最後に、ALTAIR試験の研究事務局としてCIRCULATE-Japanを支えてもらっている一方で、今回の発表のための膨大なデータ解析、発表スライド作成に昼夜を問わずご尽力いただいた白数先生に、CIRCULATE-Japanチームを代表して改めて感謝申し上げる。
(コメント・監修:愛知県がんセンター 薬物療法部 医長 谷口 浩也)
ctDNAによるMRDの評価が術後補助化学療法の選択に寄与する可能性
血中循環腫瘍DNA(circulating tumor DNA: ctDNA)による分子的微小残存病変(minimal residual disease: MRD)の評価が、術後の再発リスクおよび術後補助化学療法の有効性を評価することにより、術後補助化学療法の恩恵を受けやすい対象を選択できる可能性がある。
CIRCULATE-Japanは切除可能結腸直腸癌(cStage II-IV)におけるctDNA解析の臨床的有用性を確立する大規模プロジェクトである。ctDNAと臨床経過の関連を検討する観察研究(GALAXY試験)と、術後ctDNAステータスに応じて術後化学療法を追加あるいは省略することを検証する2つの第3相試験(VEGA試験、ALTAIR試験)から構成されている1,2)。
ctDNAの経時的変化と短期的な予後および術後補助化学療法の有効性の関連について検討
本研究で使用されたSignatera™アッセイは、米国Natera社が開発した新規MRD検出用ctDNA検出システムである。腫瘍組織を全エクソーム解析し、患者の腫瘍特異的かつクローナルな16の一塩基置換変異(SNV)を選択し、カスタム遺伝子パネルを作成する。このパネルを用いて、患者血液検体からctDNAを抽出し、次世代シークエンサー法(next generation sequencing: NGS)によりctDNAの有無を検出するMRD検出システムである。術前および術後4、12、24、36、48、72、96週時点の血液検体を用いて解析を行った。研究者は本アッセイの結果を速やかに知ることができ、前述の第3相試験(VEGA試験、ALTAIR試験)への登録を検討する。今回は、GALAXY試験におけるctDNAの経時的な変化と短期的な予後および術後補助化学療法の有効性の関連について検討された。なお、本報告では第3相試験(VEGA試験、ALTAIR試験)に登録された対象は除外されている。
2021年4月30日の時点で、1,564例が登録され、第3相試験(VEGA試験、ALTAIR試験)に登録されている症例等を除き、1,040例をOutcome cohortとして解析対象とした。そのうち12週時点でのctDNA結果が得られていない対象等を除いた838例をDynamics analysis cohort、4週時点でのctDNA結果が陽性かつ12週時点でのctDNA結果が得られている183例をClearance analysis cohort、4週時点でのctDNA結果が陰性の高リスクStage IIおよびStage IIIの症例をctDNA Negative cohortとした(図1)。
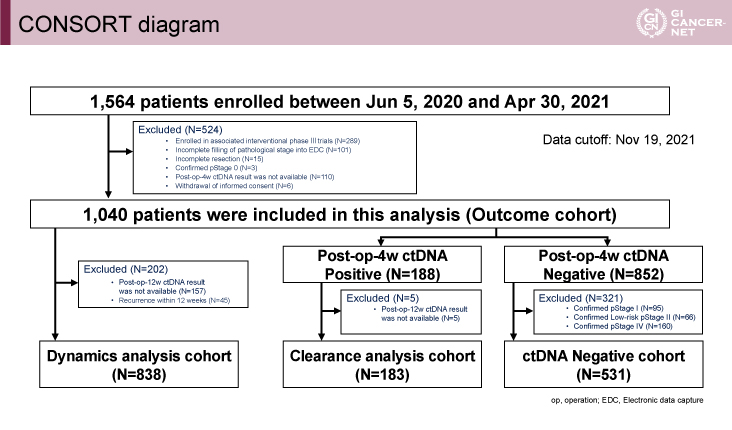
発表者の許可を得て掲載(approved by Masahito Kotaka)
Short outcome cohortでは、4週時点でのctDNA結果が陰性の852例と陽性の188例を比較した。2つの群では、性別、pStage、BRAF陽性割合、MSIステータスに有意な群間差を認めた(表1)。
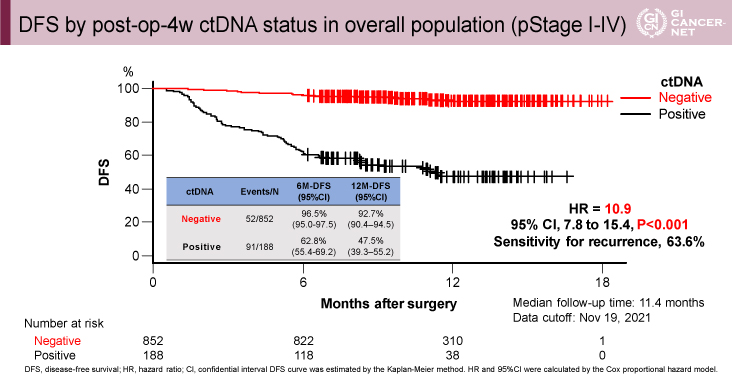
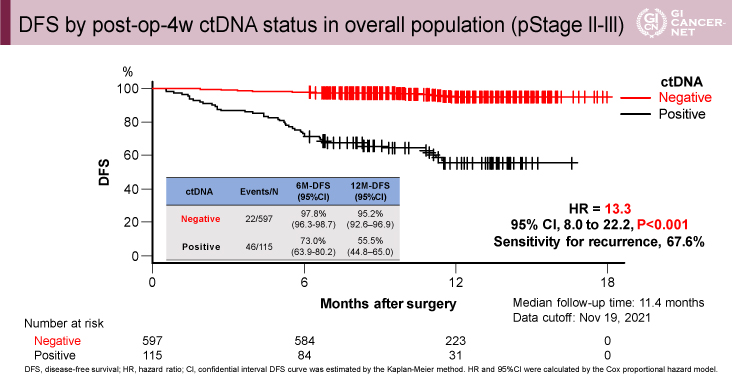
術後4週時点のctDNA陽性例はctDNA陰性例と比較して有意に無病生存期間が短かった(HR=10.9[95% CI: 7.8-15.4]、p<0.001)(図2)。また、pStage II-III症例においても全症例と同様に、術後4週時点のctDNA陽性例はctDNA陰性例と比較して有意に無病生存期間が短かった(HR=13.3[95% CI: 8.0-22.2]、p<0.001)(図3)。再発予測因子に関する検討では、多変量解析において術後4週時点のctDNAステータス、RAS変異の有無、BRAF変異の有無が有意な因子であった。
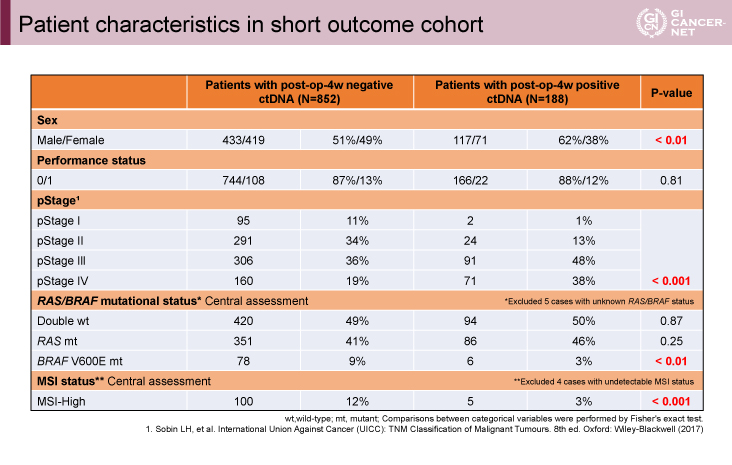
発表者の許可を得て掲載(approved by Masahito Kotaka)
発表者の許可を得て掲載(approved by Masahito Kotaka)
発表者の許可を得て掲載(approved by Masahito Kotaka)
Dynamics analysis cohortでは、4週時点でのctDNA結果および12週時点でのctDNA結果に応じて4群(陰性→陰性、陰性→陽性、陽性→陰性、陽性→陽性)に分類し解析を行った。術後4週時点のctDNA陽性→12週時点のctDNA陽性と陰転化しなかった対象は、陽性→陰性と陰転化した対象と比較して有意に無病生存期間が短かった(HR=15.8[95% CI: 5.7-44.2]、p<0.001)(図4)。
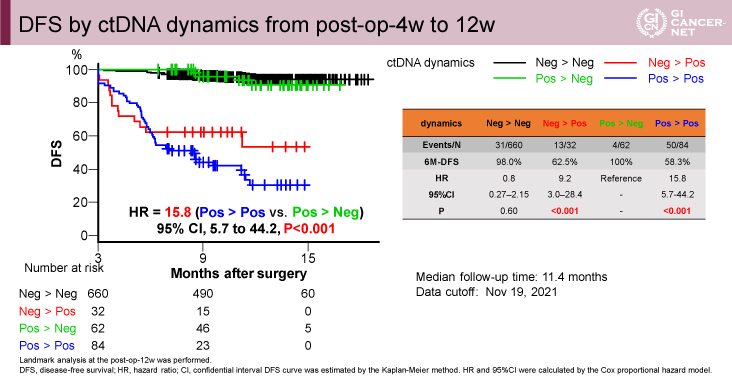
発表者の許可を得て掲載(approved by Masahito Kotaka)
Clearance analysis cohortでは、術後補助化学療法を実施した96例と未実施の87例を評価した。2つの群では、性別、pStageに有意な群間差を認めた(表2)。ctDNAの6ヵ月時点での陰転化割合は、術後補助化学療法実施群で68%、未実施群で10%と術後補助化学療法実施群で有意に高かった(HR=9.3[95% CI: 4.6-18.9]、p<0.001)。また本コホートを高リスクpStage II、pStage III、pStage IVに分け、術後補助化学療法の有無で無病生存期間の解析を行うとpStageによらず有意に術後補助化学療法未実施群で短かった(高リスクpStage II:HR=9.4[95% CI: 1.1-79.1]、p=0.04;pStage III:HR=8.8[95% CI: 3.9-19.5]、p<0.001;pStage IV:HR=2.4[95% CI: 1.1-5.2]、p=0.02)(図5)。また全例における再発予測因子に関する検討では、多変量解析において術後補助化学療法の有無、RAS変異の有無が有意な因子であった。
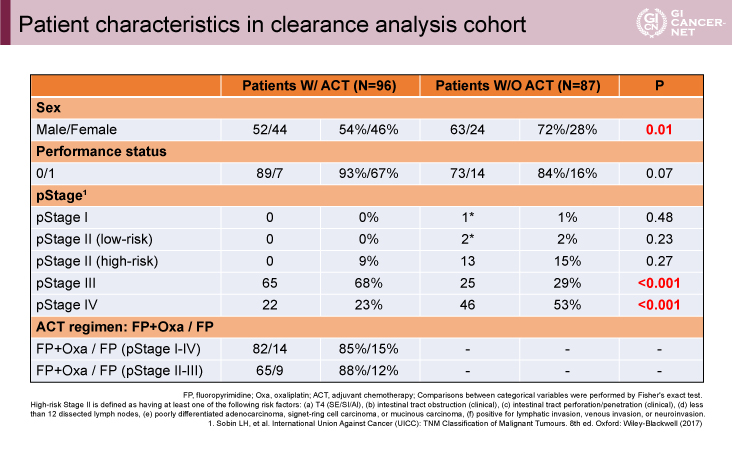
発表者の許可を得て掲載(approved by Masahito Kotaka)
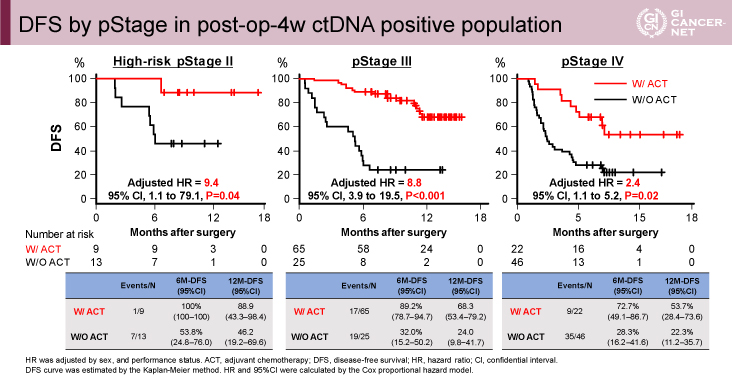
発表者の許可を得て掲載(approved by Masahito Kotaka)
ctDNA Negative cohortでは、高リスクpStage IIもしくはStage IIIの対象で、術後補助化学療法を実施した214例と未実施の317例を評価した。2つの群では、PS、pStageに有意な群間差を認めた(表3)。術後補助化学療法の有無で無病生存期間の解析を行うと有意差を認めなかった(HR=1.3[95% CI: 0.5-3.6]、p=0.63)(図6)。
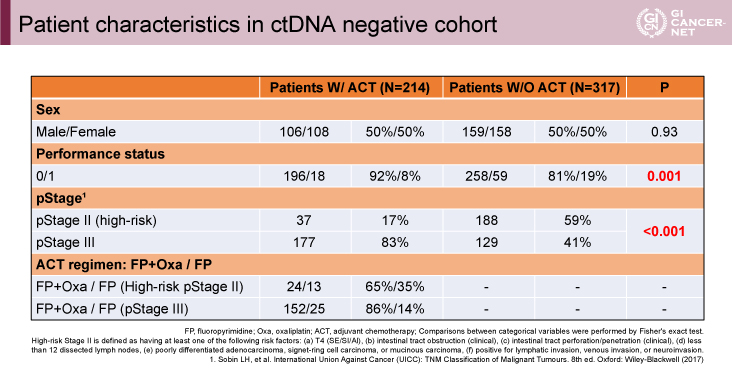
発表者の許可を得て掲載(approved by Masahito Kotaka)
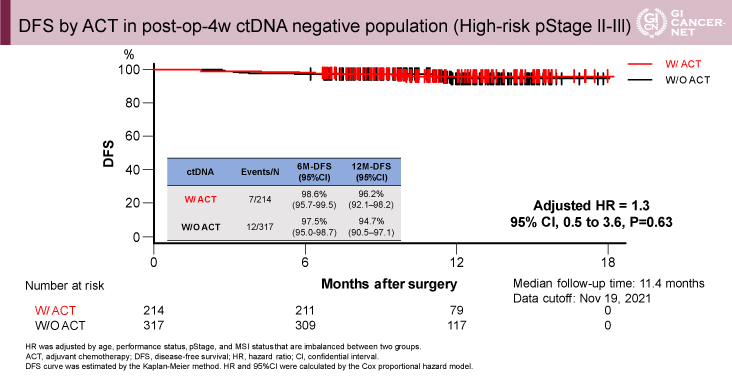
発表者の許可を得て掲載(approved by Masahito Kotaka)
まとめ
本試験の結果から、本アッセイによりpStageによらず術後補助化学療法の恩恵を受ける可能性の高い対象を選択できることが示唆された。術後4週から12週へのctDNAの変化がDFSに代わる新たなsurrogate endpointになる可能性が示唆された。ctDNAによる術後補助化学療法の選択は現在進行中の第3相試験(VEGA試験、ALTAIR試験)での検証が待たれる。
(レポート:静岡県立静岡がんセンター 消化器内科 白数 洋充)
References
- 1) Taniguchi H, et al.: Cancer Sci. 112(7): 2915-2920, 2021 [PubMed]
- 2) Miyo M, et al.: Cancer Sci. November 27, 2021 [Online ahead of print] [PubMed]
関連サイト
- ・VEGA試験 [臨床研究実施計画・研究概要公開システム]
- ・ALTAIR試験 [ClinicalTrials.gov]









谷口 浩也先生
愛知県がんセンター 薬物療法部 医長