大腸癌
切除不能進行再発大腸癌の一次化学療法におけるNivolumab併用の意義を検討する無作為化第II相試験(CheckMate 9X8試験)
Nivolumab + 5-fluorouracil/leucovorin/oxaliplatin (mFOLFOX6)/bevacizumab versus mFOLFOX6/bevacizumab for first-line treatment of metastatic colorectal cancer: phase 2 results from CheckMate 9X8
Heinz-Josef Lenz, et al.
Expert’s view
切除不能進行再発大腸癌に対する化学療法と免疫チェックポイント阻害薬の併用療法は有効か?
免疫チェックポイント阻害薬はさまざまな癌種で有効性が報告されており、MSI-High固形癌に対しては臓器横断的に効果が期待できる薬剤である。大腸癌でもMSI-High腫瘍に対する予後延長効果が示されており1)、MSI-High大腸癌の1次治療として免疫チェックポイント阻害薬単剤療法が確立している。胃癌late-lineではバイオマーカーによる適格症例の絞り込みは不要で、進行胃癌3次治療以降のNivolumab療法の有効性が認められており2)、さらに2021年にはCheckMate 649試験3)とATTRACTION-4試験4)の結果が公表され、本邦では1次治療から胃癌全体に化学療法と併用してNivolumabを使用することが承認された。大腸癌でも化学療法と併用することで、さらなる予後延長効果が認められるのか、本試験の結果がとても期待されていた。
2021年に発表されたAtezo TRIBE試験(主にMSS大腸癌が対象)5)の結果では、化学療法レジメンFOLFOXIRI+BevacizumabにAtezolizumabを併用することで有意にPFSを延長することが示された。CheckMate 9X8試験で、TripletではなくDoubletレジメンでも同じ結果になるのかについて注目されていた。しかし、本試験結果ではNivolumabを併用することでPFSは延長されず、negative studyとなった。12ヵ月以降のPFS率がNivolumab群で良好であること、バイオマーカー解析でCMS3の群で良好であることを踏まえると、特定の集団に対して1次治療にNivolumabを併用する意義があるように考えられる。しかし、PFSと相関するはずの奏効率ではNivolumab併用療法が良好な結果であること、Atezo TRIBE試験では奏効率に差がないのにPFSに差があることなど、大腸癌において化学療法と免疫チェックポイント阻害薬の併用で起こる「真実」がまだよく分かっていない。大腸癌の免疫機構や免疫関連バイオマーカーの解析、本試験のさらなる臨床データを待ち解釈することが重要である。
(コメント・監修:聖マリアンナ医科大学 臨床腫瘍学講座 教授 砂川 優)
切除不能進行再発大腸癌における免疫チェックポイント阻害薬の治療開発
抗PD-1抗体薬であるNivolumabは、単剤投与もしくはIpilimumab(抗CTLA-4阻害薬)との併用において、MSI-H/dMMRの既治療の切除不能進行再発大腸癌 (mCRC) に対する有効性が示されている6,7)。また、免疫チェックポイント阻害薬を化学療法に併用することで、大腸癌に対しての抗腫瘍効果が高まる可能性が示唆されている5,8)。本試験(CheckMate 9X8試験)では、mCRCの一次化学療法において、Nivolumabを標準的化学療法(SOC: standard of care)であるmFOLFOX6+Bevacizumab療法に併用することの意義が検討された。
MSSとMSI-Hの両者を含むmCRC一次治療例を対象とした試験
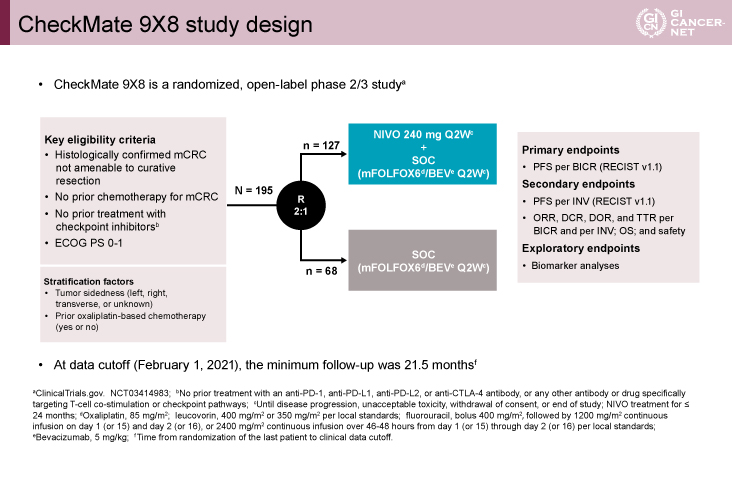
対象は未治療、PS 0-1のmCRC患者で、MSIステータスにかかわらず195例が登録された(図1)。登録された患者は、mFOLFOX6+Bevacizumab療法にNivolumab(2週間ごとに240mg)を併用する群 (NIVO+SOC群) と併用しない群(SOC群)に2:1で無作為に割り付けられた。主要評価項目は盲検下独立中央判定(BICR)による無増悪生存期間(PFS)、副次評価項目は担当医評価によるPFS、奏効割合(ORR)、奏効期間(DOR)、全生存期間(OS)、安全性などであった。また、探索的なバイオマーカー解析も行われた。
発表者の許可を得て掲載(approved by Heinz-Josef Lenz)
Nivolumab併用による有意なPFSの延長効果は示されなかった
195例のうち、127例がNIVO+SOC群に、68例がSOC群に割り付けられた。両群の患者背景は同様であった。NIVO+SOC群/SOC群の年齢中央値は58/56歳で、PS 1が40%/40%、左側原発大腸癌が60%/57%を占めていた。また、PD-L1発現陽性の腫瘍細胞を1%以上認める症例の割合は12%/9%、MSSの割合は95%/90%であった。治療継続期間の中央値はNIVO+SOC群が9.9ヵ月、SOC群が7.7ヵ月であった。データカットオフの時点(2021年2月1日)で両群ともに97%の症例が治療中止となっており、主な治療中止理由は病状進行であった。
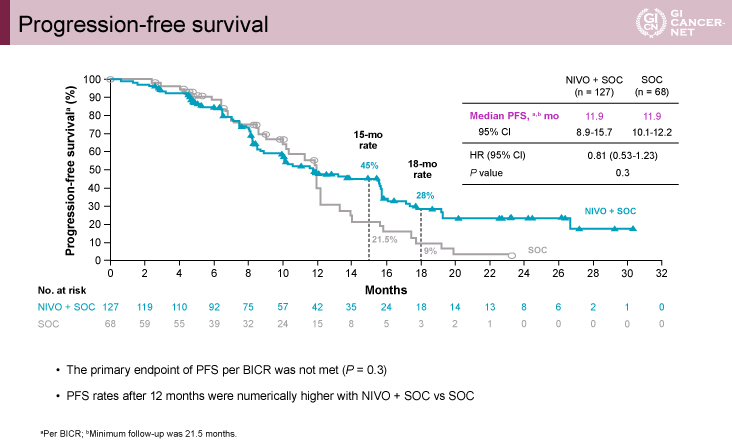
主要評価項目であるBICRによるPFSにおいて、NIVO+SOC群のSOC群に対する統計学的に有意な延長効果は示されなかった(PFS中央値11.9ヵ月vs. 11.9ヵ月、ハザード比[95%信頼区間]=0.81[0.53-1.23]、p=0.3)(図2)。12ヵ月時点までは両群のKaplan-Meier曲線が重なっていたが、12ヵ月以降は差が開き、NIVO+SOC群がより高いPFS割合を示した(15ヵ月PFS割合:45% vs. 21.5%、18ヵ月PFS割合:28% vs. 9%)。12ヵ月以降にNIVO+SOC群のPFSが上回る傾向は、MSSのみの集団でも同様であった。
発表者の許可を得て掲載(approved by Heinz-Josef Lenz)
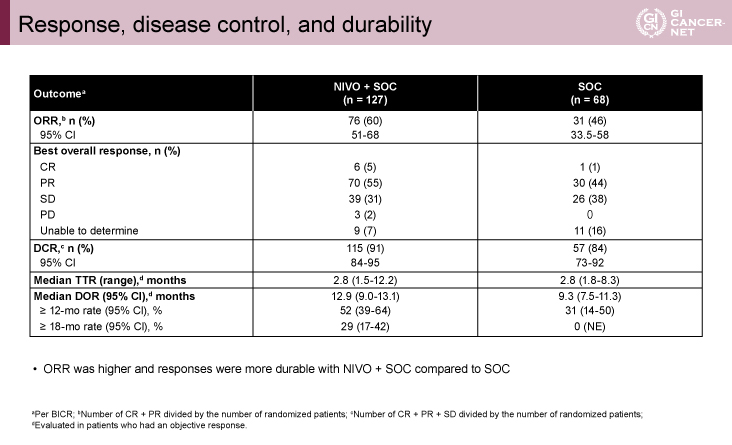
ORR(60% vs. 46%)とDOR中央値(12.9ヵ月vs. 9.3ヵ月)はNIVO+SOC群で良好な結果であった(表1)。OSは両群同等であった(中央値29.2ヵ月[NIVO+SOC群]vs. 未到達[SOC群]、ハザード比[95%信頼区間]=1.03[0.64-1.66])。しかし、最短観察期間が21.5ヵ月と短かったため、さらなるフォローアップが必要と考えられた。Grade 3または4の治療関連有害事象はNIVO+SOC群で多かったが(75% vs. 48%)、安全性に関する新たな問題は認められなかった。NIVO+SOC群では、免疫関連有害事象(All grade/grade 3または4)として、内分泌障害(22%/1%未満)、消化管障害(42%/13%)、肝障害(18%/5%)、肺障害(4%/2%)、腎障害(4%/0%)、皮膚障害(27%/3%)を認め、これらはSOC群よりも高頻度であった。
発表者の許可を得て掲載(approved by Heinz-Josef Lenz)
CMSとCD8陽性細胞についてのバイオマーカー解析
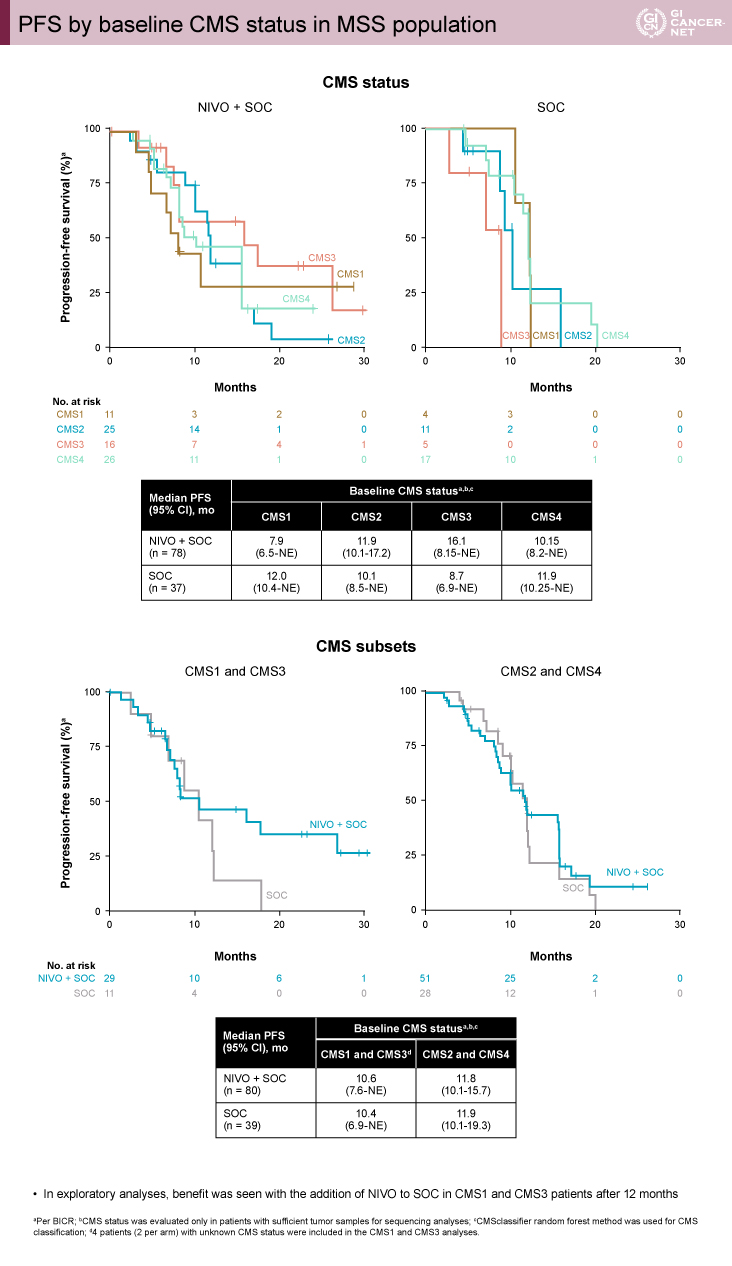
探索的なバイオマーカー解析として、MSS症例におけるベースラインのconsensus molecular subtype(CMS)とCD8陽性細胞レベルが検討された。その結果、CMS1またはCMS3、およびCD8陽性細胞高値(2%以上)のサブグループでは、NIVO+SOC群の12ヵ月以降のPFS割合がSOC群を上回っていた(図3、図4)。一方、CMS2またはCMS4、およびCD8陽性細胞低値(2%未満)のサブグループでは治療群によるPFSの差を認めなかった。
発表者の許可を得て掲載(approved by Heinz-Josef Lenz)
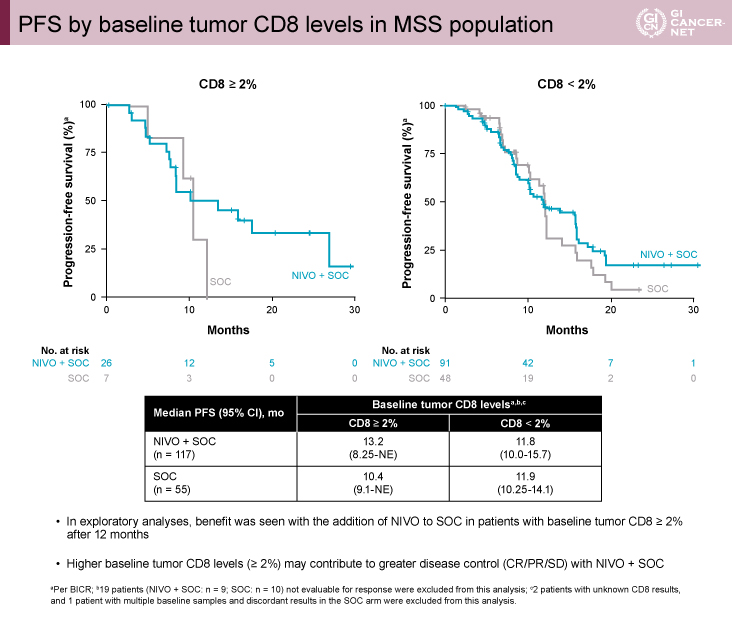
発表者の許可を得て掲載(approved by Heinz-Josef Lenz)
まとめ
mCRCの標準的一次化学療法にNivolumabを併用することでPFSは有意に延長しなかった。しかしながら、MSSの症例の中でもNivolumabを併用することのメリットが得られるサブグループが存在する可能性が示唆され、さらなる検討が必要であると考えられた。
(レポート:聖マリアンナ医科大学 臨床腫瘍学講座 新井 裕之)
References
- 1) Andre T, et al.: N Engl J Med. 383(23): 2207-2218, 2020 [PubMed]
- 2) Kang YK, et al.: Lancet. 390(10111): 2461-2471, 2017 [PubMed]
- 3) Janjigian YY, et al.: Lancet. 398(10294): 27-40, 2021 [PubMed]
- 4) Kang YK, et al.: Lancet Oncol. January 11, 2022 [Online ahead of print] [PubMed]
- 5) Cremolini C, et al.: ESMO Congress 2021. Abstract LBA20, 2021 [OncologyPRO]
- 6) Overman MJ, et al.: Lancet Oncol. 18(9): 1182-1191, 2017 [PubMed]
- 7) Overman MJ, et al.: J Clin Oncol. 36(8): 773-779, 2018 [PubMed]
- 8) Boland PM, et al.: Cancers (Basel). 9(5): 50, 2017 [PubMed]
関連サイト
- ・KEYNOTE-177試験 [論文紹介]
- ・ATTRACTION-2試験 [論文紹介] [学会レポート(ESMO 2018)] [学会レポート(ESMO 2017)]
- ・CheckMate 649試験 [学会レポート] [論文紹介]
- ・ATTRACTION-4試験 [学会レポート]
- ・Atezo TRIBE試験 [ClinicalTrials.gov]
- ・CheckMate 142試験 [学会レポート] [ClinicalTrials.gov]









砂川 優先生
聖マリアンナ医科大学 臨床腫瘍学講座 教授