胆道癌
進行胆道癌に対するGEM+CDDP+Durvalumab併用療法vs. GEM+CDDP併用療法の無作為化二重盲検プラセボ対照第III相試験(TOPAZ-1試験)
A phase 3 randomized, double-blind, placebo-controlled study of durvalumab in combination with gemcitabine plus cisplatin (GemCis) in patients (pts) with advanced biliary tract cancer (BTC): TOPAZ-1
Do-Youn Oh, et al.
Expert’s view
本試験では化学療法未治療の進行胆道癌患者を対象とし、研究計画時点での標準治療であるGemcitabine(GEM)+Cisplatin(CDDP)併用療法に対して抗PD-L1抗体であるDurvalumabの上乗せ効果を検証した第III相試験である。主要評価項目に設定された全生存期間(OS)のハザード比は0.80(95%信頼区間:0.66-0.97)と、統計学的に有意な延長が認められた。また、副次評価項目に設定された無増悪生存期間(PFS)のハザード比も0.75(95%信頼区間:0.63-0.89)と有意に延長していた。
ここ数年で、胆道癌に対する二次薬物療法として、いずれも海外で実施された臨床試験においてPemigatinib、Ivosidenib、modified FOLFOX、nal-IRI+5-FU/LVの有用性が示され、Pemigatinibは本邦でも承認された。しかし、対象となる患者は極めて限定的であり、本邦における日常臨床では依然、一次薬物療法が重要な位置づけを占めている。一次薬物療法として国内ではGEM+CDDP+S-1併用療法(MITSUBA試験)の有用性が示されており、今後、GEM+CDDP+Durvalumab併用療法との位置づけが議論されることになろう。
本年のASCO-GIでは本試験に加えて肝胆膵領域では、肝細胞癌領域で進行例に対する一次薬物療法のTremelimumab+Durvalumab(HIMALAYA試験)、二次薬物療法のアジアコホートを対象としたPembrolizumab(KEYNOTE-394試験)、胆道癌領域では術後補助化学療法としてのS-1(JCOG1202)、神経内分泌腫瘍領域では初の第III相試験であるIrinotecan/Cisplatin(IP)vs. Etoposide/Cisplatin(EP)(JCOG1213)と多くのpivotal試験が発表された。都合上、ここでは詳細を紹介できないものの、いずれもpractical changingなデータであり、日常診療に反映されることが期待される。
(コメント・監修:金沢大学 先進予防医学研究センター 特任准教授 寺島 健志)
進行胆道癌に対する一次化学療法
進行胆道癌に対する一次化学療法はGemcitabine(GEM)+Cisplatin(CDDP)併用療法が標準治療として広く実施されてきた1,2)。以前より胆道癌は免疫原性の強い癌種であることから、免疫療法の良い対象となる可能性が示唆され3,4)、二次化学療法では免疫チェックポイント阻害薬単剤の有効性が報告されてきた5)。PD-L1阻害薬Durvalumabは進行胆道癌に対する一次化学療法として第II相試験でpromisingな抗腫瘍効果を示すことがASCO 2020で報告された。今回、進行胆道癌の一次化学療法における免疫療法の化学療法に対する上乗せ効果の有用性を検証することを目的に第III相試験として本試験(TOPAZ-1試験)が実施された。
GEM+CDDP+Durvalumab併用療法とGEM+CDDP併用療法の無作為化第III相試験
本試験の主な適格基準は、1)病理組織学的に診断された進行胆道癌(局所進行または遠隔転移)(肝内胆管癌、肝外胆管癌、胆?癌)、2)初回診断時未治療例(局所進行、遠隔転移例)、3)根治切除または術後化学療法終了後から6ヵ月以上経過してからの再発例、4)ECOG PS 0-1であった。685例の登録患者をGEM+CDDP+Durvalumab併用療法群(GEM 1,000mg/m2 day 1,8、CDDP 25mg/m2 day 1,8、Durvalumab 1,500mg/body day 1 q3wksでGEM+CDDPは8サイクルまで、以後はDurvalumab 1,500mg/body day 1 q4wksを病勢増悪まで継続)とGEM+CDDP+プラセボ併用療法群(GEM 1,000mg/m2 day 1,8、CDDP 25mg/m2 day 1,8、プラセボday 1 q3wksでGEM+CDDPは8サイクルまで、以後はプラセボday 1 q4wksを病勢増悪まで継続)に1:1に割り付けた。層別化因子として、病勢(unresectable vs. recurrent)、部位(肝内胆管vs.肝外胆管vs.胆?)が設定された。主要評価項目は全生存期間(OS)、副次評価項目は無増悪生存期間(PFS)、奏効割合(ORR)(RECIST v1.1)、奏効持続期間、PD-L1 status別の有効性、安全性であった(図1)。本試験は事前に計画された中間解析においてOSの統計学的優越性が示されたため、本最終解析においてOSの統計学的優越性が示された場合にのみPFSの統計学的検定を行う手順で実施された。
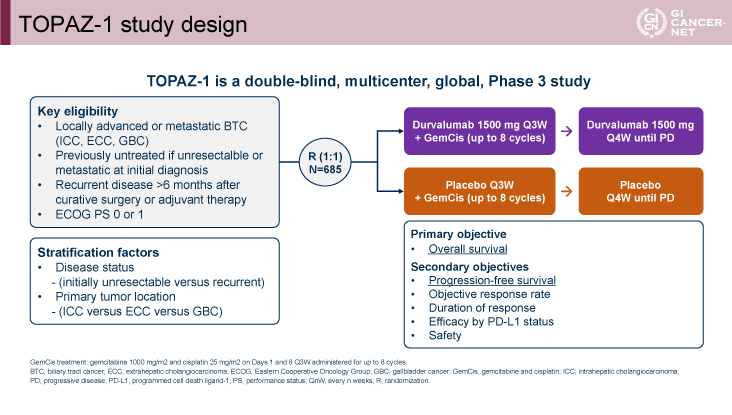
発表者の許可を得て掲載(approved by Do-Youn Oh)
GEM+CDDP+Durvalumab併用療法はGEM+CDDP併用療法に対して全生存期間における優越性を示した
本研究は本邦を含む世界17ヵ国で実施されたグローバル第III相試験であり、685例が登録され、GEM+CDDP+Durvalumab併用療法群に341例、GEM+CDDP併用療法群に344例が割り付けられた。両群の患者背景に有意な群間差は認められなかった。
主要評価項目のOSに関してはハザード比0.80(95%信頼区間:0.66-0.97、p=0.021)、OS中央値12.8ヵ月vs. 11.5ヵ月、12ヵ月OS率54.1% vs. 48.0%、24ヵ月OS率24.9% vs. 10.4%とGEM+CDDP+Durvalumab併用療法群で有意な延長効果が認められた(図2)。OSに関してはいずれのサブグループにおいてもGEM+CDDP+Durvalumab併用療法群で良好な傾向を示した(図3)。またVentana PD-L1(SP263)assayを用いたPD-L1 status別のサブグループ解析においても、TAP(tumor area positivity)score(CPS:combined positive scoreと同義)によらず、GEM+CDDP+Durvalumab併用療法群で良好な傾向を示した(図4)。
副次評価項目のPFSに関しては、ハザード比0.75(95%信頼区間:0.63-0.89、p=0.001)、PFS中央値7.2ヵ月vs. 5.7ヵ月、6ヵ月PFS率58.3% vs. 47.2%、12ヵ月PFS率16.0% vs. 6.6%とGEM+CDDP+Durvalumab併用療法群で有意な延長効果が認められた。またORRに関しては26.7% vs. 18.7%(オッズ比1.60、p=0.011)と、GEM+CDDP+Durvalumab併用療法群で高い傾向にあり、奏効持続期間に関しても12ヵ月時点における奏効割合26.1% vs. 15.0%とGEM+CDDP+Durvalumab併用療法群で長い傾向が認められた(図5)。
一方、有害事象に関してはgrade 3以上の治療関連副作用が62.7% vs. 64.9%と両群間に差を認めず、全免疫関連有害事象は12.7% vs. 4.7%とGEM+CDDP+Durvalumab併用療法群に多く認められたが、いずれも許容範囲内のものであった(図6)。
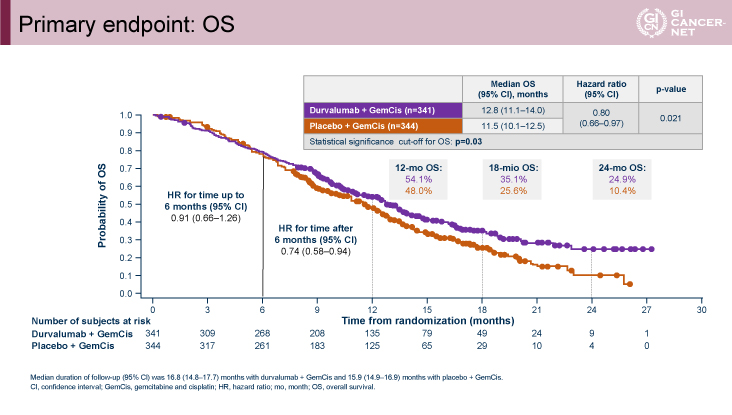
発表者の許可を得て掲載(approved by Do-Youn Oh)
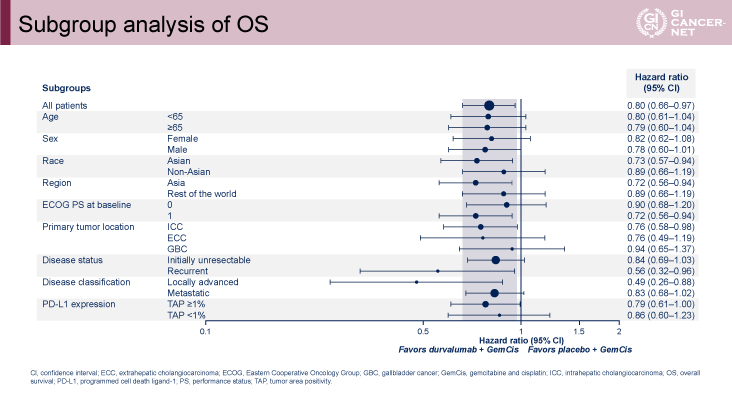
発表者の許可を得て掲載(approved by Do-Youn Oh)
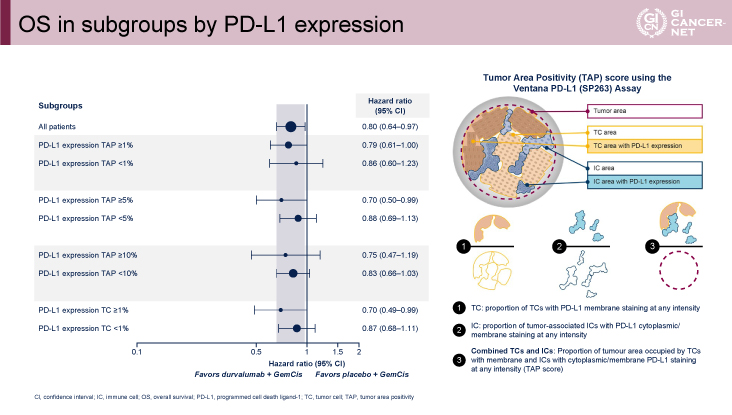
発表者の許可を得て掲載(approved by Do-Youn Oh)
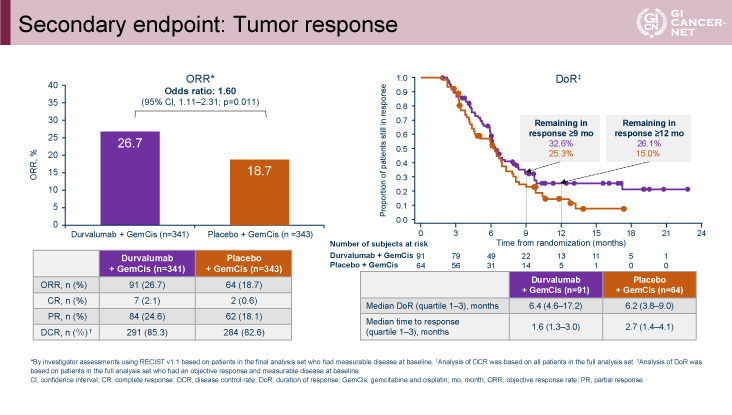
発表者の許可を得て掲載(approved by Do-Youn Oh)
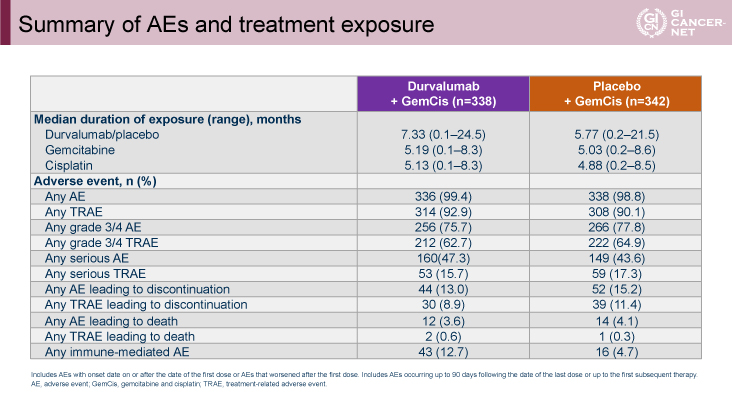
発表者の許可を得て掲載(approved by Do-Youn Oh)
まとめ
進行胆道癌に対する一次化学療法としてのGEM+CDDP+Durvalumab併用療法はGEM+CDDP療法に対し、生存期間における有意な延長効果を示した。GEM+CDDP+Durvalumab併用療法は進行胆道癌の一次化学療法における新たな標準治療になりうることが示唆された。
(レポート:慶應義塾大学病院 腫瘍センター 林 秀幸)
References
- 1) Valle J, et al.: N Engl J Med. 362(14): 1273-1281, 2010 [PubMed]
- 2) Okusaka T, et al.: Br J Cancer. 103(4): 469-474, 2010 [PubMed]
- 3) Fluxa P, et al.: BMC Cancer. 18(1): 243, 2018 [PubMed]
- 4) Kim R, et al.: Oncotarget. 9(34): 23366-23372, 2018 [PubMed]
- 5) Kim RD, et al.: JAMA Oncol. 6(6): 888-894, 2020 [PubMed]
関連サイト
- ・TOPAZ-1試験 [ClinicalTrials.gov]
- ・MITSUBA試験 [学会レポート] [UMIN-CTR]
- ・HIMALAYA試験 [ClinicalTrials.gov]
- ・KEYNOTE-394試験 [ClinicalTrials.gov]
- ・JCOG1202 [UMIN-CTR]
- ・JCOG1213 [UMIN-CTR]









寺島 健志先生
金沢大学 先進予防医学研究センター 特任准教授