切除不能局所進行または転移を有するFGFR2b高発現の胃・食道胃接合部癌に対するBemarituzumab+化学療法:FORTITUDE-101試験(第III相試験)
Bemarituzumab (BEMA) plus chemotherapy for advanced or metastatic FGFR2b-overexpressing gastric or gastroesophageal junction cancer (G/GEJC): FORTITUDE-101 phase 3 study results
Sun Young Rha, et al.
監修コメント
昨今の胃癌の治療はバイオマーカーに応じて分子標的薬を使用することが一般的である。その歴史はHER2をターゲットにしたTrastuzumabの成功までさかのぼるが、その後は、c-MetをターゲットにしたRILOMET-1試験、HER2をターゲットにしたJACOB試験やGATSBY試験など、数々の分子標的治療薬のネガティブ試験のオンパレードであった。その一方、近年のCLDN18.2をターゲットにしたZolbetuximabの成功により、FGFR2をターゲットにした抗体であるBemarituzumabの効果に期待が寄せられていた。胃癌におけるこのような試験の難しさは、胃癌組織の不均一性にも起因しており、1つの生検切片で得られた結果が全体の生物学的特性を必ずしも示さないというところで、どのような結果が出るか注目されていた。しかも、このFORTITUDE-101試験はESMOの前に、AMGEN社から“ポジティブな結果が得られた”とのプレスリリースが出されており、胃癌に新しい治療が出てくると皆思いながら発表を聞いていた。ところが、ふたを開けてびっくり。中間解析でHR=0.61であった差が、7.6カ月追跡期間を増やしただけで、HR=0.82と縮まり、有意差がなくなっていた。臨床試験としては、一応"positive“なのであるが、Discussantも言っていたように”Not Practical Changing“である。その原因としては、いくつかの可能性がある。1つは増殖経路を抑える薬にしては、奏効割合は両群で差がなく、ターゲティングとしてこの集団が妥当であったか?という疑問と、眼症状による毒性により、最初の効果があっても、なかなか治療を継続できないという薬剤ではなかったか?という点がある。2次治療の実施割合は両群で変わらないので、毒性のために2次治療が入らないというわけではない。PPSで追いつかれるということは、推測でしかないが、2次治療の有効性が両群によって違う可能性がある。Bevacizumabのように、前治療で投与後に、併用を継続しないと逆に有効性が落ちてしまう薬剤もある。そのようなことが起こっていないのか?など検討が必要である。
いずれにしてもFGFR2高発現10%集団に対するFGFR抗体は意味のある差を示せなかった。よりアディクションの強いFGFR増幅集団に絞ってみるのか?あるいは抗体ではなくADCに替えると、よい結果が得られるのか?ICIとの併用はどうなのか?など、次のステップが気になるところである。ちなみに、ICIとの併用試験であるFORTITUDE-102についてはESMO後に無効中止のプレスリリースが出された。FGFR2を標的にしたADCはすでに開発途中である。これだけ持ち上げられて落とされた薬剤も近年記憶にない。個人的には、ESMO 2025の一番の“事件”であったといっても過言ではなかった。
(コメント・監修:国立がん研究センター中央病院 消化管内科/頭頸部・食道内科 科長
加藤 健)
進行胃・食道胃接合部癌に対する新たな治療
進行胃・食道胃接合部癌において、FGFR2bの高発現が報告されている1,2)。BemarituzumabはFGFR2bを標的とした抗体薬である3)。第II相試験であるFIGHT試験において、Bemarituzumab+mFOLFOX6がFGFR2b高発現のHER2陰性胃・食道胃接合部癌に対して有望な有効性を示した4)。今回、第III相試験であるFORTITUDE-101試験(NCT05052801)の結果が報告された。
mFOLFOX6療法に対する、Bemarituzumab+mFOLFOX6の優越性を検証
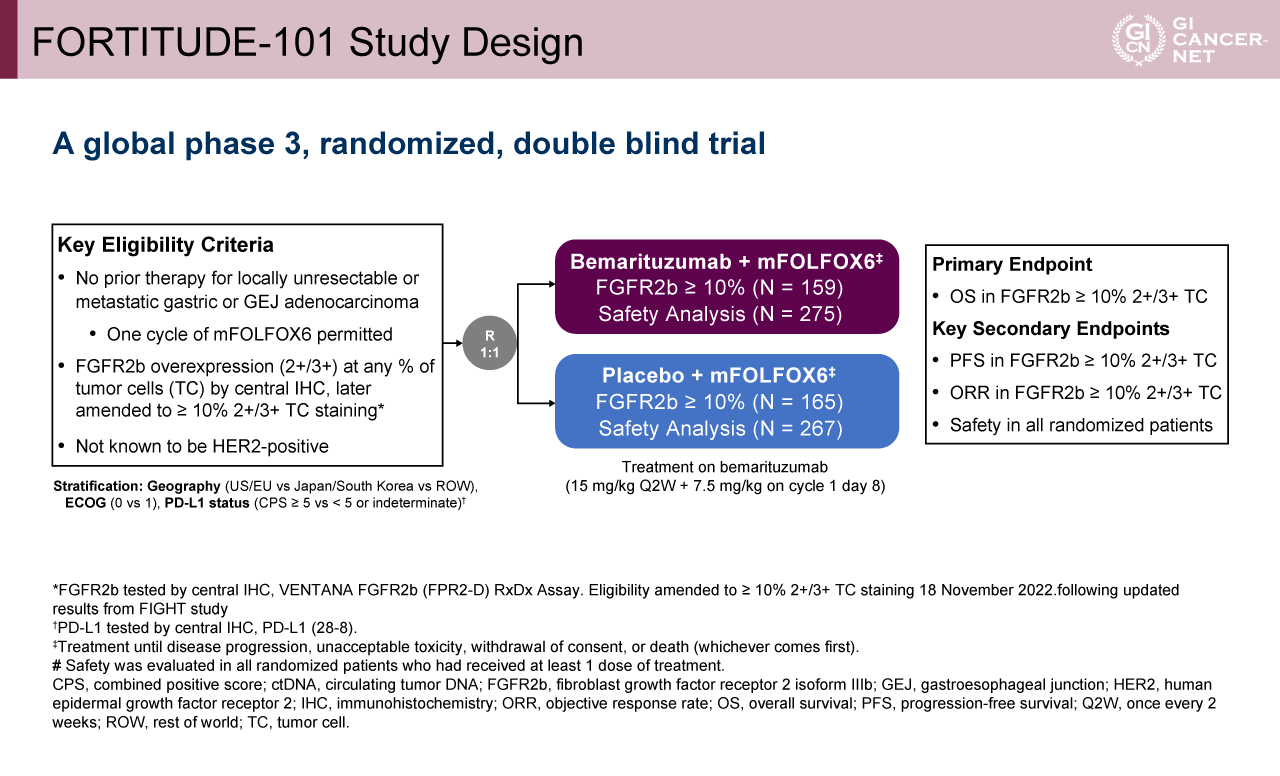
主な適格規準は、切除不能局所進行または転移を有し、FGFR2bが免疫染色で2+/3+と高発現した(後に腫瘍細胞の10%以上で高発現に適格性変更)、HER2陰性の未治療の胃・食道胃接合部腺癌であった。患者は、Bemarituzumab(15mg/kgを2週間おき、cycle 1 day 8には7.5mg/kg投与)とmFOLFOX6の併用群(Bemarituzumab群)と、プラセボとmFOLFOX6の併用群(プラセボ群)に1:1で無作為に割り付けられた。Bemarituzumab群には275例(FGFR2bが腫瘍細胞の10%以上で発現していたのは159例)、プラセボ群には267例(同165例)が割り付けられた。層別化因子は地域(米国/EU vs. 日本/韓国 vs. その他)、ECOG PS(0 vs. 1)、PD-L1発現(CPS 5以上 vs. 5未満/不明)であった。主要評価項目は腫瘍細胞の10%以上でFGFR2bが高発現の患者における全生存期間(OS)であり、副次評価項目は無増悪生存期間(PFS)、奏効率(ORR)、安全性であった(図1)。本試験では、OSにおいて90%の検出力でハザード比(HR)を0.64とした場合、214例の死亡イベントが必要とされた。必要なイベントの約70%が発生した時点で中間解析を実施することが事前に規定されていた。主要評価項目は中間解析の時点でmetされており、これが主要解析となったため、その後の有効性の解析は記述的なものにとどまるとされた。
図1 FORTITUDE-101 Study Design(発表者の許可を得て掲載)
中間解析ではOSの有意な延長を示したが、フォローアップの結果では有意差を認めず
年齢の中央値は62歳で約60%がECOG PS 1であった。年齢、性別、ECOG PS、原発部位、PD-L1 CPS発現などの背景因子は両群で概ね一致していた(表1)。追跡期間中間値11.8カ月時点の解析(中間解析)では、腫瘍細胞の10%以上でFGFR2b高発現の患者におけるOS中央値がBemarituzumab群で17.9カ月、プラセボ群で12.5カ月であり、Bemarituzumab群で有意に良好であった(HR[95% CI]=0.61[0.43-0.86]、p=0.005)(図2)。OSのサブグループ解析では一貫してBemarituzumab群で良好な傾向を認めた。腫瘍細胞の10%以上でFGFR2b高発現の患者におけるPFS中央値は、Bemarituzumab群で8.6カ月、プラセボ群で6.7カ月とBemarituzumab群で良好であった(HR[95% CI]=0.71[0.53-0.95]、p=0.019)(図3)。Bemarituzumab群とプラセボ群におけるORRはそれぞれ45.9%、44.8%(p=0.90)、奏効期間中央値は7.0カ月、5.8カ月であった。
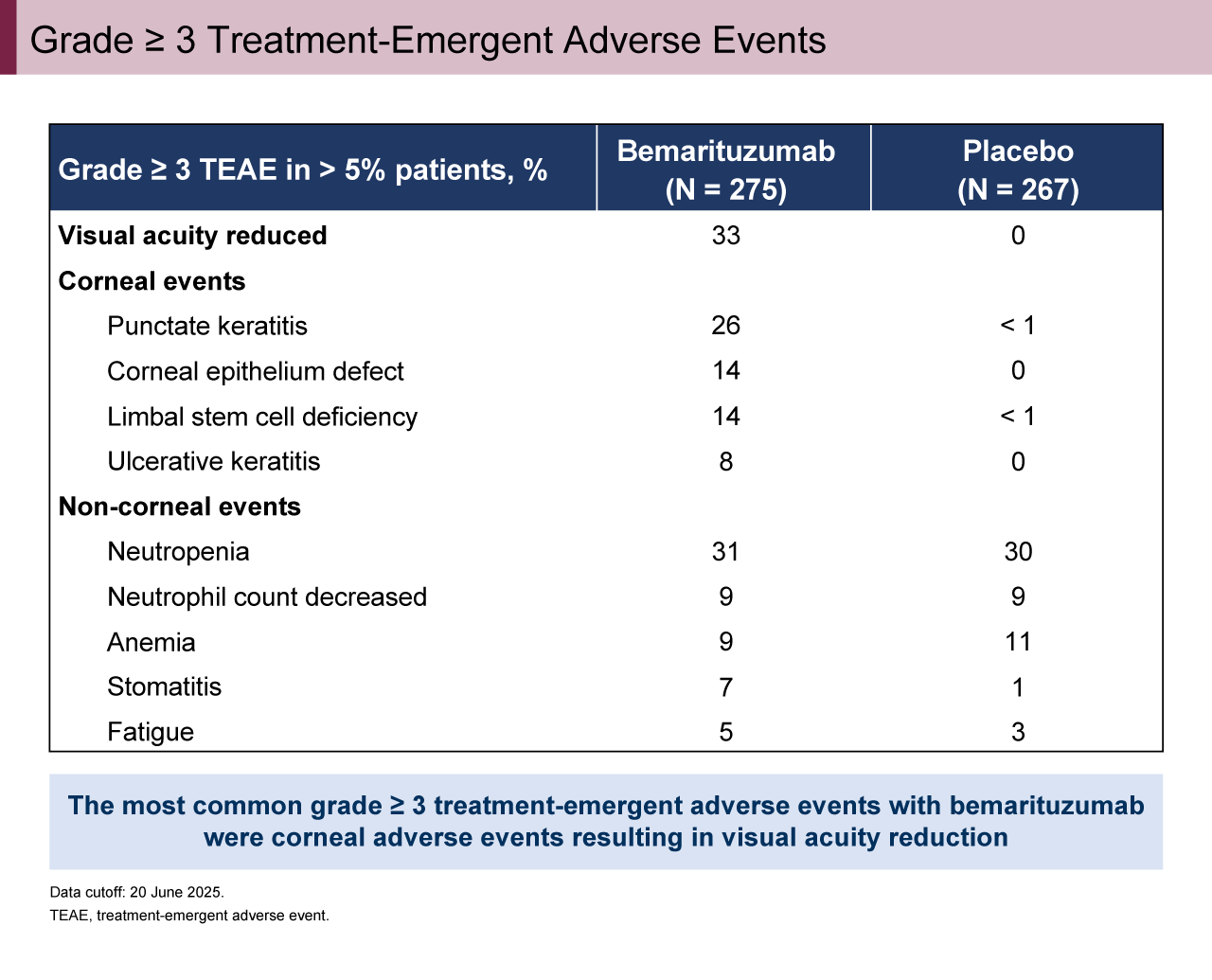
一方、追跡期間中央値19.4カ月時点(フォローアップ解析)では、OS中央値がBemarituzumab群14.5カ月、プラセボ群13.2カ月であり、両群で有意差は認められなかった(HR[95% CI]=0.82[0.62-1.08])(図4)。有害事象に関しては、grade 3以上の治療関連有害事象をBemarituzumab群で60%、プラセボ群で18%に認めた(表2)。Bemarituzumab群で最も頻度の高かったgrade 3以上の有害事象は角膜障害に伴う視力低下(33%)であった(表3)。17週以上眼障害をフォローアップされたBemarituzumab群患者において、grade 3以上の角膜障害の90%がgrade 1以下に改善した。
表1 Baseline Characteristics(発表者の許可を得て掲載)
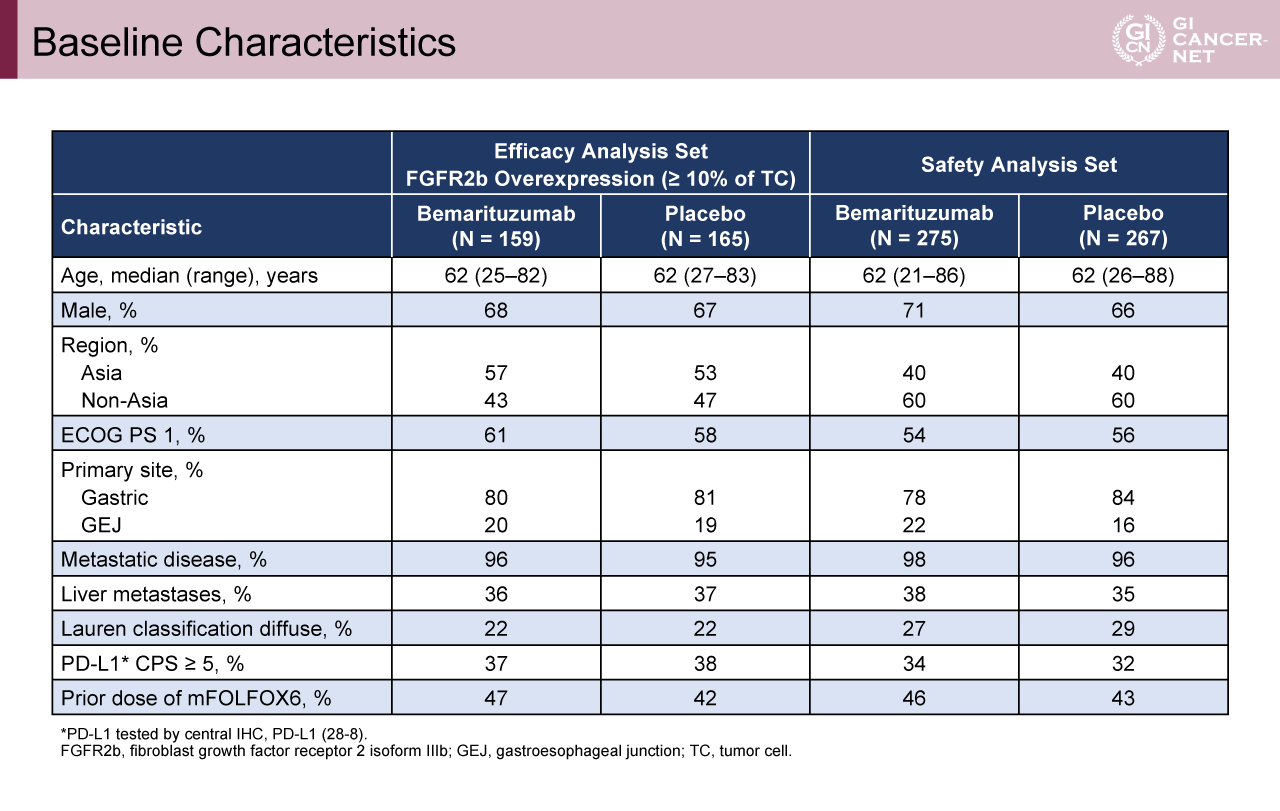
図2 Primary Analysis: Overall Survival(発表者の許可を得て掲載)
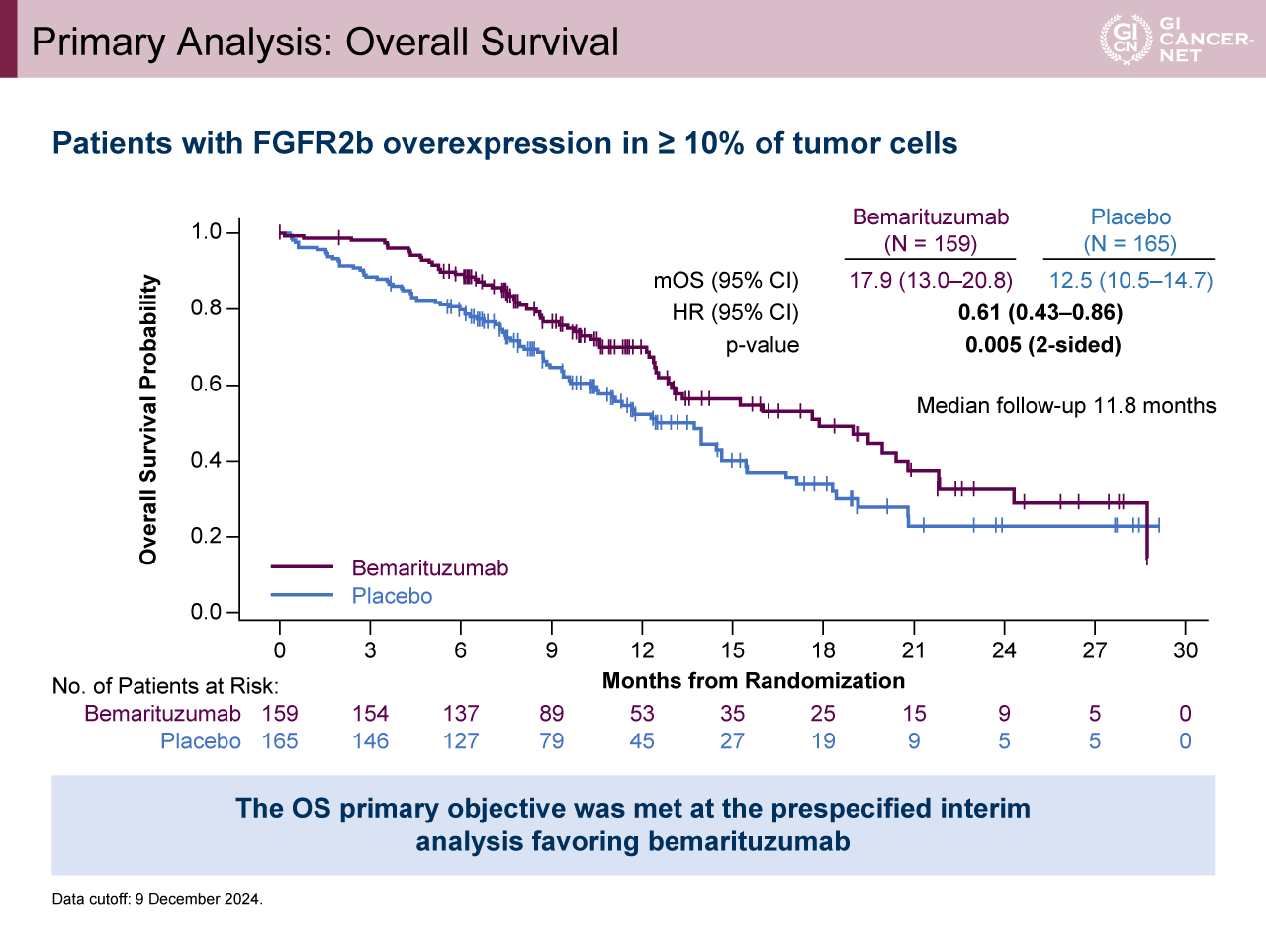
図3 Primary Analysis: Progression-Free Survival and Response(発表者の許可を得て掲載)
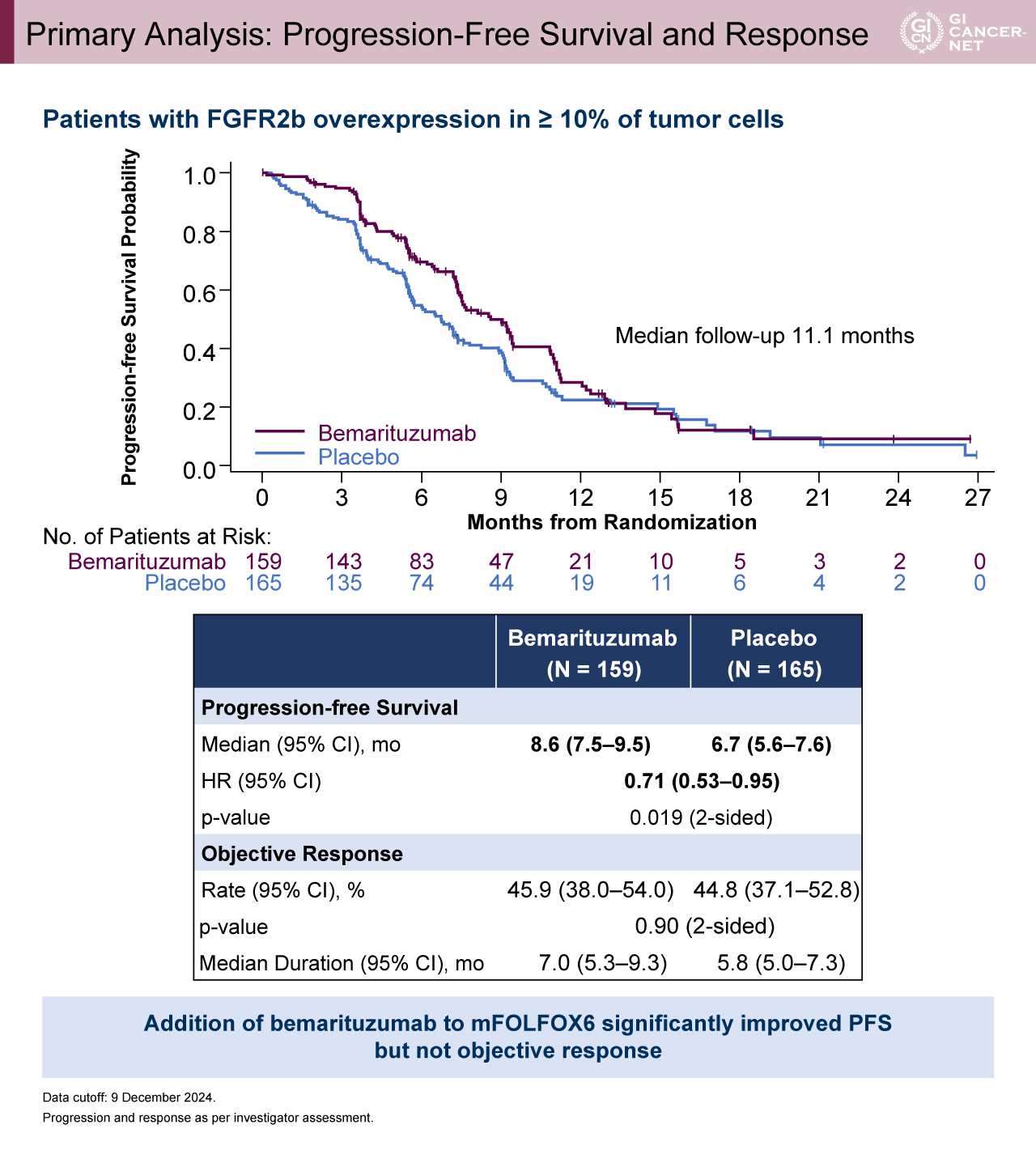
図4 Descriptive Follow-Up Analysis: Overall Survival(発表者の許可を得て掲載)
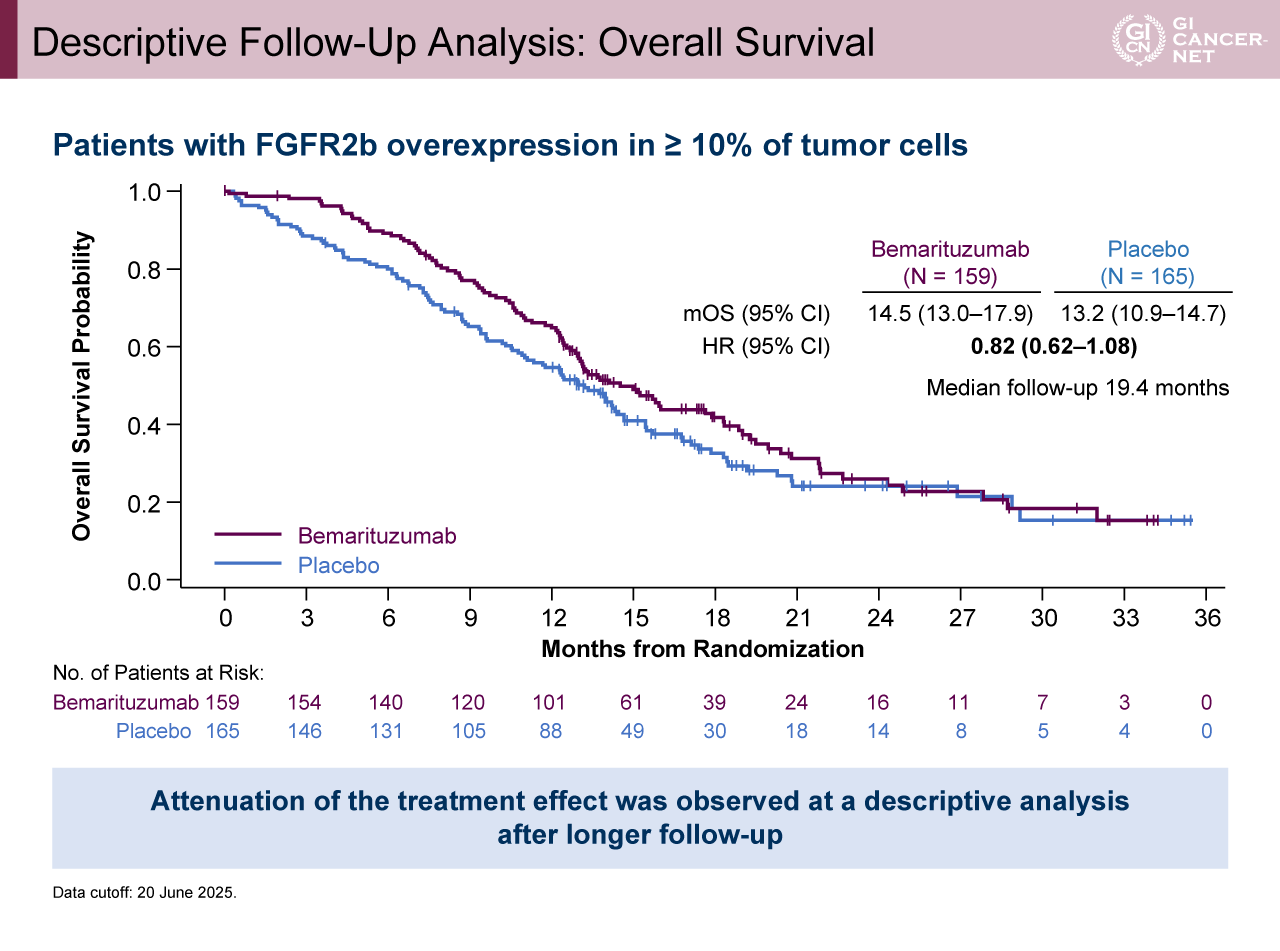
表2 Summary of Safety(発表者の許可を得て掲載)
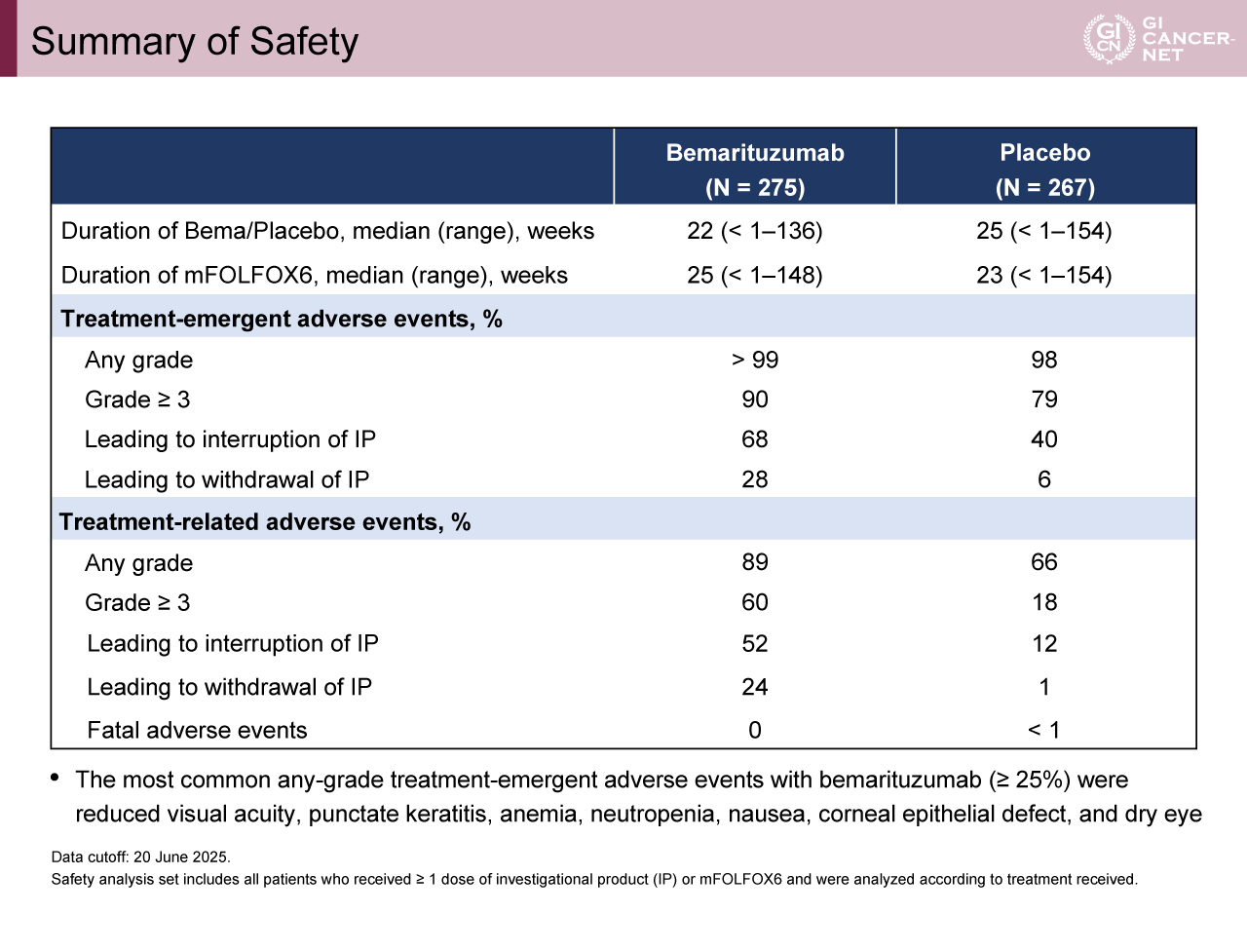
表3 Grade ≥ 3 Treatment-Emergent Adverse Events(発表者の許可を得て掲載)
まとめ
FGFR2b高発現患者において、OS(主要評価項目)およびPFS(副次評価項目)はmetした。しかし、中間解析で観察されたOSベネフィットは、その後のフォローアップ解析において減弱した。Bemarituzumabによる有害事象として角膜障害に伴う視力低下を認めたが、そのほとんどが可逆的であった。本試験およびFORTITUDE-102試験の結果により、進行胃・食道胃接合部癌におけるBemarituzumabの有効性、安全性がさらに明らかとなることが期待される。
(レポート:国立がん研究センター中央病院 消化管内科 小倉 望)
References
- 1) Wainberg ZA, et al.: Lancet Oncol. 23(11): 1430-1440, 2022 [PubMed]
- 2) Rha SY, et al.: JCO Precis Oncol. 9: e2400710, 2025 [PubMed]
- 3) Xiang H, et al.: MAbs. 13(1): 1981202, 2021 [PubMed]
- 4) Wainberg ZA, et al.: Gastric Cancer. 27(3): 558-570, 2024 [PubMed]
関連サイト
- ・FORTITUDE-101試験[ClinicalTrials.gov]
- ・FORTITUDE-102試験[ClinicalTrials.gov]
- ・FIGHT試験[ClinicalTrials.gov][論文紹介]
- ・RILOMET-1試験[ClinicalTrials.gov][論文紹介][ASCO 2015学会レポート][ASCO GI 2015学会レポート]
- ・JACOB試験[ClinicalTrials.gov][論文紹介][ESMO 2017学会レポート]
- ・GATSBY試験[ClinicalTrials.gov][論文紹介]

加藤 健 先生
国立がん研究センター中央病院 消化管内科/頭頸部・食道内科 科長