膵癌
Prep-02/JSAP-05試験:切除可能膵癌に対するGemcitabine+S-1併用術前化学療法の第II/III相試験
Randomized phase II/III trial of neoadjuvant chemotherapy with gemcitabine and S-1 versus upfront surgery for resectable pancreatic cancer (Prep-02/JSAP-05)
Michiaki Unno, et al.
Expert’s view
膵癌術前化学療法の有効性を検証する第II/III相試験が、Prep/JSAPグループを代表して、東北大学・海野先生より報告された。2018年ASCOでは、膵癌modified FOLFIRINOXによる術後補助療法の有用性が検証されたが1)、引き続いての膵癌周術期治療のエビデンスである。本試験では、ハザード比0.72、95%信頼区間0.55?0.94とGS(Gemcitabine+S-1)術前化学療法の優越性が検証された。術前化学療法には、転移病巣の縮小など腫瘍縮小効果が期待されるだけでなく、転移病巣の表在化など、予後不良症例の除外効果も期待される。本試験において、術前化学療法群でpN1症例が少なかったこと、治癒切除割合が高かったことから、GS療法で腫瘍縮小効果が得られたものと考えられる。サブグループ解析において、比較的均等に、術前化学療法群の治療成績が良好であり、切除可能境界域膵癌だけでなく、切除可能膵癌全般のエビデンスが得られた。今回は、S-1を含むエビデンスであるため、日本あるいはアジアに限られた治療と考えられがちだが、今後、膵癌周術期治療開発は、術後補助療法から、術前化学療法の時代に移行していくと思われた。
(コメント・監修:神奈川県立がんセンター 消化器内科 医長 上野 誠)
切除可能膵癌における術前化学療法
膵癌は予後不良な癌種として知られており、根治切除(R0/R1)ができたとしても、術後再発は稀でなく、再発予防のための治療が不可欠である。切除可能膵癌に対する標準治療はJASPAC 01の結果から、本邦ではS-1単独療法による術後補助化学療法が標準治療であった2)。しかし、膵癌の術後は全身状態の低下により、十分な補助化学療法を行えないこともあるため、術前補助化学療法の開発が期待された。Prep-01試験はGemcitabineとS-1の併用療法(GS療法)による術前化学療法の単群第II相試験であり、2年生存割合が74.6%と有望な結果が得られた3)。このため、術前GS療法の有効性を検証するための本試験が行われた。
術前GS療法とupfront surgeryの無作為化比較第II/III相試験
主な適格規準は、1)未治療、かつ組織学的に膵管癌であると診断されている、2)画像評価によって切除可能と診断されている、3)動脈合併切除を行わずにR0/R1切除が可能と判断されている(T1-3, N0-1)、4)根治的切除術に忍容可能と判断される、5)ECOG PS 0/1、6)20~79歳までで、本人による文書同意が得られていることであった。登録患者を、術前補助化学療法としてGS療法(GEM:1,000mg/m2 day 1,8、S-1:40mg/m2・1日2回・14日間、21日サイクル)を2コース行うNAC-GS群とupfront surgery群とに1:1に割り付けた。術後は、これまでの標準治療である6ヵ月間のS-1単独療法を、術後10週以内に開始することとした。主要評価項目は全生存期間、副次評価項目は安全性、切除割合、無再発生存期間、腫瘍残存状況、リンパ節転移、腫瘍マーカー動態とした。2年生存割合をupfront surgery群35%、NAC-GS群50%と仮定し、α=0.05、検出力0.80として、各群163例ずつの患者登録が必要と算出された。
NAC-GS群が有意に全生存期間の延長を示す
第II相試験パートにおいて、切除割合が93%と良好であったため、引き続き第III相試験へと移行した。2013年1月から2016年1月までの期間に364例が登録され、各群182例ずつが割り付けられた。Upfront surgery群のうち、2例は不適格のため除外され、計362例が解析対象となった。NAC-GS群/upfront surgery群の主な患者背景は、65歳以上が66.5%/60.0%、ECOG PS 0が96.7%/94.4%、cT3が71.4%/73.3%、cN1が21.4%/21.7%であった。治癒切除が行われたのは、NAC-GS群が140人、upfront surgery群が129人であった。全生存期間中央値は、NAC-GS群が36.72ヵ月、upfront surgery群が26.65ヵ月であり、ハザード比は0.72(95%信頼区間:0.55-0.94、p=0.015)であった(図1)。また2年生存割合はそれぞれ、63.7%および52.5%であった。
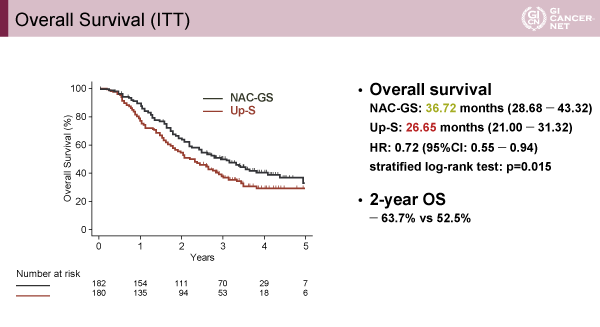
発表者の許可を得て掲載(approved by Michiaki Unno)
Forrest plotでは、いずれの背景因子においても一貫してNAC-GS群が予後良好であった。病理学的リンパ節転移陽性率(pN1)はNAC-GS群で59.6%に対してupfront surgery群で81.5%であった。NAC-GS療法中のGrade 3/4の有害事象は72.7%に認められ、その主な内訳は血液毒性では好中球減少(57.6%)、白血球減少(30.8%)が多く、非血液毒性では皮疹(8.7%)、食欲不振(7.6%)、発熱性好中球減少症6.4%の順であった。
まとめ
切除可能膵癌に対するGS併用療法による術前補助化学療法は、統計学的有意に生存期間の延長を示し、新たな標準治療になりうると考えられる。
(レポート:神奈川県立がんセンター 消化器内科 小林 智)
References
- 1) Conroy T, et al.: ASCO 2018 Abstract #LBA4001 [学会レポート]
- 2) Uesaka K, et al.: Lancet. 388(10041): 248-257, 2016 [PubMed]
- 3) Motoi F, et al.: J Gastroenterol. Sep 4, 2018 [Epub ahead of print]







上野 誠先生
神奈川県立がんセンター
消化器内科 医長