大腸癌
大腸癌肝転移切除例に対するL-BLP25の有効性を検討する多施設共同二重盲検プラセボ対照無作為化第II相試験(LICC試験)
A randomized, double-blinded, placebo-controlled multicenter phase II trial of adjuvant immunotherapy with tecemotide (L-BLP25) after R0/R1 hepatic colorectal cancer metastasectomy (LICC): Final results
Carl Christoph Schimanski, et al.
Expert’s view
MUC1は治療標的として有望な癌抗原であり、これを標的とした免疫治療薬であるL-BLP25の有効性、および前治療としてのCyclophosphamideによる制御性T細胞への抑制作用に基づく腫瘍免疫の活性効果も期待された。しかしながら、プラセボを対象とした本試験で有効性を示すことができなかった。一方、得られた全生存期間中央値の65.1ヵ月という値は、CELIM(53.9ヵ月)1)、FIRE-3(56.2ヵ月)2)と比較し良好な結果であり、本試験で行われた綿密なサーベイランスが生存への寄与に有効であった可能性が考えられた。
(コメント・監修:静岡県立静岡がんセンター 消化器内科 医長 山﨑 健太郎)
L-BLP25は癌抗原であるMUC1を標的とした免疫治療薬である
L-BLP25は癌抗原の一つであるMUC1を標的とした免疫治療薬である。MUC1の細胞外ドメインによる免疫抑制作用により、MUC1は腫瘍細胞の増殖を促すため、MUC1を標的とした免疫治療は重要なアプローチと考えられている。L-BLP25はリポソームを基盤として作製され、リポソームを介したドラッグデリバリーは抗原提示細胞の腫瘍抗原の取り込みを促進する。さらに、L-BLP25はCD4陽性T細胞の増殖とMUC1陽性細胞を攻撃する細胞障害性T細胞を誘導するため、MUC1を発現する細胞に免疫応答を誘導する有望な薬剤と考えられる。LICC(L-BLP25 In Colorectal Cancer)試験3)は、大腸癌肝転移に対しR0/R1切除が実施された症例を対象に、L-BLP25の有効性を検討した多施設共同二重盲検プラセボ対照無作為化第II相試験であり、今回、その試験結果が発表された。
無再発生存期間、3年生存割合を主要評価項目としてL-BLP25の有効性を検討
対象は、組織学的に腺癌と診断された肝転移を有する、根治切除を目的として原発巣および転移巣を切除(R0/R1)されたStage IVの大腸癌である。術前補助化学療法の治療歴がなく、PS 0-1が適格とされた。
投与方法は、試験群は前治療としてCyclophosphamide単剤療法300mg/m2、を投与し、その後L-BLP25 930μgを導入療法として毎週投与(8週間)、維持療法として6週毎投与(2年間)した。対照群はプラセボが投与された。治療は再発もしくは維持療法開始から3年経過するまで継続され、フォローアップ期間中は、6週毎にCT/MRIで評価された。
主要評価項目は、無再発生存期間(RFS)、3年生存割合(OS)で、副次評価項目は安全性、MUC1の発現に基づくRFSおよびOSと設定された。
L-BLP25群はOS/RFSともに有効性を示せなかった
133例が登録され(ITT population)、L-BLP25群に79例、対照群に42例が2:1に無作為化された。病変の残存、プロトコル逸脱などを理由として、L-BLP25群から18例、対照群から9例が除外された。患者背景は、年齢中央値はL-BLP25群60.0歳、対照群58.5歳で、性別、診断時病期、肝転移切除個数、R0/R1切除率に偏りを認めなかった。ECOG PS(0/1)はL-BLP25群77.2%/22.8%、対照群57.1%/42.9%と、L-BLP25群にPS 0の患者が多く含まれていた。MUC1の発現(Low/Moderate/Strong/Not evaluable/Missing)はL-BLP25群13.9%/38.0%/27.8%/20.3%/0%、対照群11.9%/42.9%/23.8%/19.0%/2.4%と2群間に偏りを認めなかった。
主要評価項目のRFS中央値はL-BLP25群6.1ヵ月、対照群11.4ヵ月(p=0.1754)(図1)、全生存期間中央値はL-BLP25群62.8ヵ月、対照群未到達(p=0.2141)(図2)、それぞれ2群間に統計学的有意差は認められないものの、L-BLP25群において治療成績は不良な傾向にあった。MUC1の発現強度に応じて、RFS、OSの解析がなされたが明らかな群間差を認めなかった(図3)。
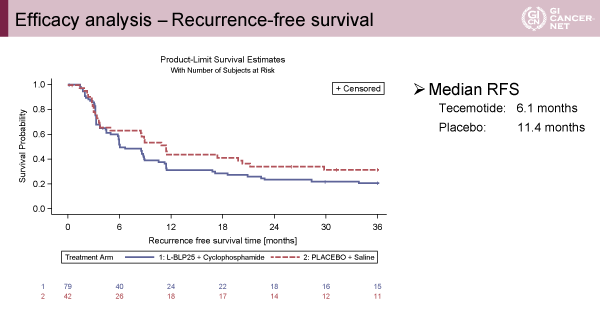
発表者の許可を得て掲載(approved by Carl Christoph Schimanski)
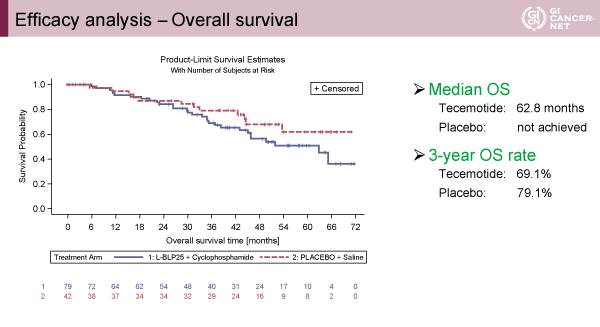
発表者の許可を得て掲載(approved by Carl Christoph Schimanski)
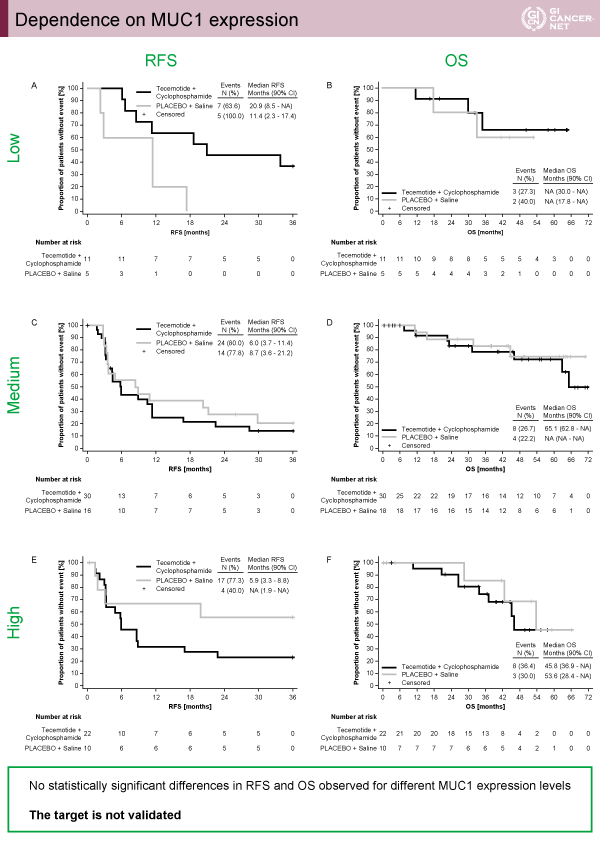
発表者の許可を得て掲載(approved by Carl Christoph Schimanski)
安全性の評価は、Any Gradeの有害事象は、L-BLP25群vs. 対照群でそれぞれ、悪心30.4% vs. 19.0%、倦怠感24.1% vs. 19.0%、下痢19.0% vs. 16.7%であった。Grade 3以上の有害事象は、L-BLP25群で下痢2例、貧血2例、胆?炎1例、腸閉塞2例、背部痛2例、対照群で下痢2例、胆?炎2例などであった。
結語
MUC1を標的とした免疫治療薬であるL-BLP25はプラセボと比較し大腸癌肝転移治癒切除例のRFSおよびOSを改善できなかった。また、MUC1の発現程度と治療成績には相関を認めなかった。
(レポート:九州がんセンター 消化管・腫瘍内科 中野 倫孝)







山﨑 健太郎先生
静岡県立静岡がんセンター 消化器内科 医長